名校
1 . 水合肼 在储氢领域有广阔的应用前景,其水溶液呈弱碱性。
在储氢领域有广阔的应用前景,其水溶液呈弱碱性。
(1) 分子有顺式、反式和交互式三种比较稳定的空间构型。下列结构能表示
分子有顺式、反式和交互式三种比较稳定的空间构型。下列结构能表示 分子交互式的是
分子交互式的是_______ (填序号)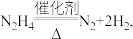 肼的理论储氢密度
肼的理论储氢密度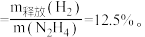 测得肼实际分解时产生的气体中含
测得肼实际分解时产生的气体中含 肼实际储氢密度小于理论值的原因是
肼实际储氢密度小于理论值的原因是_______ (用化学方程式表示)。
(3)水合肼制氢过程中涉及肼在 催化剂表面分解,如图所示。
催化剂表面分解,如图所示。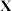 的结构简式为
的结构简式为_______ 。
②催化剂表面存在 和
和 两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于
两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于_______ (填“ ”或“
”或“ ”)活性位点。已知:
”)活性位点。已知: 键、
键、 键的键能分别是
键的键能分别是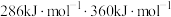 。肼在该催化剂表面反应断裂的化学键不是
。肼在该催化剂表面反应断裂的化学键不是 键,而是
键,而是 键,原因是
键,原因是_______ 。
③催化剂存在下,不同浓度的 分解时,测得
分解时,测得 随时间的变化如下图所示。当
随时间的变化如下图所示。当 浓度从
浓度从 增加到
增加到 时,反应速率加快;从
时,反应速率加快;从 增加到
增加到 时,反应速率几乎不变。其原因是
时,反应速率几乎不变。其原因是_______ 。
 在储氢领域有广阔的应用前景,其水溶液呈弱碱性。
在储氢领域有广阔的应用前景,其水溶液呈弱碱性。(1)
 分子有顺式、反式和交互式三种比较稳定的空间构型。下列结构能表示
分子有顺式、反式和交互式三种比较稳定的空间构型。下列结构能表示 分子交互式的是
分子交互式的是
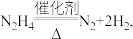 肼的理论储氢密度
肼的理论储氢密度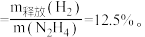 测得肼实际分解时产生的气体中含
测得肼实际分解时产生的气体中含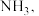 肼实际储氢密度小于理论值的原因是
肼实际储氢密度小于理论值的原因是(3)水合肼制氢过程中涉及肼在
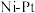 催化剂表面分解,如图所示。
催化剂表面分解,如图所示。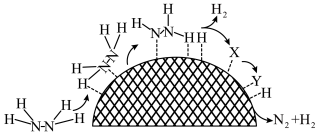
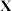 的结构简式为
的结构简式为②催化剂表面存在
 和
和 两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于
两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于 ”或“
”或“ ”)活性位点。已知:
”)活性位点。已知: 键、
键、 键的键能分别是
键的键能分别是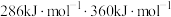 。肼在该催化剂表面反应断裂的化学键不是
。肼在该催化剂表面反应断裂的化学键不是 键,而是
键,而是 键,原因是
键,原因是③催化剂存在下,不同浓度的
 分解时,测得
分解时,测得 随时间的变化如下图所示。当
随时间的变化如下图所示。当 浓度从
浓度从 增加到
增加到 时,反应速率加快;从
时,反应速率加快;从 增加到
增加到 时,反应速率几乎不变。其原因是
时,反应速率几乎不变。其原因是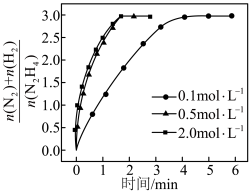
您最近一年使用:0次
昨日更新
|
55次组卷
|
2卷引用:江苏省无锡市锡东高级中学2023-2024学年高三下学期5月月考化学试题
名校
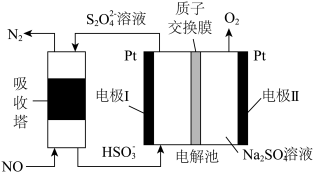
2 . 利用成对电合成即在阴阳两极同时得到有用的产物可提高电流效率和降低成本,如图是利用成对电合成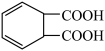 和
和 原理示意图。下列说法正确的是
原理示意图。下列说法正确的是
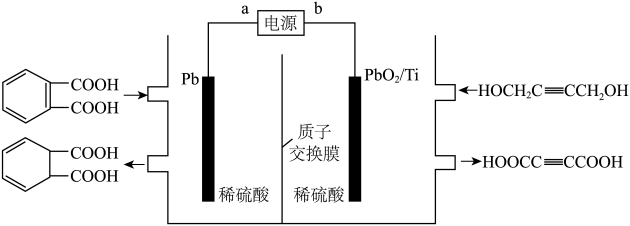
| A.a为直流电源的正极 |
B. 通过质子交换膜向右侧移动,右侧溶液pH下降 通过质子交换膜向右侧移动,右侧溶液pH下降 |
C.理论上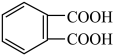 与 与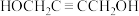 消耗的物质的量之比为 消耗的物质的量之比为 |
D.若使用铅酸蓄电池作电源,则每生产1mol 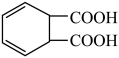 ,消耗98g ,消耗98g |
您最近一年使用:0次
7日内更新
|
117次组卷
|
3卷引用:广西桂林市第十八中学2023-2024学年高三下学期5月月考化学试卷
名校
解题方法
3 . 钴广泛应用于机械制造、电子电器、航空航天、电池制造等行业,是国家重要的战略资源。用含钴废料(主要成分为 ,含少量
,含少量 、
、 、CaO、MgO、
、CaO、MgO、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的工艺流程如图所示,试回答下列问题:
)的工艺流程如图所示,试回答下列问题:
① 具有强氧化性。
具有强氧化性。
② ,
, 。
。
(1)为提高含钴废料的浸出效率,可采取的措施是___________ (任写一条)。
(2) 在水溶液中的电离方程式为
在水溶液中的电离方程式为___________ ;浸出渣的主要成分为___________ (填化学式)。
(3)向“浸出液”中加入适量的 时,
时, 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4)①“除钙镁”后,滤液中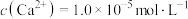 时,
时,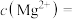
___________  。
。
②若“调pH”时溶液的pH偏低,将会导致 、
、 沉淀不完全,其原因是
沉淀不完全,其原因是___________ 。
(5)将 在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知:
在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知: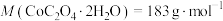 ,曲线中330℃及以上所得固体均为钴氧化物]
,曲线中330℃及以上所得固体均为钴氧化物] ,此过程中发生反应的化学方程式为
,此过程中发生反应的化学方程式为___________ 。
 ,含少量
,含少量 、
、 、CaO、MgO、
、CaO、MgO、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的工艺流程如图所示,试回答下列问题:
)的工艺流程如图所示,试回答下列问题: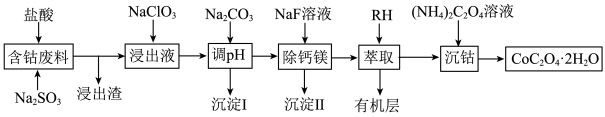
①
 具有强氧化性。
具有强氧化性。②
 ,
, 。
。(1)为提高含钴废料的浸出效率,可采取的措施是
(2)
 在水溶液中的电离方程式为
在水溶液中的电离方程式为(3)向“浸出液”中加入适量的
 时,
时, 发生反应的离子方程式为
发生反应的离子方程式为(4)①“除钙镁”后,滤液中
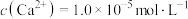 时,
时,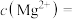
 。
。②若“调pH”时溶液的pH偏低,将会导致
 、
、 沉淀不完全,其原因是
沉淀不完全,其原因是(5)将
 在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知:
在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知: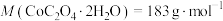 ,曲线中330℃及以上所得固体均为钴氧化物]
,曲线中330℃及以上所得固体均为钴氧化物]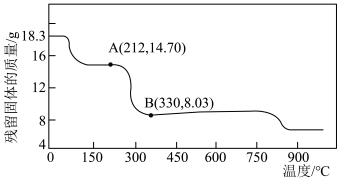
 ,此过程中发生反应的化学方程式为
,此过程中发生反应的化学方程式为
您最近一年使用:0次
7日内更新
|
204次组卷
|
5卷引用:河南省许昌高级中学2023-2024学年高三下学期5月月考化学试题
4 . 减少 的排放、捕集并利用
的排放、捕集并利用 是我国能源领域的一个重要战略方向。
是我国能源领域的一个重要战略方向。
在 加氢合成甲醇的体系中,同时存在以下反应:
加氢合成甲醇的体系中,同时存在以下反应:
反应i:
 kJ/mol
kJ/mol
反应ii:
 kJ/mol
kJ/mol
(1)反应iii: 的
的
___________ 。
(2)在 加氢合成甲醇的体系中,下列说法不正确的是___________(填序号)。
加氢合成甲醇的体系中,下列说法不正确的是___________(填序号)。
(3)某温度下,向容积恒为1 L的密闭容器中通入1 mol 和5 mol
和5 mol  ,10 min后体系达到平衡,此时
,10 min后体系达到平衡,此时 的转化率为20%。
的转化率为20%。 的选择性为50%。[已知:
的选择性为50%。[已知: 的选择性:
的选择性: ]
]
①反应i的平衡常数
___________ (写出计算式即可)。
②反应ii的净速率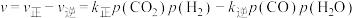 ,其中
,其中 、
、 分别为正、逆反应的速率常数,p为气体的分压。降低温度时,
分别为正、逆反应的速率常数,p为气体的分压。降低温度时,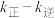
___________ (填“增大”“减小”或“不变”)。
③其他条件相同时,反应温度对 的平衡转化率和
的平衡转化率和 的选择性的影响如图甲所示,温度高于260°C时,
的选择性的影响如图甲所示,温度高于260°C时, 的平衡转化率变化的原因是
的平衡转化率变化的原因是___________ 。 的选择性:实验值略高于平衡值,从化学反应速率角度解释原因:
的选择性:实验值略高于平衡值,从化学反应速率角度解释原因:___________ 。
(4)利用如图所示原理去除NO:___________ ,每产生224 mL  (体积已换算成标准状况,不考虑
(体积已换算成标准状况,不考虑 的溶解),可处理NO的物质的量为
的溶解),可处理NO的物质的量为___________ mol。
 的排放、捕集并利用
的排放、捕集并利用 是我国能源领域的一个重要战略方向。
是我国能源领域的一个重要战略方向。在
 加氢合成甲醇的体系中,同时存在以下反应:
加氢合成甲醇的体系中,同时存在以下反应:反应i:

 kJ/mol
kJ/mol反应ii:

 kJ/mol
kJ/mol(1)反应iii:
 的
的
(2)在
 加氢合成甲醇的体系中,下列说法不正确的是___________(填序号)。
加氢合成甲醇的体系中,下列说法不正确的是___________(填序号)。| A.若在绝热恒容容器,反应i的平衡常数K保持不变,说明反应i、ii都已达平衡 |
| B.若气体的平均相对分子质量不变,说明反应i、ii都已达平衡 |
| C.体系达平衡后,若压缩体积,反应i平衡正向移动,反应i平衡不移动 |
| D.选用合适的催化剂可以提高甲醇在单位时间内的产量 |
(3)某温度下,向容积恒为1 L的密闭容器中通入1 mol
 和5 mol
和5 mol  ,10 min后体系达到平衡,此时
,10 min后体系达到平衡,此时 的转化率为20%。
的转化率为20%。 的选择性为50%。[已知:
的选择性为50%。[已知: 的选择性:
的选择性: ]
]①反应i的平衡常数

②反应ii的净速率
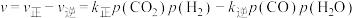 ,其中
,其中 、
、 分别为正、逆反应的速率常数,p为气体的分压。降低温度时,
分别为正、逆反应的速率常数,p为气体的分压。降低温度时,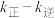
③其他条件相同时,反应温度对
 的平衡转化率和
的平衡转化率和 的选择性的影响如图甲所示,温度高于260°C时,
的选择性的影响如图甲所示,温度高于260°C时, 的平衡转化率变化的原因是
的平衡转化率变化的原因是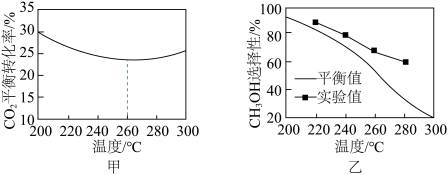
 的选择性:实验值略高于平衡值,从化学反应速率角度解释原因:
的选择性:实验值略高于平衡值,从化学反应速率角度解释原因:(4)利用如图所示原理去除NO:
 (体积已换算成标准状况,不考虑
(体积已换算成标准状况,不考虑 的溶解),可处理NO的物质的量为
的溶解),可处理NO的物质的量为
您最近一年使用:0次
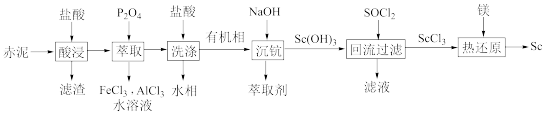
5 . 赤泥含有Sc2O3 (氧化钪)、Al2O3、Fe2O3、SiO2等,以赤泥为原料提取钪(Sc)的流程如下:
请回答下列问题:
(1)滤渣主要成分是___________ (填化学式)。
(2)“酸浸”时温度过高,酸浸速率反而减慢,其原因是___________ 。
(3)“回流过滤”中稍过量SOCl2作用有将Sc(OH)3转化为ScCl3,作溶剂和___________ 。
(4)“热还原”的化学方程式为___________ 。
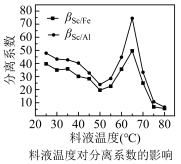
(5)P2O4萃取浸出液,其浓度、料液温度对萃取率的影响如下所示,萃取时最佳浓度
及料液温度分别为___________ 、___________ 。流程中“洗涤”的目的是___________ 。
[A的分离系数指分离后混合体系中A的物质的量分数,如βSc/Fe= ×100%]
×100%]___________ 。
请回答下列问题:
(1)滤渣主要成分是
(2)“酸浸”时温度过高,酸浸速率反而减慢,其原因是
(3)“回流过滤”中稍过量SOCl2作用有将Sc(OH)3转化为ScCl3,作溶剂和
(4)“热还原”的化学方程式为
(5)P2O4萃取浸出液,其浓度、料液温度对萃取率的影响如下所示,萃取时最佳浓度
及料液温度分别为
[A的分离系数指分离后混合体系中A的物质的量分数,如βSc/Fe=
 ×100%]
×100%]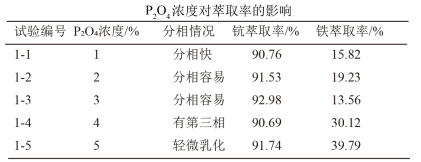
您最近一年使用:0次
6 . 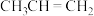 和HBr在通常情况下发生加成反应主要得到2-溴丙烷,其机理如下:
和HBr在通常情况下发生加成反应主要得到2-溴丙烷,其机理如下:不正确 的是
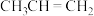 和HBr在通常情况下发生加成反应主要得到2-溴丙烷,其机理如下:
和HBr在通常情况下发生加成反应主要得到2-溴丙烷,其机理如下: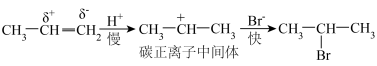
A.碳正离子中间体稳定性: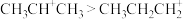 |
B.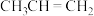 与氢卤酸反应时速率大小HI>HBr>HCl 与氢卤酸反应时速率大小HI>HBr>HCl |
C.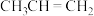 与甲硼烷( 与甲硼烷(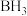 )加成最终能得到 )加成最终能得到 |
D.乙炔可通过如下流程合成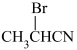 : : 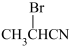 |
您最近一年使用:0次
名校
解题方法
7 . 铑(Rh)和铱(Ir)形成的材料在生产生活中应用广泛,如铑(Rh)膦络合物常用作催化剂,二氧化铱(IrO₂)可用作电生理学研究中的微电极。回答下列问题:
(1)铱(Ir)的原子序数为77,其价电子排布式为___________ ,铑(Rh)的原子序数为45,其位于元素周期表的___________ 区。
(2)固体铑(Rh)膦缘金催化剂(Ph为苯基)的结构如图所示,中心原子Rh的VSEPR模型是___________ ,该分子中P原子的杂化方式为___________ ,1mol该物质中含有的σ键的数目为___________ (设NA为阿伏伽德罗常数的值)。___________ 。
(4)在有机合成中C-H键和C-C键是非常难断裂的键,C-H键活化曾被称为有机化学中的“圣杯”,铑、铱复合催化剂在C→H和C-C插入反应中表现出了很好的催化活性。某一种铑、铱复合催化剂晶体的四方晶胞如图所示,晶胞参数为a nm、a nm、c nm,晶胞中Ir、Rh分别形成的八面体的微粒带两个和三个负电荷,则该晶胞的化学式为___________ , 表示阿伏伽德罗常数的值,则晶体密度为
表示阿伏伽德罗常数的值,则晶体密度为___________ g·cm-3(用含a、c、 的代数式表示)。
的代数式表示)。
(1)铱(Ir)的原子序数为77,其价电子排布式为
(2)固体铑(Rh)膦缘金催化剂(Ph为苯基)的结构如图所示,中心原子Rh的VSEPR模型是
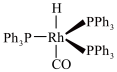
(4)在有机合成中C-H键和C-C键是非常难断裂的键,C-H键活化曾被称为有机化学中的“圣杯”,铑、铱复合催化剂在C→H和C-C插入反应中表现出了很好的催化活性。某一种铑、铱复合催化剂晶体的四方晶胞如图所示,晶胞参数为a nm、a nm、c nm,晶胞中Ir、Rh分别形成的八面体的微粒带两个和三个负电荷,则该晶胞的化学式为
 表示阿伏伽德罗常数的值,则晶体密度为
表示阿伏伽德罗常数的值,则晶体密度为 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
8 . Mo和Ni为重要战略性金属,从废钼催化剂(主要成分为 、
、 少量NiS、NiO、
少量NiS、NiO、 等)中回收有价金属的工艺流程如图所示:
等)中回收有价金属的工艺流程如图所示:
①“沉钼”前钼元素主要以 形式存在。
形式存在。
②常温下,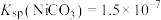 ,
,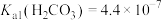 ,
,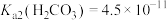 ,
,
③
④金属离子开始沉淀和完全沉淀时pH范围:
请回答
(1)“焙烧”过程中采用多层逆流(空气从炉底进入,固体粉末从炉顶投入),该操作的优点为___________ 。写出在“焙烧”过程中 被氧化的化学方程式:
被氧化的化学方程式:___________ 。
(2)“除铁”时调节溶液pH范围是___________ ;已知“沉镍”所得滤液的 ,则滤液中
,则滤液中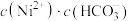 约为
约为___________ 
(3)写出“沉钼”时的离子方程式:___________ 。
(4) 与丁二酮(
与丁二酮( )反应会生成鲜红色的丁二酮肟镍沉淀,该反应可用于检验
)反应会生成鲜红色的丁二酮肟镍沉淀,该反应可用于检验 ,丁二酮肟中的碳氮双键是由
,丁二酮肟中的碳氮双键是由___________ 轨道重叠而成的(填字母)。
A. 和
和 B.sp和
B.sp和 C.sp和2p D.2p和2p E.
C.sp和2p D.2p和2p E. 和2p
和2p
(5)氮化钼量子点可应用于电池及催化领域,其晶胞结构如图所示,氮化钼的化学式为___________ 。若晶胞密度为 ,则晶胞参数a=
,则晶胞参数a=___________ nm。(设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
 、
、 少量NiS、NiO、
少量NiS、NiO、 等)中回收有价金属的工艺流程如图所示:
等)中回收有价金属的工艺流程如图所示: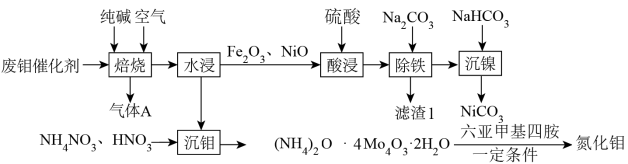
①“沉钼”前钼元素主要以
 形式存在。
形式存在。②常温下,
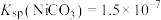 ,
,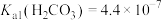 ,
,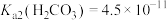 ,
,③

④金属离子开始沉淀和完全沉淀时pH范围:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 2.7 | 3.7 |
 | 7.1 | 9.2 |
(1)“焙烧”过程中采用多层逆流(空气从炉底进入,固体粉末从炉顶投入),该操作的优点为
 被氧化的化学方程式:
被氧化的化学方程式:(2)“除铁”时调节溶液pH范围是
 ,则滤液中
,则滤液中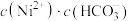 约为
约为
(3)写出“沉钼”时的离子方程式:
(4)
 与丁二酮(
与丁二酮( )反应会生成鲜红色的丁二酮肟镍沉淀,该反应可用于检验
)反应会生成鲜红色的丁二酮肟镍沉淀,该反应可用于检验 ,丁二酮肟中的碳氮双键是由
,丁二酮肟中的碳氮双键是由A.
 和
和 B.sp和
B.sp和 C.sp和2p D.2p和2p E.
C.sp和2p D.2p和2p E. 和2p
和2p(5)氮化钼量子点可应用于电池及催化领域,其晶胞结构如图所示,氮化钼的化学式为
 ,则晶胞参数a=
,则晶胞参数a= 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
您最近一年使用:0次
名校
9 . 合成氨反应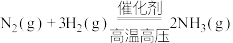 是目前最有效的工业固氮方法,解决数亿人口生存问题。回答下列问题:
是目前最有效的工业固氮方法,解决数亿人口生存问题。回答下列问题:
(1)合成氨反应在催化作用的化学吸附及初步表面反应历程如下:
①写出N2参与化学吸附的反应方程式:_____________ 。
②以上历程须克服的最大能垒为______ eV。
(2)t℃、0.9MPa的条件下,向一恒压密闭容器中通入氢氮比为3的混合气体,体系中气体的含量与时间变化关系如图所示:
______  ,该反应的
,该反应的
______ (用数字表达式表示,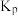 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
②下列叙述能说明该条件下反应达到平衡状态的是______ (填标号)。
a.氨气的体积分数保持不变
b.容器中氢氮比保持不变
c.N2和NH3的平均反应速率之比为1∶2
d.气体密度保持不变
(3)如图是20℃时,NH3-CO2-H2O三元体系相图。纵坐标代表CO2的体积分数,横坐标代表NH3的体积分数,坐标原点代表液态纯水。 与
与 ,也可选择无水体系反应得到
,也可选择无水体系反应得到 。
。
①20℃时,利用NH3(g)、CO2(g)和H2O(l)制备NH4HCO3(aq)的最佳曲线是______ (填“A-H2O”或“B-H2O”)。
②B点可得到的产品是______ (填化学式)。
(4)钌系催化剂是目前合成氨最先进的催化剂。一种钌的化合物晶胞结构如图。该晶胞中与 等距最近的
等距最近的 有
有______ 个,若该晶胞边长为a pm,该晶体的密度为______  (
(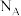 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
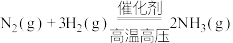 是目前最有效的工业固氮方法,解决数亿人口生存问题。回答下列问题:
是目前最有效的工业固氮方法,解决数亿人口生存问题。回答下列问题:(1)合成氨反应在催化作用的化学吸附及初步表面反应历程如下:

①写出N2参与化学吸附的反应方程式:
②以上历程须克服的最大能垒为
(2)t℃、0.9MPa的条件下,向一恒压密闭容器中通入氢氮比为3的混合气体,体系中气体的含量与时间变化关系如图所示:


 ,该反应的
,该反应的
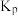 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。②下列叙述能说明该条件下反应达到平衡状态的是
a.氨气的体积分数保持不变
b.容器中氢氮比保持不变
c.N2和NH3的平均反应速率之比为1∶2
d.气体密度保持不变
(3)如图是20℃时,NH3-CO2-H2O三元体系相图。纵坐标代表CO2的体积分数,横坐标代表NH3的体积分数,坐标原点代表液态纯水。
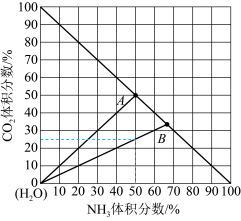
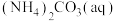 与
与 ,也可选择无水体系反应得到
,也可选择无水体系反应得到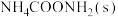 。
。①20℃时,利用NH3(g)、CO2(g)和H2O(l)制备NH4HCO3(aq)的最佳曲线是
②B点可得到的产品是
(4)钌系催化剂是目前合成氨最先进的催化剂。一种钌的化合物晶胞结构如图。该晶胞中与
 等距最近的
等距最近的 有
有 (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
名校
解题方法
10 . 药物 对治疗心脏病有疗效。一种合成
对治疗心脏病有疗效。一种合成 的流程如下。
的流程如下。 。
。
回答下列问题:
(1)H的结构简式为___________ ,E→F的试剂和条件分别是___________ 。
(2)F中所含官能团的名称为___________ ,F→G的反应类型是___________ 。
(3)吡啶(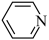 )呈碱性,F→G中常加入吡啶,其作用是
)呈碱性,F→G中常加入吡啶,其作用是___________ 。
(4)B→C的化学方程式为___________ 。
(5)芳香族化合物L在分子组成上比F少3个“CH2”原子团,则满足下列条件的L的结构简式有___________ 种(不考虑立体异构)。
①遇FeCl3溶液发生显色反应;
②苯环上有3个取代基,且取代基中无-C=N-结构,除苯环外无其他环状结构;
③只有一种含氧官能团且均与苯环直接相连。
其中,核磁共振氢谱显示有5组峰且峰面积之比为2:2:2:2:1的结构简式为___________ (只写一种即可)。
 对治疗心脏病有疗效。一种合成
对治疗心脏病有疗效。一种合成 的流程如下。
的流程如下。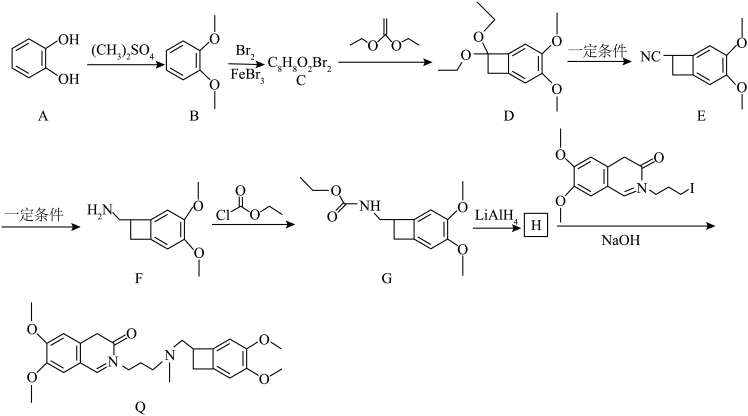
 。
。回答下列问题:
(1)H的结构简式为
(2)F中所含官能团的名称为
(3)吡啶(
 )呈碱性,F→G中常加入吡啶,其作用是
)呈碱性,F→G中常加入吡啶,其作用是(4)B→C的化学方程式为
(5)芳香族化合物L在分子组成上比F少3个“CH2”原子团,则满足下列条件的L的结构简式有
①遇FeCl3溶液发生显色反应;
②苯环上有3个取代基,且取代基中无-C=N-结构,除苯环外无其他环状结构;
③只有一种含氧官能团且均与苯环直接相连。
其中,核磁共振氢谱显示有5组峰且峰面积之比为2:2:2:2:1的结构简式为
您最近一年使用:0次



