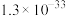名校
解题方法
1 . 氯及其化合物应用广泛。ClO2可用于自来水消毒,ClO2是一种黄绿色气体,易溶于水,与碱反应会生成 与
与 ;NaClO2(亚氯酸钠)是一种高效漂白剂和氧化剂,NaClO2饱和溶液在温度低于38℃时析出NaClO2·3H2O晶体,高于60℃时易分解。NaClO2·3H2O的实验室制备过程为:
;NaClO2(亚氯酸钠)是一种高效漂白剂和氧化剂,NaClO2饱和溶液在温度低于38℃时析出NaClO2·3H2O晶体,高于60℃时易分解。NaClO2·3H2O的实验室制备过程为:
①在强酸性介质中用SO2还原NaClO3制备ClO2;
②在碱性介质中ClO2与H2O2反应,得到亚氯酸钠溶液;
③再经一系列操作可得NaClO2·3H2O晶体。
根据上述实验原理,下列说法不正确的是
 与
与 ;NaClO2(亚氯酸钠)是一种高效漂白剂和氧化剂,NaClO2饱和溶液在温度低于38℃时析出NaClO2·3H2O晶体,高于60℃时易分解。NaClO2·3H2O的实验室制备过程为:
;NaClO2(亚氯酸钠)是一种高效漂白剂和氧化剂,NaClO2饱和溶液在温度低于38℃时析出NaClO2·3H2O晶体,高于60℃时易分解。NaClO2·3H2O的实验室制备过程为:①在强酸性介质中用SO2还原NaClO3制备ClO2;
②在碱性介质中ClO2与H2O2反应,得到亚氯酸钠溶液;
③再经一系列操作可得NaClO2·3H2O晶体。
根据上述实验原理,下列说法不正确的是
| A.①中可用硫酸作强酸性介质,②中可用NaOH作碱性介质 |
| B.反应②中的H2O2可用NaClO4代替 |
| C.过程③一系列操作含冷却结晶,温度控制在38℃以下 |
D.若通过原电池反应来实现①,正极的电极反应为ClO +e-+2H+=ClO2+H2O +e-+2H+=ClO2+H2O |
您最近一年使用:0次
名校
解题方法
2 . 光催化氧化甲烷制甲醛的机理如图所示。下列说法不正确的是
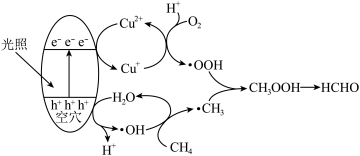
A.在光催化剂表面会发生反应 |
B. 为中间产物 为中间产物 |
| C.上述过程中有非极性键的断裂与生成 |
| D.含O分子参与的反应一定有电子转移 |
您最近一年使用:0次
名校
3 . 我国科学家最新合成出一种聚醚酯(PM)新型材料,可实现“单体―聚合物―单体”的闭合循环,推动塑料经济的可持续发展,合成方法如图。
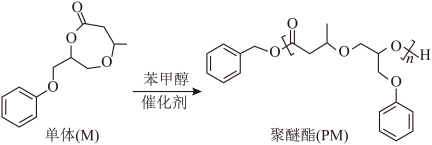
A.单体M的分子式是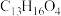 |
| B.合成1mol PM理论上需要1mol苯甲醇和n mol M |
| C.合成聚醚酯(PM)的过程中官能团的种类和数目均改变 |
D.聚醚酯(PM)与稀 和NaOH溶液都能反应 和NaOH溶液都能反应 |
您最近一年使用:0次
2024-06-06更新
|
152次组卷
|
4卷引用:选择题11-16
(已下线)选择题11-16(已下线)选择题6-10云南省曲靖市2023-2024学年高三下学期第二次教学质量监测理科综合试题卷-高中化学2024届吉林省长春吉大附中实验学校高三下学期考前适应考试化学试题
名校
解题方法
4 . 近期,科学家合成出了一种化合物如图所示,其中W、X、Y、Z.为同一短周期元素,Z核外最外层电子数是X核外电子数的一半,Y的最高价氧化物对应的水化物是中强酸,下列说法错误的是

| A.原子半径:W>X>Y>Z |
B.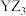 的VSEPR模型为三角锥形 的VSEPR模型为三角锥形 |
| C.该周期中第一电离能比Y大的元素有2种 |
| D.X的单质与W的最高价氧化物对应的水化物可以发生化学反应 |
您最近一年使用:0次
2024-06-06更新
|
192次组卷
|
3卷引用:选择题11-15
2024高三下·浙江·专题练习
5 . Li、B、C、Ga等元素的单质或化合物在很多领域有广泛的应用。请回答:
(1)基态31Ga原子的价电子排布式为___________ 。
(2)一种含B化合物可用作吸附材料,其化学式为[C(NH2)3]4[B(OCH3)4]3Cl,部分晶体结构如图1所示,其中 [C(NH2)3]+为平面结构。不正确 的是___________。
(3)比较C-B-C键角大小:B(CH3)3___________ B(CH3)3(OCH3) (填“>”“=”或“<”),并说明理由___________ 。
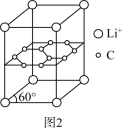
(4)一种锂离子电池负极材料为两层石墨层中嵌入Li+,形成如图2所示的晶胞结构。该物质的化学式可以表示为___________ ,Li+的配位数为___________ 。
(1)基态31Ga原子的价电子排布式为
(2)一种含B化合物可用作吸附材料,其化学式为[C(NH2)3]4[B(OCH3)4]3Cl,部分晶体结构如图1所示,其中 [C(NH2)3]+为平面结构。
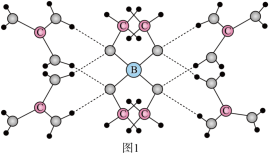
| A.基态原子的第一电离能:C<N<O |
| B.基态原子未成对电子数:B<C<N<O |
| C.该晶体中存在的化学键有离子键、共价键、配位键、氢键 |
| D.晶体中B、C、N和O原子轨道的杂化类型分别为sp3、sp2、sp3、sp3 |
(3)比较C-B-C键角大小:B(CH3)3
(4)一种锂离子电池负极材料为两层石墨层中嵌入Li+,形成如图2所示的晶胞结构。该物质的化学式可以表示为
您最近一年使用:0次
名校
解题方法
6 . 甲醇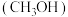 是一种用途广泛的基础有机原料和优质燃料。
是一种用途广泛的基础有机原料和优质燃料。
(1)甲醇可以在铜做催化剂的条件下直接氧化成甲醛 。
。
①基态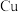 原子的价层电子的轨道表示式为
原子的价层电子的轨道表示式为_______ 。
②甲醛中碳原子的杂化方式为_______ 杂化,其组成元素的电负性由小到大 的顺序为_______ 。
(2)在一定条件下,甲醇可转化为乙酸甲酯 ,一个乙酸甲酯分子中
,一个乙酸甲酯分子中 键和
键和 键个数之比为
键个数之比为_______ 。
(3)由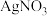 制备的
制备的 可用于检验醛基。
可用于检验醛基。 中配位原子为
中配位原子为_______ , 的空间构型为
的空间构型为_______ 。
(4)图中银晶胞的边长为 ,该晶胞中
,该晶胞中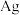 的配位数为
的配位数为_______ ;该晶胞密度为_______ 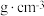 (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
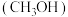 是一种用途广泛的基础有机原料和优质燃料。
是一种用途广泛的基础有机原料和优质燃料。(1)甲醇可以在铜做催化剂的条件下直接氧化成甲醛
 。
。①基态
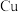 原子的价层电子的轨道表示式为
原子的价层电子的轨道表示式为②甲醛中碳原子的杂化方式为
(2)在一定条件下,甲醇可转化为乙酸甲酯
 ,一个乙酸甲酯分子中
,一个乙酸甲酯分子中 键和
键和 键个数之比为
键个数之比为(3)由
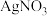 制备的
制备的 可用于检验醛基。
可用于检验醛基。 中配位原子为
中配位原子为 的空间构型为
的空间构型为(4)图中银晶胞的边长为
 ,该晶胞中
,该晶胞中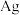 的配位数为
的配位数为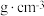 (用含
(用含 、
、 的代数式表示)。
的代数式表示)。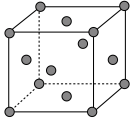
您最近一年使用:0次
2024-06-05更新
|
319次组卷
|
5卷引用:T13-结构与性质
名校
解题方法
7 . 镓、锗都是重要的半导体原材料,利用锌浸出渣(主要成分有ZnO、Ga2O3、GeO2、还有FeO、Fe2O3、Bi2O3等杂质)制备镓和锗的流程如下:
Ⅱ.该工艺条件下,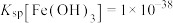 ,
,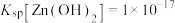
Ⅲ.镓与铝的性质相似,但高纯度的镓难溶于酸或碱。
回答下列问题:
(1)“浸渣”的主要成分为___________ 。
(2)“降铁浓缩”中 为
为 ,则除
,则除 时应控制pH的范围是
时应控制pH的范围是___________ (已知:当溶液中某离子浓度小于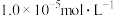 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(3)若用H2R表示单宁酸,“沉锗”的反应原理为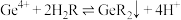 ,该操作中需调节pH为2.5,不能过高或过低,原因是
,该操作中需调节pH为2.5,不能过高或过低,原因是___________ 。
(4)HGaCl4与过量氢氧化钠反应的化学方程式为___________ 。“电解”得到单质镓,阴极的电极反应为___________ 。
(5)步骤①—③目的为___________ ,“还原”过程中参与反应的H2体积为89.6 L(标准状况下),则理论上步骤①中消耗SOCl2物质的量为___________ 。

Ⅱ.该工艺条件下,
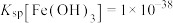 ,
,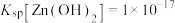
Ⅲ.镓与铝的性质相似,但高纯度的镓难溶于酸或碱。
回答下列问题:
(1)“浸渣”的主要成分为
(2)“降铁浓缩”中
 为
为 ,则除
,则除 时应控制pH的范围是
时应控制pH的范围是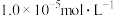 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。(3)若用H2R表示单宁酸,“沉锗”的反应原理为
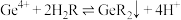 ,该操作中需调节pH为2.5,不能过高或过低,原因是
,该操作中需调节pH为2.5,不能过高或过低,原因是(4)HGaCl4与过量氢氧化钠反应的化学方程式为
(5)步骤①—③目的为
您最近一年使用:0次
2024-06-05更新
|
205次组卷
|
4卷引用:T11-工业流程题
名校
解题方法
8 . 中国文化博大精深,许多文献记载中蕴含丰富的化学知识,下列有关说法错误的是
| A.《茶疏》中对泡茶过程有如下记载:“治壶、投茶、出浴、淋壶、烫杯、酾茶、品茶……”,泡茶过程涉及的操作有溶解、过滤等。 |
| B.《天工开物》记载“人贱者短褐、梟裳,冬以御寒,夏以蔽体,其质造物之所具也。属草木者,为梟、麻、苘、葛……”文中的“臬、麻、苘、葛”属于纤维素。 |
| C.《千里江山图》中的颜料来自于矿物质,并经研磨、溶解、过滤这三道工序获得,这三道工序涉及的均是物理变化。 |
| D.《傅鹑觚集·太子少傅箴》中写道:“夫金木无常,方园应行,亦有隐括,习与性形。故近朱者赤,近墨者黑。”这里的“朱”指的是Fe2O3。 |
您最近一年使用:0次
2024-06-05更新
|
336次组卷
|
3卷引用:选择题7-12
名校
9 . 羟基自由基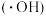 具有很强的氧化性,能将苯酚氧化为
具有很强的氧化性,能将苯酚氧化为 和
和 。我国科学家开发出如图所示装置,能实现制备氢气、处理含苯酚废水二位一体。下列说法正确的是
。我国科学家开发出如图所示装置,能实现制备氢气、处理含苯酚废水二位一体。下列说法正确的是
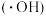 具有很强的氧化性,能将苯酚氧化为
具有很强的氧化性,能将苯酚氧化为 和
和 。我国科学家开发出如图所示装置,能实现制备氢气、处理含苯酚废水二位一体。下列说法正确的是
。我国科学家开发出如图所示装置,能实现制备氢气、处理含苯酚废水二位一体。下列说法正确的是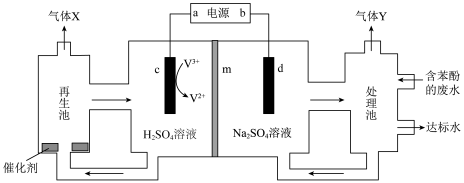
A.d电极的电极反应式: |
B.再生池中发生的反应: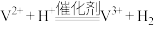 |
C.a为电源负极,m为阴离子交换膜, 能增强导电性 能增强导电性 |
D.气体X与Y在相同条件下的体积比为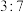 |
您最近一年使用:0次
2024-06-04更新
|
584次组卷
|
5卷引用:选择题11-14
(已下线)选择题11-142024届黑龙江省哈尔滨师范大学附属中学高三下学期三模化学试题东北三省三校2024届高三下学期5月第三次联合模拟考试化学试卷 (已下线)江苏省南京师范大学附属中学2024届高三下学期5月模拟化学试题福建省泉州第五中学2024届高三下学期适应性检测化学试题
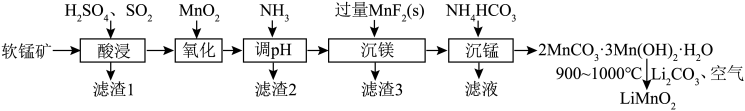
10 . 层状LiMnO2在电动车、空间技术等范畴具有十分广阔的应用前景。LiMnO2可由软锰矿(主要成分是MnO2,含少量Fe2O3、Al2O3、SiO2、MgO等)制备,其制备流程如图:
回答下列问题:
(1) LiMnO2中锰元素的化合价为______ ;“酸浸”后过滤,所得滤液中主要含有的金属阳离子有______ 。
(2)为了提高“酸浸”的浸取速率,可采取的措施有______ (写出两点)。
(3)“氧化”步骤需要加入过量MnO2,该步反应的离子方程式为______ 。
(4)常温下,“调pH”后溶液pH=5,则滤渣2的主要成分是______ 。
(5)滤渣3与浓H2SO4反应可以释放HF,同时得到的副产物是______ 。
(6)测定 LiMnO2样品中锰含量:取10g LiMnO2样品,粉碎后加入浓盐酸、30%H2O2溶液,充分反应,生成Mn(Ⅱ)。加入蒸馏水标定溶液体积为250mL,移取25mL后加入KB指示剂,用0.15mol/L的EDTA标准溶液滴定,平均消耗60mL标准溶液。样品中锰含量为______ %(已知:EDTA与Mn2+反应的化学计量数之比为1∶1)。
物质 |
|
|
|
|
|
|
|
|
|
|
|
(1) LiMnO2中锰元素的化合价为
(2)为了提高“酸浸”的浸取速率,可采取的措施有
(3)“氧化”步骤需要加入过量MnO2,该步反应的离子方程式为
(4)常温下,“调pH”后溶液pH=5,则滤渣2的主要成分是
(5)滤渣3与浓H2SO4反应可以释放HF,同时得到的副产物是
(6)测定 LiMnO2样品中锰含量:取10g LiMnO2样品,粉碎后加入浓盐酸、30%H2O2溶液,充分反应,生成Mn(Ⅱ)。加入蒸馏水标定溶液体积为250mL,移取25mL后加入KB指示剂,用0.15mol/L的EDTA标准溶液滴定,平均消耗60mL标准溶液。样品中锰含量为
您最近一年使用:0次
2024-06-04更新
|
276次组卷
|
5卷引用:T16-工业流程题
(已下线)T16-工业流程题2024届河北省部分高中高三下学期二模化学试题2024届河南省周口市西华县第一高级中学高三下学期信息押题模拟训练理综卷(3)-高中化学2024届河南省许昌部分高中高三下学期模拟考试(三)理科综合试题-高中化学(已下线)2024届四川省成都外国语学校高三下学期冲刺练习(五)理科综合试题-高中化学