1 . 在容积为2.0L的密闭容器中充入0.60molX和1.60molY,发生反应:aX(g)+3Y(g) 2Z(g)。经过10min反应达到平衡状态,X的物质的量为0.2mol,Y的浓度为0.2mol/L。计算并回答:
2Z(g)。经过10min反应达到平衡状态,X的物质的量为0.2mol,Y的浓度为0.2mol/L。计算并回答:
(1)a的值____ 。
(2)该条件下X的平衡转化率_____ (百分数表示,保留一位小数)。
(3)该条件下反应2Z(g) aX(g)+3Y(g)的平衡常数为
aX(g)+3Y(g)的平衡常数为____ 。
 2Z(g)。经过10min反应达到平衡状态,X的物质的量为0.2mol,Y的浓度为0.2mol/L。计算并回答:
2Z(g)。经过10min反应达到平衡状态,X的物质的量为0.2mol,Y的浓度为0.2mol/L。计算并回答:(1)a的值
(2)该条件下X的平衡转化率
(3)该条件下反应2Z(g)
 aX(g)+3Y(g)的平衡常数为
aX(g)+3Y(g)的平衡常数为
您最近一年使用:0次
2 . 甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如图:
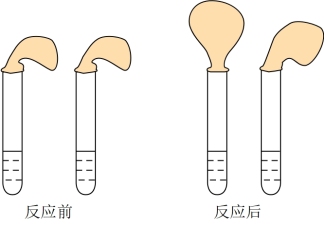
甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入0.1 mol∙L−1的HA、HCl溶液各10mL,按图装好,观察现象。
乙:①用pH计测定物质的量浓度均为0.1 mol∙L−1HA和HCl溶液的pH;
②再取0.1 mol∙L−1的HA和HCl溶液各2滴(1滴约为 mL)分别稀释至100mL,再用pH计测其pH变化。
mL)分别稀释至100mL,再用pH计测其pH变化。
(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol∙L−1的HA溶pH____ 1(填“>”、“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是:____ 。
A.加入HCl溶液后,试管上方的气球鼓起快
B.加入HA溶液后,试管上方的气球鼓起慢
C.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
(2)乙同学设计的实验第____ 步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1 mol∙L−1的HA溶液中,选择加入____ 试剂(选填“A”“B’“C”“D”下同)。
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol∙L−1的HA溶液中,选择加入____ 试剂。
A.NaA固体(可完全溶于水) B.1 mol∙L−1NaOH溶液
C.1 mol∙L−1H2SO4 D.2 mol∙L−1HA

甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入0.1 mol∙L−1的HA、HCl溶液各10mL,按图装好,观察现象。
乙:①用pH计测定物质的量浓度均为0.1 mol∙L−1HA和HCl溶液的pH;
②再取0.1 mol∙L−1的HA和HCl溶液各2滴(1滴约为
 mL)分别稀释至100mL,再用pH计测其pH变化。
mL)分别稀释至100mL,再用pH计测其pH变化。(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol∙L−1的HA溶pH
A.加入HCl溶液后,试管上方的气球鼓起快
B.加入HA溶液后,试管上方的气球鼓起慢
C.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
(2)乙同学设计的实验第
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1 mol∙L−1的HA溶液中,选择加入
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol∙L−1的HA溶液中,选择加入
A.NaA固体(可完全溶于水) B.1 mol∙L−1NaOH溶液
C.1 mol∙L−1H2SO4 D.2 mol∙L−1HA
您最近一年使用:0次
2022-09-25更新
|
259次组卷
|
2卷引用:西藏自治区拉萨那曲高级中学2021-2022学年高二下学期入学检测化学试题
解题方法
3 . 回答下列问题:
(1)对于Ag2S(s) 2Ag+(aq)+S2-(aq),其Ksp=
2Ag+(aq)+S2-(aq),其Ksp=____ 。
(2)在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成____ 沉淀(填化学式),生成该沉淀的离子方程式为_____ 。(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)。
(3)下列说法不正确的是____ 。
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的
C.对于Al(OH)3(s) Al(OH)3(aq)
Al(OH)3(aq) Al3++3OH-,前者为溶解平衡,后者为电离平衡
Al3++3OH-,前者为溶解平衡,后者为电离平衡
D.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO 效果好,说明Mg(OH)2的溶解度比MgCO3大
效果好,说明Mg(OH)2的溶解度比MgCO3大
E.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全
(1)对于Ag2S(s)
 2Ag+(aq)+S2-(aq),其Ksp=
2Ag+(aq)+S2-(aq),其Ksp=(2)在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(3)下列说法不正确的是
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的
C.对于Al(OH)3(s)
 Al(OH)3(aq)
Al(OH)3(aq) Al3++3OH-,前者为溶解平衡,后者为电离平衡
Al3++3OH-,前者为溶解平衡,后者为电离平衡D.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO
 效果好,说明Mg(OH)2的溶解度比MgCO3大
效果好,说明Mg(OH)2的溶解度比MgCO3大E.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全
您最近一年使用:0次
解题方法
4 . 回答下列问题:
(1)某温度时,在2L容器中X、Y、Z三种物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式为____ 。
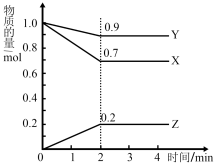
反应开始至2min,Z的平均反应速率为____ 。
(2)甲烷作为能源燃烧放出大量的热,已知:
①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol
则表示甲烷燃烧热的热化学方程式____ 。
(1)某温度时,在2L容器中X、Y、Z三种物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式为

反应开始至2min,Z的平均反应速率为
(2)甲烷作为能源燃烧放出大量的热,已知:
①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol
则表示甲烷燃烧热的热化学方程式
您最近一年使用:0次
解题方法
5 . 25℃时,某浓度的氯化铵溶液的pH=4,下列叙述中正确的是
| A.溶液中的水电离的c(OH-)=1×10-10mol•L-1 |
B.溶液中的c(Cl-)>c(NH )=c(H+)>c(OH-) )=c(H+)>c(OH-) |
C.溶液中的c(H+)+c(NH )=c(Cl-)+c(OH-) )=c(Cl-)+c(OH-) |
D.溶液中的c(NH3•H2O)=c(NH ) ) |
您最近一年使用:0次
解题方法
6 . 对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是| A.化学反应速率关系是:2v正(NH3)=3v正(H2O) |
| B.若单位时间内生成xmolNO的同时,生成xmolNH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 |
| D.达到化学平衡时,4v正(O2)<5v逆(NO) |
您最近一年使用:0次
名校
解题方法
7 . 在Na2S溶液中存在着多种分子和离子,下列关系不正确的是
| A.c(OH-)=c(HS-)+c(H+)+c(H2S) | B.c(OH-)=c(HS-)+c(H+)+2c(H2S) |
| C.c(Na+)=2[c(HS-)+c(S2-)+c(H2S)] | D.c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
您最近一年使用:0次
2022-09-25更新
|
161次组卷
|
2卷引用:西藏自治区拉萨那曲高级中学2021-2022学年高二下学期入学检测化学试题
解题方法
8 . 下列离子分别加入纯水中,能使水中c(H+)增大的是
| A.ClO- | B.Fe3+ | C.S2- | D.NO |
您最近一年使用:0次
9 . 回答下列问题:
(1)区别溶液和胶体的最简单方法是____ 。
(2)用一种试剂除去下列各物质的杂质(括号内为杂质):
CO2(HCl),试剂:____ ;SO (CO
(CO ),试剂:
),试剂:____ 。
(3)已知:6Fe2++R2O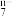 +14H+=6Fe3++2R3++7H2O,则R2O
+14H+=6Fe3++2R3++7H2O,则R2O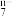 中R的化合价为
中R的化合价为____ 。
(4)熔融的NaHSO4电离方程式____ 。
(1)区别溶液和胶体的最简单方法是
(2)用一种试剂除去下列各物质的杂质(括号内为杂质):
CO2(HCl),试剂:
 (CO
(CO ),试剂:
),试剂:(3)已知:6Fe2++R2O
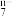 +14H+=6Fe3++2R3++7H2O,则R2O
+14H+=6Fe3++2R3++7H2O,则R2O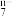 中R的化合价为
中R的化合价为(4)熔融的NaHSO4电离方程式
您最近一年使用:0次
2022-09-25更新
|
134次组卷
|
3卷引用:西藏拉萨那曲高级中学2021-2022学年高一下学期入学检测化学试题
10 . 阿伏加德罗常数的值为NA,下列说法正确的是
| A.标准状况下,2.24LN2和O2的混合气体中分子数为0.1NA |
| B.2.4gMg与H2SO4完全反应,转移的电子数为0.1NA |
| C.在常温常压下,1molHe含有的原子数目为2NA |
| D.标准状况下,2.24LHCl溶于500mL水中所得溶液浓度为2mol/L |
您最近一年使用:0次
2022-09-25更新
|
185次组卷
|
3卷引用:西藏拉萨那曲高级中学2021-2022学年高一下学期入学检测化学试题



