1 . 饱和二氧化硫水溶液中存在下列平衡体系:SO2+H2O H++
H++ ,
,
 H++
H++ ,若向此溶液中
,若向此溶液中
 H++
H++ ,
,
 H++
H++ ,若向此溶液中
,若向此溶液中A.加水, 浓度增大 浓度增大 |
| B.通入少量Cl2气体,溶液pH增大 |
C.加少量CaSO3粉末, 浓度基本不变 浓度基本不变 |
D.通入少量HCl气体,溶液中 浓度减小 浓度减小 |
您最近一年使用:0次
2 . 中国诗词深受众人喜爱,针对下列一些诗词,从化学角度解读正确的是
| A.王安石的《梅花》 “遥知不是雪,唯有暗香来”描述了物质发生化学变化过程中既有状态变化又有气味的产生 |
| B.庾信的《杨柳歌》“独忆飞絮鹅毛下,非复青丝马尾垂”从化学成分分析现实生活中“飞絮”“鹅毛”主要成分都是蛋白质 |
| C.赵孟頫的《烟火诗》“纷纷灿烂如星陨,赫赫喧虺似火攻”描述了颜色反应的现象 |
| D.刘禹锡的《浪淘沙》“千淘万漉虽辛苦,吹尽狂沙始到金”,说明金在自然界中以游离态存在,其化学性质稳定 |
您最近一年使用:0次
2022-09-11更新
|
567次组卷
|
3卷引用:吉林省四平市2021-2022学年高三下学期最后冲刺化学试题
名校
解题方法
3 . 氯化铅(PbCl2)常用于焊接和制备铅黄等染料。利用从废旧铅蓄电池中得到的铅膏获取氯化铅的流程如下图所示:

已知:①铅膏主要由PbSO4、PbO、PbO2和Pb等组成。
②硫酸铅、氯化铅微溶于水,但氯化铅能溶于NaCl溶液中,主要发生反应: 。
。
请根据要求,回答下列问题:
(1)铅蓄电池的正极材料是___________ (填化学式),放电时负极的电极反应式为___________ 。
(2)“浸取反应”是在加热条件下,用盐酸和氯化钠溶液浸取铅膏的过程,主要发生反应的方程式有: 、
、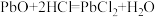 、
、 、
、 ,除此之外,PbO2还能与HCl反应产生一种黄绿色气体,该反应的化学方程式是
,除此之外,PbO2还能与HCl反应产生一种黄绿色气体,该反应的化学方程式是___________ ;该浸取过程中Pb与盐酸反应产生的H2可能会与___________ (填气体名称,下同)、___________ 等混合发生爆炸。
(3)PbCl2(溶液显酸性)在氯化钠溶液中的溶解度随温度的升高而增大,适当地升高温度有利于提高铅的浸取率,当温度高于70℃时,浸取率提高不明显,可能的原因是___________ ;为了提高浸取率,还可以采取的措施是___________ 。
(4)在室温下静置冷却3h后,过滤得到的氯化铅的回收率可达到85%,过滤后得到的滤液进行循环使用可提高铅的利用率。在循环使用之前需加入氯化钙将 进行沉淀转化,若无此步骤,直接循环使用,溶液中
进行沉淀转化,若无此步骤,直接循环使用,溶液中 浓度过大,则会导致的结果是
浓度过大,则会导致的结果是___________ 。

已知:①铅膏主要由PbSO4、PbO、PbO2和Pb等组成。
②硫酸铅、氯化铅微溶于水,但氯化铅能溶于NaCl溶液中,主要发生反应:
 。
。请根据要求,回答下列问题:
(1)铅蓄电池的正极材料是
(2)“浸取反应”是在加热条件下,用盐酸和氯化钠溶液浸取铅膏的过程,主要发生反应的方程式有:
 、
、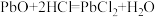 、
、 、
、 ,除此之外,PbO2还能与HCl反应产生一种黄绿色气体,该反应的化学方程式是
,除此之外,PbO2还能与HCl反应产生一种黄绿色气体,该反应的化学方程式是(3)PbCl2(溶液显酸性)在氯化钠溶液中的溶解度随温度的升高而增大,适当地升高温度有利于提高铅的浸取率,当温度高于70℃时,浸取率提高不明显,可能的原因是
(4)在室温下静置冷却3h后,过滤得到的氯化铅的回收率可达到85%,过滤后得到的滤液进行循环使用可提高铅的利用率。在循环使用之前需加入氯化钙将
 进行沉淀转化,若无此步骤,直接循环使用,溶液中
进行沉淀转化,若无此步骤,直接循环使用,溶液中 浓度过大,则会导致的结果是
浓度过大,则会导致的结果是
您最近一年使用:0次
2021-09-05更新
|
448次组卷
|
7卷引用:吉林省四平市第一高级中学2019届高三下学期第二次模拟考试化学试题
4 . 甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H=
CH3OCH3(g)+CO2(g)的△H=___________ kJ·mol-1。
(2)反应②达平衡后采取下列措施,能提高CH3OCH3产率的有___________ (填字母,下同)。
(3)以下说法能说明反应3H2(g)+3CO(g)  CH3OCH3(g)+CO2(g)达到平衡状态的有
CH3OCH3(g)+CO2(g)达到平衡状态的有___________ 。
A.H2和CO2的浓度之比为3:1
B.单位时间内断裂3个H-H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
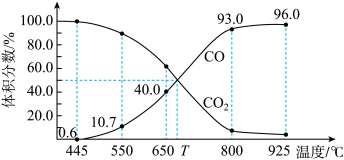
已知:气体分压(p分)=气体总压(p总)×体积分数。
①该反应△H___________ (填“>”“<”或“=”)0,550℃时,平衡后若充入惰性气体,平衡___________ (填“正移”“逆移”或“不移动”)。
②650℃时,反应达平衡后CO2的转化率为___________ (保留2位有效数字)。
③T℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=___________ p总。
(5)一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。图中b电极是___________ (填“正”或“负”)极,写出a电极反应式为___________ 。

①CO(g)+2H2(g)
 CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1②2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1③CO(g)+H2O(g)
 CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
CO2(g)+H2(g) △H3=-41.2 kJ·mol-1回答下列问题:
(1)则反应3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)的△H=
CH3OCH3(g)+CO2(g)的△H=(2)反应②达平衡后采取下列措施,能提高CH3OCH3产率的有___________ (填字母,下同)。
| A.使用催化剂 | B.升高温度 | C.增大压强 | D.移出H2O |
 CH3OCH3(g)+CO2(g)达到平衡状态的有
CH3OCH3(g)+CO2(g)达到平衡状态的有A.H2和CO2的浓度之比为3:1
B.单位时间内断裂3个H-H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)
 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
已知:气体分压(p分)=气体总压(p总)×体积分数。
①该反应△H
②650℃时,反应达平衡后CO2的转化率为
③T℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=
(5)一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。图中b电极是

您最近一年使用:0次
5 . 锌及其化合物在生产生活中应用比较广泛。
(1)ZnFe2O4是一种性能优良的软磁材料,也是一种催化剂,能催化烯类有机物氧化脱氢等反应。
①ZnFe2O4中Fe的化合价是___________ 。
②工业上利用反应ZnFe2(C2O4)3·6H2O ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4,该反应中还原产物是
ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4,该反应中还原产物是___________ (填化学式),每生成1 molZnFe2O4转移的电子总数是___________ 。
(2)业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等杂质)制取金属锌的工艺流程如下:

①酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率,为达到这一目的,还可采用的措施是___________ (任答一条)。写出ZnFe2O4溶于酸的离子方程式___________ 。
②净化I中H2O2参与反应的离子方程式为___________ 。
③净化II中Y的主要成分是___________ (填化学式)。
(3)金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属氢氧化物在不同pH下的溶解度[S/(mol·L-1)]如图所示:

①pH=3时溶液中铜元素的主要存在形式是___________
②若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH___________ 。
A.<1 B.4左右 C.>6
(1)ZnFe2O4是一种性能优良的软磁材料,也是一种催化剂,能催化烯类有机物氧化脱氢等反应。
①ZnFe2O4中Fe的化合价是
②工业上利用反应ZnFe2(C2O4)3·6H2O
 ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4,该反应中还原产物是
ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4,该反应中还原产物是(2)业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等杂质)制取金属锌的工艺流程如下:

①酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率,为达到这一目的,还可采用的措施是
②净化I中H2O2参与反应的离子方程式为
③净化II中Y的主要成分是
(3)金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属氢氧化物在不同pH下的溶解度[S/(mol·L-1)]如图所示:

①pH=3时溶液中铜元素的主要存在形式是
②若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH
A.<1 B.4左右 C.>6
您最近一年使用:0次
名校
6 . 用下列装置完成相关实验,合理的是
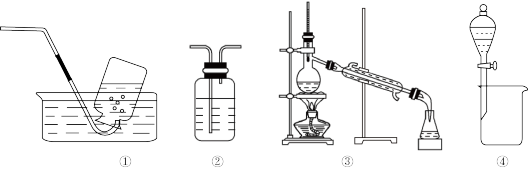

| A.用装置①收集铜与稀硝酸反应产生的NO |
| B.用装有饱和NaHCO3溶液的装置②除去Cl2中混有的HCl |
| C.用装置③分离Na2CO3溶液与CH3COOCH2CH3 |
| D.用装置④分离CH3CH2OH与CH3COOCH2CH3 |
您最近一年使用:0次
2021-08-13更新
|
346次组卷
|
4卷引用:吉林省(双辽市一中、长岭县一中、大安市一中、通榆县一中)2022届高三上学期摸底联考理综化学试题
7 . 化学与生产、生活、环境等社会实际密切相关。下列叙述错误的是
| A.雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 |
| B.洁厕灵的主要成分是盐酸,不能与“84”消毒液(主要成分是NaClO)混用 |
| C.推广使用煤液化技术,可减少二氧化碳等温室气体的排放 |
| D.Cl2、ClO2、O3和Na2O2等都具有强氧化性,但Na2O2不能用于饮用水的消毒 |
您最近一年使用:0次
2021-08-13更新
|
424次组卷
|
2卷引用:吉林省(双辽市一中、长岭县一中、大安市一中、通榆县一中)2022届高三上学期摸底联考理综化学试题
8 . 短周期主族元素X、Y、Z、W的原子序数依次增大,X与W同主族,X、W可以分别与Z形成原子个数比为1:1、2:1的两种化合物,Y与Z可以形成多种化合物,其中某些化合物是常见的空气污染物。下列说法正确的是
A.简单离子半径的大小关系: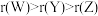 | B.X与Z形成的化合物都具有较强的热稳定性 |
C.简单氢化物的沸点: | D.化合物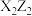 与 与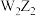 所含化学键类型完全相同 所含化学键类型完全相同 |
您最近一年使用:0次
2021-03-14更新
|
561次组卷
|
4卷引用:吉林省(双辽市一中、长岭县一中、大安市一中、通榆县一中)2022届高三上学期摸底联考理综化学试题
吉林省(双辽市一中、长岭县一中、大安市一中、通榆县一中)2022届高三上学期摸底联考理综化学试题河北省唐山市2021届高三学业水平选择性考试第一次模拟化学试题(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)
名校
解题方法
9 . T℃下,三种硫酸盐MSO4,(M表示Pb2+或Ba2+或Sr2+)的沉淀溶解平衡曲线如图所示。已知pM=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是( )


| A.BaSO4在任何条件下都不可能转化成PbSO4 |
| B.X点和Z点分别是SrSO4和BaSO4的饱和溶液,对应的溶液中c(M)=c(SO42-) |
| C.在ToC时,用0.01mol.L-1Na2SO4溶液滴定20mL浓度均是0.01mol.L-1的Ba(NO3)2和Sr(NO3)2的混合溶液,Sr2+先沉淀 |
D.ToC下,反应PbSO4(s)+Ba2+(aq) BaSO4(s)+Pb2+(aq)的平衡常数为102.4 BaSO4(s)+Pb2+(aq)的平衡常数为102.4 |
您最近一年使用:0次
2020-04-24更新
|
404次组卷
|
3卷引用:吉林省四平市2021-2022学年高三下学期最后冲刺化学试题
名校
解题方法
10 . 国际能源期刊报道了一种正在开发中的绿色环保“全氢电池”,有望减少废旧电池产生污染。其工作原理如图所示。下列说法正确的是
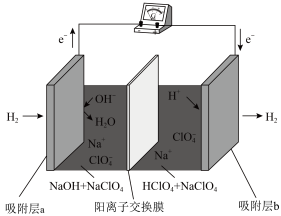

| A.“全氢电池”工作时,将酸碱反应的中和能转化为电能 |
| B.吸附层b发生的电极反应:H2 – 2e- + 2 OH-= 2H2O |
| C.Na+ 在装置中从右侧透过阳离子交换膜向左侧移动 |
| D.“全氢电池”的总反应: 2H2 + O2 =2H2O |
您最近一年使用:0次
2020-04-02更新
|
492次组卷
|
4卷引用:吉林省四平市2021-2022学年高三下学期最后冲刺化学试题
吉林省四平市2021-2022学年高三下学期最后冲刺化学试题北京市门头沟区2020届高三3月综合练习化学试题四川省绵阳南山中学 2020届三诊模拟考试理综化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编 选择题:热化学 电化学



