名校
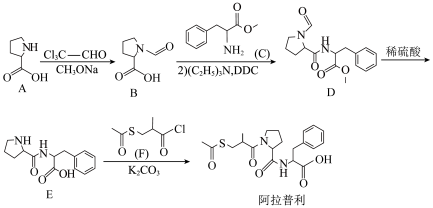
1 . 阿拉普利是治疗高血压的长效药,合成路线如图:
(1)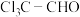 中官能团的名称为
中官能团的名称为_______ 。
(2)写出A→B的化学方程式:_______ ;制备E的过程中,设计A→B的目的是_______ 。
(3)E和F反应生成阿拉普利的反应类型是_______ ; 的作用是
的作用是_______ 。
(4)阿拉普利分子中含有_______ 个手性碳原子。
(5)C的芳香族同分异构体中,同时具备下列条件的结构有_______ 种(不包括立体异构体)。
①既能发生银镜反应,又能发生水解反应
②苯环上只有两种取代基,且其中一个为
其中核磁共振氢谱显示有五组峰,且峰面积比为6:2:2:2:1的结构简式为_______ 。
(1)
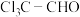 中官能团的名称为
中官能团的名称为(2)写出A→B的化学方程式:
(3)E和F反应生成阿拉普利的反应类型是
 的作用是
的作用是(4)阿拉普利分子中含有
(5)C的芳香族同分异构体中,同时具备下列条件的结构有
①既能发生银镜反应,又能发生水解反应
②苯环上只有两种取代基,且其中一个为

其中核磁共振氢谱显示有五组峰,且峰面积比为6:2:2:2:1的结构简式为
您最近一年使用:0次
7日内更新
|
406次组卷
|
4卷引用:2024届河南省周口市高三5月全真模拟理科综合试题-高中化学
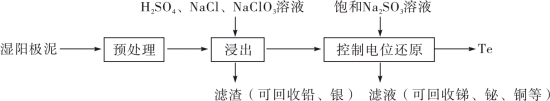
2 . 碲(Te)是一种重要的稀有分散元素,广泛应用于冶金、石油、化工、航空、电子等领域。以某冶炼厂的湿阳极泥(含水26%,主要含锑、砷、铅、铋、银和少量铜、碲等)为原料回收碲的流程如下:
请回答下列问题:
(1)52Te的基态原子的电子排布式为___________ 。
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是_______________ ;氧化后的原料还需粉碎、过筛,目的是_________________ 。
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为___________ 、___________ ;添加 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式________________ 。
(4)电解时为防止除Te以外的单质生成,需控制电位的范围为___________ ;加入饱和Na2SO3溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成_____________ (填化学式)。
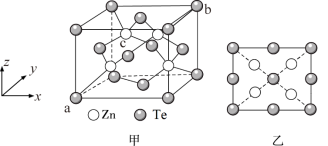
(5)将碲与锌一起加热,然后升华可制得碲化锌。碲化锌是一种重要的半导体材料,图甲为它的一种立方晶胞结构,图乙为该晶胞沿z轴投影图。已知a点的坐标为(0,0,0),b点的坐标为(1,1,1),则c点的坐标为_______________ ,设ZnTe的摩尔质量为M,阿伏加德罗常数的值为NA,密度为dg/cm3,则Zn与Te最近距离为___________ nm(列出计算式即可)。
物质 |
|
|
|
|
|
氧化还原电位(E)/V | 0.342 | 0.568 | 0.16 | 小于0.16 | 小于0.16 |
(1)52Te的基态原子的电子排布式为
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为
 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式(4)电解时为防止除Te以外的单质生成,需控制电位的范围为
 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成(5)将碲与锌一起加热,然后升华可制得碲化锌。碲化锌是一种重要的半导体材料,图甲为它的一种立方晶胞结构,图乙为该晶胞沿z轴投影图。已知a点的坐标为(0,0,0),b点的坐标为(1,1,1),则c点的坐标为
您最近一年使用:0次
7日内更新
|
61次组卷
|
2卷引用:2024届河南省许昌高级中学高三下学期三模化学试题
名校
3 . 葡萄糖酸钙是一种重要的补钙剂,工业上以葡萄糖、碳酸钙为原料,在溴化钠溶液中采用间接电氧化反应制备葡萄糖酸钙,其阳极区反应过程如下:
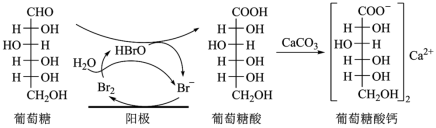
| A.溴化钠起催化和导电作用 |
B.每生成 葡萄糖酸钙,理论上电路中转移了0.1NA电子 葡萄糖酸钙,理论上电路中转移了0.1NA电子 |
| C.葡萄糖酸能通过分子内反应生成含有六元环状结构的产物 |
| D.葡萄糖能发生氧化、还原、取代、加成和消去反应 |
您最近一年使用:0次
7日内更新
|
81次组卷
|
2卷引用:2024届河南省许昌高级中学高三下学期三模化学试题
名校
解题方法
4 . 下列离子方程式书写正确的是
A.乙酰胺与盐酸混合共热:CH3CONH2+H2O+H+ CH3COOH+NH CH3COOH+NH |
| B.向硝酸银溶液中滴入少量氨水:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O |
C.向Na2S2O3溶液中加入足量稀硝酸:S2O +2H+=S↓+SO2↑+H2O +2H+=S↓+SO2↑+H2O |
D.一定条件下,由乳酸[CH3CH(OH)COOH]合成聚乳酸的化学方程式: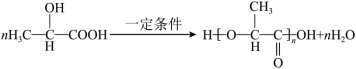 |
您最近一年使用:0次
7日内更新
|
231次组卷
|
2卷引用:2024届河南省许昌高级中学高三下学期三模化学试题
解题方法
5 . 非洛地平具有扩张动脉、降低血压的作用,可用于治疗高血压。一种合成路线如下: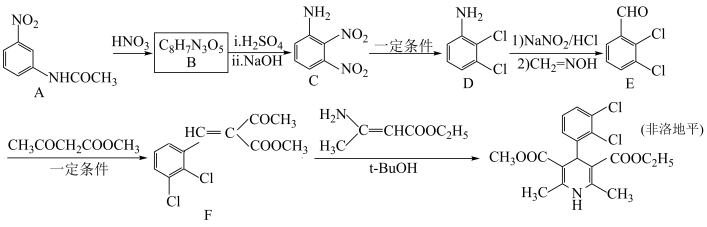
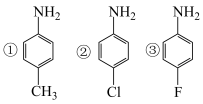
(1)已知氨基的N原子上电子云密度越大,碱性越强;卤素为吸电子基,甲基为推电子基。下列有机物碱性由强到弱排序为
(3)非洛地平中含氧官能团是
(4)E→F的化学方程式为
(5)在A的芳香族同分异构体中,同时含
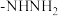 、-CHO、-OOCH结构的有
、-CHO、-OOCH结构的有(6)以苯甲醇和
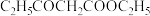 为原料合成
为原料合成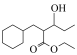 ,设计合成路线
,设计合成路线
您最近一年使用:0次
7日内更新
|
138次组卷
|
3卷引用:2024届河南省百所名校仿真模拟大联考三模考试理综试题-高中化学
名校
6 . 有机氟化学在材料科学、催化化学以及生物化学等领域引起了越来越多的重视。一种以Ni的配合物Ni(IMes)L催化氟苯的碳—氟键芳基化反应制备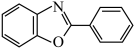 的机理如图所示。下列说法正确的是
的机理如图所示。下列说法正确的是
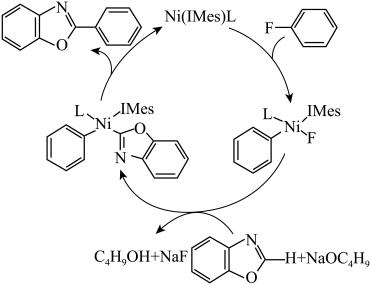
| A.该总反应原子利用率为100% |
| B.该历程涉及C-H键的断裂和形成 |
| C.该反应过程中涉及四种中间产物 |
D.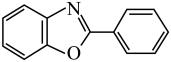 中苯环上的一氯代物7种 中苯环上的一氯代物7种 |
您最近一年使用:0次
7日内更新
|
147次组卷
|
2卷引用:2024届河南省信阳市高三下学期高考考前押题理科综合试卷-高中化学
解题方法
7 . 物质的转化是化学学习的重要内容,甲、乙、丙所代表的物质不符合如图所示转化关系的是
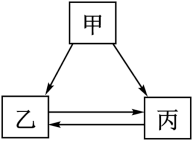
A. NaOH NaOH  | B.CuO   |
C. Fe Fe  | D. NaCl NaCl  |
您最近一年使用:0次
解题方法
8 . 物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
选项 | 性质差异 | 结构因素 |
A | 分子的极性: 强于 强于 | 磷氯键的极性强于氧硫键的极性 |
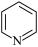
B | 熔点:金刚石高于 | 金刚石是共价晶体, 是分子晶体 是分子晶体 |
C | 酸性:HCOOH强于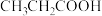 | HCOOH中的羟基极性更大 |
D | 在水中的溶解度(20℃) |
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-06-15更新
|
133次组卷
|
3卷引用:2024届河南省重点高中高三下学期4月联考模拟预测理综试题-高中化学
2024届河南省重点高中高三下学期4月联考模拟预测理综试题-高中化学吉林省松原市2024届高三下学期普通高等学校招生全国统一模拟考试大联考化学试题(已下线)期末押题卷01 -备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)
名校
9 . 常温下,用NaOH溶液分别滴定等物质的量浓度的HX(弱酸)、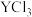 (可溶性盐)和
(可溶性盐)和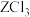 (可溶性盐)三种溶液。
(可溶性盐)三种溶液。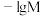 [M表示
[M表示 、
、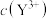 、
、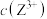 ]随溶液pH的变化如图所示。已知:
]随溶液pH的变化如图所示。已知: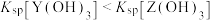 。下列说法错误的是
。下列说法错误的是
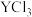 (可溶性盐)和
(可溶性盐)和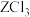 (可溶性盐)三种溶液。
(可溶性盐)三种溶液。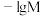 [M表示
[M表示 、
、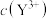 、
、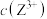 ]随溶液pH的变化如图所示。已知:
]随溶液pH的变化如图所示。已知: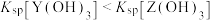 。下列说法错误的是
。下列说法错误的是
A.曲线I代表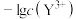 随溶液pH的变化关系 随溶液pH的变化关系 |
B. 的数量级是 的数量级是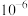 |
C. 固体能完全溶解在 固体能完全溶解在 溶液中 溶液中 |
D.滴定HX溶液至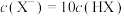 时,溶液中: 时,溶液中: |
您最近一年使用:0次
2024-06-11更新
|
132次组卷
|
2卷引用:2024届河南省漯河市高级中学高三下学期三模理综试题-高中化学
解题方法
10 . 2024年全国两会首次将“新质生产力”写进《政府工作报告》。氢能是新质生产力的重要组成部分,工业上常用氢气和氮气来合成氨。回答下列问题:
(1)我国首座商用分布式氨制氢加氢一体站在广西建成并成功试投产。氨制氢过程中的能量变化如下图所示。 键能为
键能为_______  ,氨气制氢反应的热化学方程式为
,氨气制氢反应的热化学方程式为_______ 。 ,在钨(W)表面发生分解反应生成
,在钨(W)表面发生分解反应生成 和
和 ,测得半衰期与温度、起始压强关系如下图所示。
,测得半衰期与温度、起始压强关系如下图所示。
①温度:
_______ (填“>”“<”或“=”) ,判断依据是
,判断依据是_______ 。
②在 温度、起始压强为200kPa下,半衰期为tmin时,总压强为
温度、起始压强为200kPa下,半衰期为tmin时,总压强为_______ kPa。
(3)在一恒温恒容密闭容器中充入1mol 和1mol
和1mol ,下列叙述正确的是_______(填标号)。
,下列叙述正确的是_______(填标号)。
(4)一定温度下,向一体积为1L的恒容密闭容器中充入1mol 和xmol
和xmol ,平衡体系中
,平衡体系中 体积分数与投料比
体积分数与投料比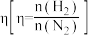 关系如下图所示。
关系如下图所示。 转化率最大的是
转化率最大的是_____ (填“a”“b”或“c”)点。b点时氨气的体积分数为25%,则该温度下合成氨的平衡常数K=_____ (只列计算式) 。
。
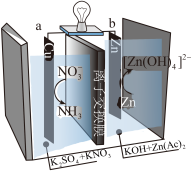
(5)我国科学家开发出高效催化电极,实现利用废水中的硝酸盐制备氨气,装置如下图所示。写出a电极的电极反应式:_______ 。
(1)我国首座商用分布式氨制氢加氢一体站在广西建成并成功试投产。氨制氢过程中的能量变化如下图所示。
 键能为
键能为 ,氨气制氢反应的热化学方程式为
,氨气制氢反应的热化学方程式为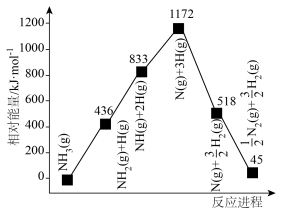
 ,在钨(W)表面发生分解反应生成
,在钨(W)表面发生分解反应生成 和
和 ,测得半衰期与温度、起始压强关系如下图所示。
,测得半衰期与温度、起始压强关系如下图所示。
①温度:

 ,判断依据是
,判断依据是②在
 温度、起始压强为200kPa下,半衰期为tmin时,总压强为
温度、起始压强为200kPa下,半衰期为tmin时,总压强为(3)在一恒温恒容密闭容器中充入1mol
 和1mol
和1mol ,下列叙述正确的是_______(填标号)。
,下列叙述正确的是_______(填标号)。A.达到平衡时,最多生成 |
B. 体积分数不变时,反应一定达到平衡状态 体积分数不变时,反应一定达到平衡状态 |
| C.充入少量氩气,逆反应速率大于正反应速率 |
D.达到平衡时及时液化分离出 , , 平衡转化率增大 平衡转化率增大 |
(4)一定温度下,向一体积为1L的恒容密闭容器中充入1mol
 和xmol
和xmol ,平衡体系中
,平衡体系中 体积分数与投料比
体积分数与投料比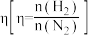 关系如下图所示。
关系如下图所示。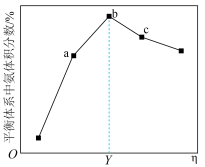
 转化率最大的是
转化率最大的是 。
。(5)我国科学家开发出高效催化电极,实现利用废水中的硝酸盐制备氨气,装置如下图所示。写出a电极的电极反应式:
您最近一年使用:0次
2024-06-10更新
|
66次组卷
|
3卷引用:2024届河南省百所名校仿真模拟大联考三模考试理综试题-高中化学

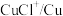

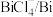
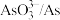
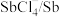
 高于
高于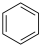
 能够与水分子形成氢键
能够与水分子形成氢键

