名校
解题方法
1 . 某高分子化合物M常用于制作眼镜镜片,可由N和P两种物质合成,M、N、P的结构如图所示,下列说法正确的是
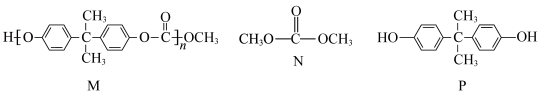
| A.N与P合成M的反应为加聚反应 | B.M的链节中在同一平面的碳原子最多有14个 |
| C.P在空气中很稳定,可以保存在广口瓶中 | D.常温下,M、N、P均易溶于水 |
您最近一年使用:0次
昨日更新
|
326次组卷
|
4卷引用:2024届山西省晋中市和诚高中高三下学期理综冲刺卷(二)-高中化学
解题方法
2 . 下列有关物质结构与性质的说法正确的是
A. 和 和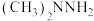 中C、O、N杂化方式均相同 中C、O、N杂化方式均相同 |
| B.含有手性碳原子的分子叫做手性分子 |
| C.NaClO和NaCl均为离子化合物,他们所含的化学键类型相同 |
D. 的空间结构为V形 的空间结构为V形 |
您最近一年使用:0次
解题方法
3 . 2023年9月23日晚,第19届亚运会在杭州开幕。下列有关说法错误的是
| A.火炬“薪火”使用的铝合金熔点比纯铝低 |
| B.“亚运莲花尊”的青瓷是以黏土为主要原料,经高温烧结而成 |
| C.会馆使用的防滑剂主要成分石墨烯与乙烯互为同系物 |
| D.主火炬塔的燃料首次使用废碳再生的绿色甲醇,有利于实现碳中和 |
您最近一年使用:0次
解题方法
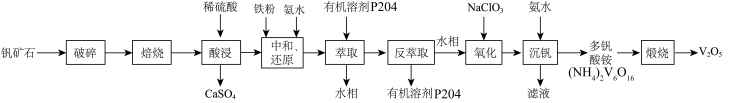
4 . V2O5广泛用于冶金、化工等行业,主要用于冶炼钒铁。以钒矿石为原料制备V2O5的工艺如下: “酸浸”后钒以
“酸浸”后钒以 形式存在,“中和还原”后钒以
形式存在,“中和还原”后钒以 形式存在。
形式存在。
ii.P204对四价钒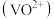 具有高选择性,且萃取
具有高选择性,且萃取 而不萃取
而不萃取 。
。
iii.多钒酸铵微溶于冷水,易溶于热水。
iv.该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“破碎”的目的是___________ 。
(2)“中和还原”时, 参与反应的离子方程式:
参与反应的离子方程式:___________ 。
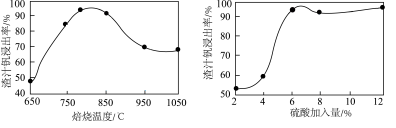
(3)钒的浸出率与焙烧温度、硫酸加入量的关系如图所示。指出适宜的工艺条件为___________ 。若在得到多钒酸铵后,使用冰水洗涤多钒酸铵的目的是___________ 。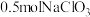 ,可得到
,可得到___________ 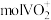 。
。
(5)流程中可偱环使用的物质有___________ 。
(6)萃取后的“水相”中含有丰富的金属资源,经三道工序可回收 溶液。请根据题给信息,参照上述工艺流程,将下列工艺流程补充完整
溶液。请根据题给信息,参照上述工艺流程,将下列工艺流程补充完整___________ (可选用的试剂: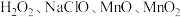 、
、 )。
)。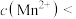
___________  。
。
 “酸浸”后钒以
“酸浸”后钒以 形式存在,“中和还原”后钒以
形式存在,“中和还原”后钒以 形式存在。
形式存在。ii.P204对四价钒
 具有高选择性,且萃取
具有高选择性,且萃取 而不萃取
而不萃取 。
。iii.多钒酸铵微溶于冷水,易溶于热水。
iv.该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Ca2+ | Mn2+ |
| 开始沉淀pH | 1.9 | 7.0 | 11.9 | 8.1 |
| 完全沉淀pH | 3.2 | 9.0 | 13.9 | 10.1 |
(1)“破碎”的目的是
(2)“中和还原”时,
 参与反应的离子方程式:
参与反应的离子方程式:(3)钒的浸出率与焙烧温度、硫酸加入量的关系如图所示。指出适宜的工艺条件为
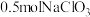 ,可得到
,可得到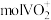 。
。(5)流程中可偱环使用的物质有
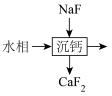
(6)萃取后的“水相”中含有丰富的金属资源,经三道工序可回收
 溶液。请根据题给信息,参照上述工艺流程,将下列工艺流程补充完整
溶液。请根据题给信息,参照上述工艺流程,将下列工艺流程补充完整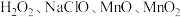 、
、 )。
)。
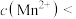
 。
。
您最近一年使用:0次
解题方法
5 . 甲烷是一种重要的化工原料,广泛应用于工业中。回答下列问题:
(1)甲烷在工业上可用于制备合成气: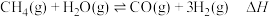 ,在某密闭容器中通入
,在某密闭容器中通入 和
和 ,在不同条件下发生反应。测得平衡时
,在不同条件下发生反应。测得平衡时 的体积分数与温度、压强的关系如图所示。
的体积分数与温度、压强的关系如图所示。
___________ (填“<”、“>”或“=”下同)P2,
___________ 0。
②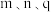 三点的化学平衡常数大小关系为
三点的化学平衡常数大小关系为___________ 。
③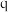 点甲烷的转化率为
点甲烷的转化率为___________ 。
(2)甲烷在一定条件下脱氢可生成乙烯,其反应如下: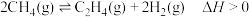 。
。 温度下,在体积为
温度下,在体积为 的刚性密闭容器中充入
的刚性密闭容器中充入 甲烷进行上述反应,容器内的总压强
甲烷进行上述反应,容器内的总压强 随时间
随时间 的变化如下表所示:
的变化如下表所示:
①下列有关说法正确的是___________ 。
A.当混合气的密度不变时,表明该反应已达到平衡状态
B.反应进行到第10分钟时刚好达到平衡
C.升温既可提高反应速率也能提高甲烷的转化率
D.使用适当的催化剂既可提高反应速率也能提高甲烷的转化率
E.该反应在较高温度下可自发进行
②前10min内,平均速率v(H2)=___________ kPa·min-1,实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),其中k正、k逆为速率常数,仅与温度有关,T1温度时,k正/k逆=___________ (填数值)。
(3)科研人员设计了甲烷燃料电池电解饱和食盐水装置如图所示,电池的电解质是掺杂了Y2O3与ZrO2的固体,可在高温下传导O2-。___________ 。
②用该电池电解100mL饱和食盐水,若电解一段时间后,两极产生的气体体积分别为0.224L和0.336L(均为标准状况),则电解所得溶液的pH=___________ (忽略气体溶解和溶液体积变化)。
(1)甲烷在工业上可用于制备合成气:
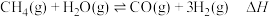 ,在某密闭容器中通入
,在某密闭容器中通入 和
和 ,在不同条件下发生反应。测得平衡时
,在不同条件下发生反应。测得平衡时 的体积分数与温度、压强的关系如图所示。
的体积分数与温度、压强的关系如图所示。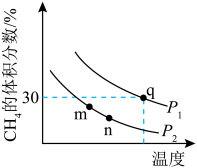


②
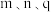 三点的化学平衡常数大小关系为
三点的化学平衡常数大小关系为③
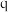 点甲烷的转化率为
点甲烷的转化率为(2)甲烷在一定条件下脱氢可生成乙烯,其反应如下:
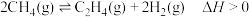 。
。 温度下,在体积为
温度下,在体积为 的刚性密闭容器中充入
的刚性密闭容器中充入 甲烷进行上述反应,容器内的总压强
甲烷进行上述反应,容器内的总压强 随时间
随时间 的变化如下表所示:
的变化如下表所示:| 反应时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| 总压强P/kPa | 10.0 | 11.5 | 12.3 | 13.0 | 13.6 | 14.0 | 14.0 |
A.当混合气的密度不变时,表明该反应已达到平衡状态
B.反应进行到第10分钟时刚好达到平衡
C.升温既可提高反应速率也能提高甲烷的转化率
D.使用适当的催化剂既可提高反应速率也能提高甲烷的转化率
E.该反应在较高温度下可自发进行
②前10min内,平均速率v(H2)=
(3)科研人员设计了甲烷燃料电池电解饱和食盐水装置如图所示,电池的电解质是掺杂了Y2O3与ZrO2的固体,可在高温下传导O2-。
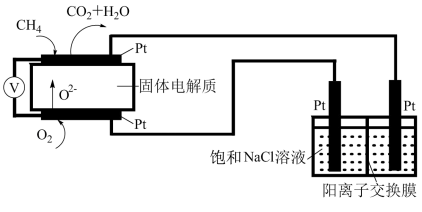
②用该电池电解100mL饱和食盐水,若电解一段时间后,两极产生的气体体积分别为0.224L和0.336L(均为标准状况),则电解所得溶液的pH=
您最近一年使用:0次
6 . 已知: ,且
,且 均为一元弱酸。常温下,向
均为一元弱酸。常温下,向 的
的 溶液和HY溶液中分别加水稀释,所得溶液pH与
溶液和HY溶液中分别加水稀释,所得溶液pH与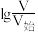 变化的关系如图所示,其中V为稀释后溶液体积,
变化的关系如图所示,其中V为稀释后溶液体积,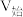 为起始时溶液体积,下列说法正确的是
为起始时溶液体积,下列说法正确的是
 ,且
,且 均为一元弱酸。常温下,向
均为一元弱酸。常温下,向 的
的 溶液和HY溶液中分别加水稀释,所得溶液pH与
溶液和HY溶液中分别加水稀释,所得溶液pH与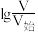 变化的关系如图所示,其中V为稀释后溶液体积,
变化的关系如图所示,其中V为稀释后溶液体积,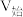 为起始时溶液体积,下列说法正确的是
为起始时溶液体积,下列说法正确的是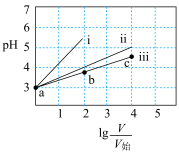
| A.线iii代表HY,线i或ii可代表HX |
B.升高温度, 点溶液 点溶液 不变 不变 |
C.水的电离程度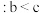 |
D.向等体积 点溶液加入 点溶液加入 固体恰好中和后,溶液中 固体恰好中和后,溶液中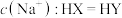 |
您最近一年使用:0次
解题方法
7 . 磺酰氯( )是一种重要的有机合成试剂,也是锂电池正极活性物质。实验室可利用
)是一种重要的有机合成试剂,也是锂电池正极活性物质。实验室可利用 与
与 在活性炭作用下制取少量的
在活性炭作用下制取少量的 ,装置如图所示(有些夹持装置省略)。
,装置如图所示(有些夹持装置省略)。 的熔点为-54.1℃,沸点为69.1℃,常温较稳定。100℃以上易分解。
的熔点为-54.1℃,沸点为69.1℃,常温较稳定。100℃以上易分解。
②
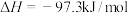
③ 遇水发生剧烈反应,并产生大量白雾。
遇水发生剧烈反应,并产生大量白雾。
回答下列问题:
(1)装置丙中发生反应的化学方程式为___________ 。
(2)仪器A的名称为___________ ,装置乙中盛放的试剂为___________ ,仪器F中盛放的试剂为___________ ,装置丁中应采取的控制温度的方式为___________ 。
(3)上述仪器的正确连接顺序是___________ 。(填仪器接口字母编号,仪器可重复使用)e→___________→g,h←___________←f
(4)某实验小组利用该装置消耗了标准状况下氯气1120mL( 足量),最后得到纯净的磺酰氯4.0g,则磺酰氯的产率为
足量),最后得到纯净的磺酰氯4.0g,则磺酰氯的产率为___________ (保留3位有效数字)。
(5)某公司开发的Li― 电池,其示意图如图。
电池,其示意图如图。 。则电池工作时,正极的电极反应式为
。则电池工作时,正极的电极反应式为___________ 。
 )是一种重要的有机合成试剂,也是锂电池正极活性物质。实验室可利用
)是一种重要的有机合成试剂,也是锂电池正极活性物质。实验室可利用 与
与 在活性炭作用下制取少量的
在活性炭作用下制取少量的 ,装置如图所示(有些夹持装置省略)。
,装置如图所示(有些夹持装置省略)。
 的熔点为-54.1℃,沸点为69.1℃,常温较稳定。100℃以上易分解。
的熔点为-54.1℃,沸点为69.1℃,常温较稳定。100℃以上易分解。②

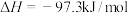
③
 遇水发生剧烈反应,并产生大量白雾。
遇水发生剧烈反应,并产生大量白雾。回答下列问题:
(1)装置丙中发生反应的化学方程式为
(2)仪器A的名称为
(3)上述仪器的正确连接顺序是
(4)某实验小组利用该装置消耗了标准状况下氯气1120mL(
 足量),最后得到纯净的磺酰氯4.0g,则磺酰氯的产率为
足量),最后得到纯净的磺酰氯4.0g,则磺酰氯的产率为(5)某公司开发的Li―
 电池,其示意图如图。
电池,其示意图如图。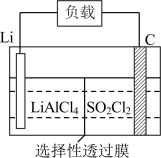
 。则电池工作时,正极的电极反应式为
。则电池工作时,正极的电极反应式为
您最近一年使用:0次
名校
8 . 化合物G是一种药物合成中间体,其一种合成路线如下:
(1)C中含氧官能团的名称为__________ ,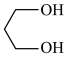 的系统命名为
的系统命名为___________ 。
(2)B→C的反应类型为__________ ;反应C→D的化学方程式为_______________ 。
(3)设计A→B的目的是____________________________ 。
(4)若F→G的反应经历F→X→G的过程,已知X的分子式为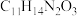 ,则X的结构简式为
,则X的结构简式为_______________ ,X→G的反应类型为_______________ 。
(5)E→F的反应中, 的作用是
的作用是____________________ 。
(6)化合物K是A的同系物且化合物K比化合物A多一个碳原子,满足以下条件的K的同分异构体有________ 种(不考虑立体异构),其中核磁共振氢谱峰面积之比为1∶2∶2∶2的结构简式为_____________ (写一种)。
1mol K的同分异构体与足量碳酸氢钠溶液反应,可以生成2mol 。
。
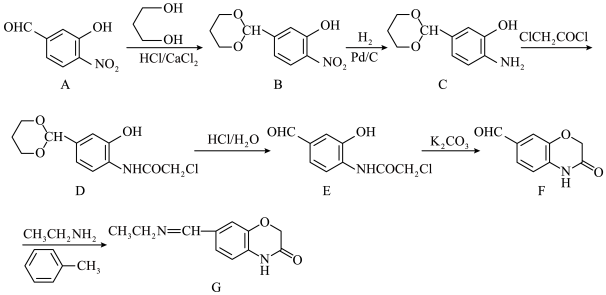
(1)C中含氧官能团的名称为
 的系统命名为
的系统命名为(2)B→C的反应类型为
(3)设计A→B的目的是
(4)若F→G的反应经历F→X→G的过程,已知X的分子式为
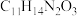 ,则X的结构简式为
,则X的结构简式为(5)E→F的反应中,
 的作用是
的作用是(6)化合物K是A的同系物且化合物K比化合物A多一个碳原子,满足以下条件的K的同分异构体有
1mol K的同分异构体与足量碳酸氢钠溶液反应,可以生成2mol
 。
。
您最近一年使用:0次
2024-06-07更新
|
91次组卷
|
2卷引用:2024届山西省大同市第一中学校高三下学期高考临门一脚(一)理综试卷-高中化学
解题方法
9 . 为早日实现“碳中和碳达峰”目标,科学家提出用钌(Ru)基催化剂催化 和
和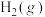 反应生成HCOOH.反应机理如图所示,已知当生成46g液态HCOOH时放出31.2kJ的热量。下列说法正确的是
反应生成HCOOH.反应机理如图所示,已知当生成46g液态HCOOH时放出31.2kJ的热量。下列说法正确的是
 和
和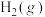 反应生成HCOOH.反应机理如图所示,已知当生成46g液态HCOOH时放出31.2kJ的热量。下列说法正确的是
反应生成HCOOH.反应机理如图所示,已知当生成46g液态HCOOH时放出31.2kJ的热量。下列说法正确的是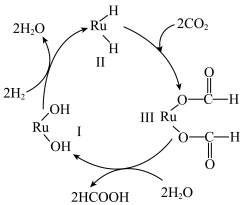
| A.反应历程中存在极性键、非极性键的断裂与形成 |
| B.物质Ⅰ为该反应的催化剂,物质Ⅱ、Ⅲ为中间产物 |
| C.催化剂能降低活化能,加快反应速率,改变反应热,从而提高转化率 |
D.通过 和 和 反应制备液态HCOOH,每转移1mol 反应制备液态HCOOH,每转移1mol ,放出31.2kJ的热量 ,放出31.2kJ的热量 |
您最近一年使用:0次
解题方法
10 . 烯烃是重要的化工原料,如乙烯、苯乙烯、丁二烯等。
(1)目前生产苯乙烯的方法主要是乙苯脱氢法,反应原理如下:
①则
___________ 。
②实际生产过程中,通常向乙苯中掺入水蒸气,保持体系总压为常压(101kPa)的条件下进行反应。掺入水蒸气的目的是___________ 。
③乙苯的平衡转化率与温度、投料比 的关系如图所示。
的关系如图所示。 ,保持体系总压为常压(101kPa),则A点温度下,该反应的平衡常数
,保持体系总压为常压(101kPa),则A点温度下,该反应的平衡常数
___________ kPa(列出计算式即可, 为用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
为用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
(2) 经催化加氢合成乙烯:
经催化加氢合成乙烯: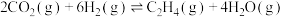
 。恒容条件下,按
。恒容条件下,按 投料,各物质平衡浓度变化与温度的关系如图所示:
投料,各物质平衡浓度变化与温度的关系如图所示:___________ 、___________ 的浓度。
②升高温度,平衡常数K___________ (填“减小”、“增大”或“不变”)。A点,
___________ (用 表示)。写出能提高乙烯平衡产率的措施
表示)。写出能提高乙烯平衡产率的措施___________ (任举两种)。
(3)丁二烯与卤素反应为有机合成的重要步骤,1,3-丁二烯和 反应的能量随反应过程的变化关系如图所示:
反应的能量随反应过程的变化关系如图所示: 反应会生成两种产物,一种称为动力学产物,由速率更快的反应生成;一种称为热力学产物,由产物更加稳定的反应生成。则动力学产物结构简式为
反应会生成两种产物,一种称为动力学产物,由速率更快的反应生成;一种称为热力学产物,由产物更加稳定的反应生成。则动力学产物结构简式为___________ 。
②T℃时在2L刚性密闭容器中充入1,3-丁二烯(g)( )和
)和 各2mol,发生反应。1,3-丁二烯及产物的物质的量分数随时间的变化如下表:
各2mol,发生反应。1,3-丁二烯及产物的物质的量分数随时间的变化如下表:
在0~20min内,反应体系中1,4-加成产物的平均反应速率v(1,4-加成产物)=___________ 。
(1)目前生产苯乙烯的方法主要是乙苯脱氢法,反应原理如下:
 。
。
| 共价键 |  |  |  |  |
键能 | 347.7 | 413.4 | 615 | 436 |

②实际生产过程中,通常向乙苯中掺入水蒸气,保持体系总压为常压(101kPa)的条件下进行反应。掺入水蒸气的目的是
③乙苯的平衡转化率与温度、投料比
 的关系如图所示。
的关系如图所示。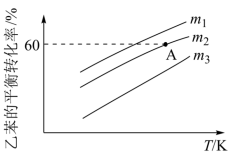
 ,保持体系总压为常压(101kPa),则A点温度下,该反应的平衡常数
,保持体系总压为常压(101kPa),则A点温度下,该反应的平衡常数
 为用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
为用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。(2)
 经催化加氢合成乙烯:
经催化加氢合成乙烯: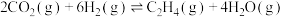
 。恒容条件下,按
。恒容条件下,按 投料,各物质平衡浓度变化与温度的关系如图所示:
投料,各物质平衡浓度变化与温度的关系如图所示:
②升高温度,平衡常数K

 表示)。写出能提高乙烯平衡产率的措施
表示)。写出能提高乙烯平衡产率的措施(3)丁二烯与卤素反应为有机合成的重要步骤,1,3-丁二烯和
 反应的能量随反应过程的变化关系如图所示:
反应的能量随反应过程的变化关系如图所示: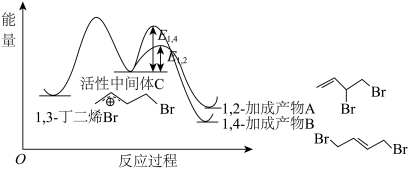
 反应会生成两种产物,一种称为动力学产物,由速率更快的反应生成;一种称为热力学产物,由产物更加稳定的反应生成。则动力学产物结构简式为
反应会生成两种产物,一种称为动力学产物,由速率更快的反应生成;一种称为热力学产物,由产物更加稳定的反应生成。则动力学产物结构简式为②T℃时在2L刚性密闭容器中充入1,3-丁二烯(g)(
 )和
)和 各2mol,发生反应。1,3-丁二烯及产物的物质的量分数随时间的变化如下表:
各2mol,发生反应。1,3-丁二烯及产物的物质的量分数随时间的变化如下表:| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| 1,3-丁二烯 | 100% | 72% | 0% | 0% | 0% |
| 1,2-加成产物 | 0% | 26% | 10% | 4% | 4% |
| 1,4-加成产物 | 0% | 2% | 90% | 96% | 96% |
您最近一年使用:0次



