名校
解题方法
1 . 维生素C,又称L-抗坏血酸,用于治疗坏血病,也可用于各种急慢性传染性疾病及紫癜等辅助治疗等。维生素C的结构简式如图所示。下列关于维生素C的说法错误的是
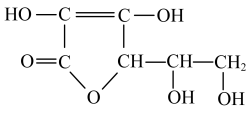
| A.维生素C中含有C、H、O三种元素 |
| B.分子中含有羰基 |
| C.能发生水解、氧化、消去反应 |
| D.能使酸性KMnO4溶液褪色 |
您最近一年使用:0次
2024-03-29更新
|
151次组卷
|
4卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题
名校
解题方法
2 . 短周期主族元素X、Y、Z、R、W的原子序数依次增大,R为地壳中含量最高的元素,乙在元素周期表中与R相邻,Y、Z原子序数之和为12。X、Y、W组成一种有机合成中常见的还原剂M,结构式如图所示。下列推断正确的是
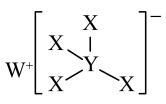
| A.原子半径:W>R>Z | B.W2R2是离子化合物 |
| C.熔点:W2R>ZX3>X2R | D.WZR3能破坏水的电离平衡 |
您最近一年使用:0次
2024-03-29更新
|
186次组卷
|
3卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题
3 . 已知:H2R是二元弱酸,HY是一元弱酸。常温下,分别向20mL。0.1mol/L的Na2R、NaY溶液中滴加0.1mol/L盐酸,测得溶液pM[pM=-lgM],M=x、y、z,x= 、y=
、y=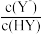 、z=
、z= 和pH关系如图所示。下列叙述正确的是
和pH关系如图所示。下列叙述正确的是
 、y=
、y=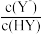 、z=
、z= 和pH关系如图所示。下列叙述正确的是
和pH关系如图所示。下列叙述正确的是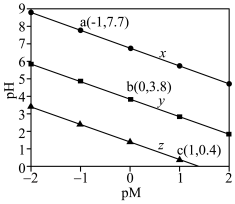
| A.NaY溶液呈中性 |
| B.直线y中b点时,c(Y-)>c(HY) |
| C.Ka1(H2R)=1×10-1.4 |
| D.a点时,溶液中c(Na+)+c(H+)=c(OH-)+c(HR-)+2c(R2-) |
您最近一年使用:0次
2024-03-15更新
|
66次组卷
|
3卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题
4 . 下列实验能达到目的的是
A.制备NO2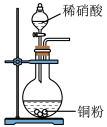 | B.除SO2中的HCl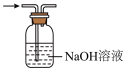 |
C.收集H2S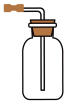 | D.证明氨气极易溶于水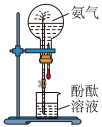 |
您最近一年使用:0次
2024-03-15更新
|
427次组卷
|
3卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题
名校
解题方法
5 . 氮氧化物是大气污染物之一,消除其造成的环境污染,对促进社会可持续发展有重要意义。回答下列问题:
(1)NH3(g)和O2(g)发生反应的反应历程如图所示。 5N2(g)+6H2O(g)的△H=
5N2(g)+6H2O(g)的△H=______ kJ/mol。
(2)在密闭容器中充入4molNH3和5molNO,反应4NH3(g)+6NO(g) 5N2(g)+6H2O(g)平衡时NH3的物质的量分数随温度、压强的变化关系如图。
5N2(g)+6H2O(g)平衡时NH3的物质的量分数随温度、压强的变化关系如图。______ (填字母)。
A.其他条件不变,升高温度平衡逆向移动
B.其他条件不变,增大压强,平衡不移动
C.NH3的质量不变时,则达到平衡状态
D.加入催化剂,则可以提高NO的平衡转化率
E.加入催化剂,能降低△H,加快化学反应速率
②A点NH3的平衡转化率为______ %(保留两位小数)。
③从平衡浓度的角度写出该反应的平衡常数表达式为K=______ ,K(B)______ K(C)______ K(E)(填“>”“<”或“=”)。
(3)以多孔石墨为电极的碱性电解池处理氮氧化物,装置如图:______ 、______ 。
②当电路中转移2mol电子时,阴极放电的O2的质量为______ g。
(1)NH3(g)和O2(g)发生反应的反应历程如图所示。
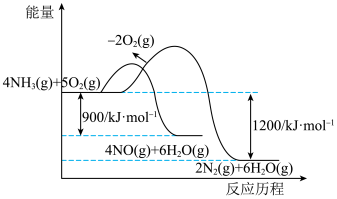
 5N2(g)+6H2O(g)的△H=
5N2(g)+6H2O(g)的△H=(2)在密闭容器中充入4molNH3和5molNO,反应4NH3(g)+6NO(g)
 5N2(g)+6H2O(g)平衡时NH3的物质的量分数随温度、压强的变化关系如图。
5N2(g)+6H2O(g)平衡时NH3的物质的量分数随温度、压强的变化关系如图。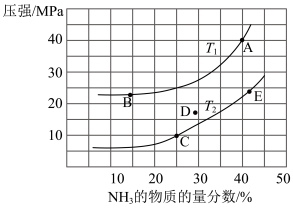
A.其他条件不变,升高温度平衡逆向移动
B.其他条件不变,增大压强,平衡不移动
C.NH3的质量不变时,则达到平衡状态
D.加入催化剂,则可以提高NO的平衡转化率
E.加入催化剂,能降低△H,加快化学反应速率
②A点NH3的平衡转化率为
③从平衡浓度的角度写出该反应的平衡常数表达式为K=
(3)以多孔石墨为电极的碱性电解池处理氮氧化物,装置如图:
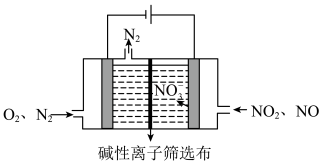
②当电路中转移2mol电子时,阴极放电的O2的质量为
您最近一年使用:0次
2024-03-15更新
|
209次组卷
|
4卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题
2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题河南省周口恒大中学2023-2024学年高三下学期3月月考化学试题(已下线)大题预测卷(黑龙江、吉林专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)(已下线)T29-原理综合题
名校
6 . 硅锰电池是一种新型电池,其工作原理如图所示。下列说法错误的是
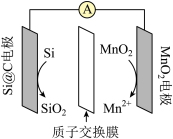
| A.Si@C电极为电池的负极 |
| B.电池工作时,H+向MnO2电极区移动 |
| C.电池放电时,MnO2发生还原反应 |
| D.放电时,当导线上每通过0.2mol电子,则会生成0.1molSiO2 |
您最近一年使用:0次
2024-03-15更新
|
280次组卷
|
4卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题
名校
7 . 设NA代表阿伏加德罗常数的值。下列说法正确的是
| A.18gH2O中含有中子的数目为10NA |
| B.标准状况下,22.4LH2O含氧原子总数为3NA |
| C.在锌铜原电池中,负极减少65g时理论上转移电子数为2NA |
| D.在4Na+O2=2Na2O中,46gNa参与反应时需要氧化剂分子数为NA |
您最近一年使用:0次
2024-03-15更新
|
215次组卷
|
2卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题
8 . 化合物J是一种治疗胆结石的药物,合成路线如图所示

已知:① ;
;
② ;
;
③RCOOR′+R″OH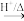 RCOOR″+R′OH(R、R′、R″代表烃基)。
RCOOR″+R′OH(R、R′、R″代表烃基)。
回答下列问题:
(1)H的分子式为___________ ,D的化学名称为___________ 。
(2)J中所含氧官能团的名称为___________ 。
(3)写出实验室用G制备E的化学方程式为___________ ,反应类型___________ 。
(4)H的结构中手性碳原子的数目为___________ ,同时符合下列条件的J的同分异构体有 ___________ 种(不考虑立体异构)。
①分子中苯环有二个取代基。
②与FeCl3溶液发生显色反应。
③与NaHCO3反应产生气体。
④分子中除苯环再无其他环状结构。
(5)已知酚羟基可以与羧酸发生酯化反应,根据上述合成路线和信息,以甲苯为原料(其它无机试剂任选),设计制备 的合成路线(提示:甲苯发生取代反应时取代间位的氢原子)。
的合成路线(提示:甲苯发生取代反应时取代间位的氢原子)。_________

已知:①
 ;
;②
 ;
;③RCOOR′+R″OH
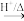 RCOOR″+R′OH(R、R′、R″代表烃基)。
RCOOR″+R′OH(R、R′、R″代表烃基)。 回答下列问题:
(1)H的分子式为
(2)J中所含氧官能团的名称为
(3)写出实验室用G制备E的化学方程式为
(4)H的结构中手性碳原子的数目为
①分子中苯环有二个取代基。
②与FeCl3溶液发生显色反应。
③与NaHCO3反应产生气体。
④分子中除苯环再无其他环状结构。
(5)已知酚羟基可以与羧酸发生酯化反应,根据上述合成路线和信息,以甲苯为原料(其它无机试剂任选),设计制备
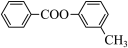 的合成路线(提示:甲苯发生取代反应时取代间位的氢原子)。
的合成路线(提示:甲苯发生取代反应时取代间位的氢原子)。
您最近一年使用:0次
解题方法
9 . 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、磷、硼、镓、硒等。已知铜的配合物A结构如图。请回答

(1)基态铜原子的电子排布式为___________ ,单晶硅的晶体类型为___________ 。
(2)PCl3的立体结构为___________ ,中心原子的杂化轨道类型为___________ 。
(3)B、C、N、O四种元素第一电离能由大到小的顺序为___________ 。
(4)硅元素的同一主族元素碳,碳元素形成的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:

回答下列问题:
石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm,其原因是石墨层内的C-C键间存在___________ 键,而金刚石中只存在C-C键间的___________ 共价键;金刚石晶胞含有___________ 个碳原子。若碳原子半径为a,金刚石晶胞的边长为b。计算表示碳原子在晶胞中的空间占有率___________ (不要求计算结果)。

(1)基态铜原子的电子排布式为
(2)PCl3的立体结构为
(3)B、C、N、O四种元素第一电离能由大到小的顺序为
(4)硅元素的同一主族元素碳,碳元素形成的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:

回答下列问题:
石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm,其原因是石墨层内的C-C键间存在
您最近一年使用:0次
10 . 氮及其化合物在人们的日常生活、生产工业中和环保事中属于“明星物质”,目前最成功的应用就是“人工固氮”,在某特殊催化剂和光照条件下,N2与水反应可生成NH3 。
(1)已知:
①4NH3(g) + 3O2 (g) 2N2 (g) + 6H2O(g) ΔH1 =-1260 kJ/mol;
2N2 (g) + 6H2O(g) ΔH1 =-1260 kJ/mol;
②H2O(l)= H2O(g) ΔH2=+44.0 kJ/mol。
则 2N2(g) + 6H2O(1) 4NH3(g)+ 3O2(g) ΔH3 =
4NH3(g)+ 3O2(g) ΔH3 =___________ kJ / mol
(2)N2(g) + 3H2 (g) 2NH3 (g) ΔH=-92.4 kJ/mol。将1. 00 mol N2和3. 00 mol H2充入容积为3 L的恒容密闭容器中,发生上述反应。
2NH3 (g) ΔH=-92.4 kJ/mol。将1. 00 mol N2和3. 00 mol H2充入容积为3 L的恒容密闭容器中,发生上述反应。
①图甲是测得X、Y的浓度随时间变化的曲线,反应达到平衡时的平均反应速率v(H2)=___________ 。

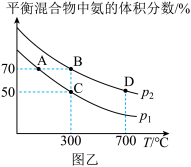
②在不同温度和压强下,平衡体系中NH3的体积分数与温度、压强关系如图乙,则压强P2___________ P1 (填“大于”“小于”或“不确定”,下同),B、D两点的平衡常数K(D)___________ K(B),B点N2的转化率=___________ (保留4位有效数字)。
(3)在恒容密闭容器中充入NH3和NO2,在一定温度下发生反应:8NH3(g) + 6NO2(g) 7N2(g) + 12H2O(g)。下列表明该反应能达到平衡状态的是
7N2(g) + 12H2O(g)。下列表明该反应能达到平衡状态的是___________ (填字母)
a. 混合气体压强保持不变 b. 混合气体密度保持不变
c. NO2和NH3的消耗速率之比为3 : 4 d. 混合气体颜色不变
(4)“绿水青山就是金山银山”,利用原电池原理(6NO2 + 8NH3 =7N2 + 12H2O),可以处理氮的氧化物和NH3尾气,装置原理图如图丙,正极反应式为___________ ,当有标准状况下44.8 L NO2被处理时,转移电子的物质的量为___________ mol。

(1)已知:
①4NH3(g) + 3O2 (g)
 2N2 (g) + 6H2O(g) ΔH1 =-1260 kJ/mol;
2N2 (g) + 6H2O(g) ΔH1 =-1260 kJ/mol;②H2O(l)= H2O(g) ΔH2=+44.0 kJ/mol。
则 2N2(g) + 6H2O(1)
 4NH3(g)+ 3O2(g) ΔH3 =
4NH3(g)+ 3O2(g) ΔH3 =(2)N2(g) + 3H2 (g)
 2NH3 (g) ΔH=-92.4 kJ/mol。将1. 00 mol N2和3. 00 mol H2充入容积为3 L的恒容密闭容器中,发生上述反应。
2NH3 (g) ΔH=-92.4 kJ/mol。将1. 00 mol N2和3. 00 mol H2充入容积为3 L的恒容密闭容器中,发生上述反应。 ①图甲是测得X、Y的浓度随时间变化的曲线,反应达到平衡时的平均反应速率v(H2)=

②在不同温度和压强下,平衡体系中NH3的体积分数与温度、压强关系如图乙,则压强P2

(3)在恒容密闭容器中充入NH3和NO2,在一定温度下发生反应:8NH3(g) + 6NO2(g)
 7N2(g) + 12H2O(g)。下列表明该反应能达到平衡状态的是
7N2(g) + 12H2O(g)。下列表明该反应能达到平衡状态的是a. 混合气体压强保持不变 b. 混合气体密度保持不变
c. NO2和NH3的消耗速率之比为3 : 4 d. 混合气体颜色不变
(4)“绿水青山就是金山银山”,利用原电池原理(6NO2 + 8NH3 =7N2 + 12H2O),可以处理氮的氧化物和NH3尾气,装置原理图如图丙,正极反应式为

您最近一年使用:0次



