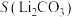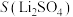名校
1 . 前四周期元素X、Y、Z、W、Q原子序数依次增大,其中Y、Z同周期,Z、W同主族;X、Y、Z是人体内含量最高的三种元素,X、Y、Z、W、Q五原子核外电子数之和为51。下列叙述合理的是
A.原子半径 |
| B.X、Y形成的化合物沸点低于X、Z形成的化合物 |
| C.这些元素组成的三元化合物都可溶于水 |
D. 的一种化合物常加于煤中,避免煤燃烧产生的 的一种化合物常加于煤中,避免煤燃烧产生的 的某种氧化物污染空气 的某种氧化物污染空气 |
您最近一年使用:0次
昨日更新
|
239次组卷
|
3卷引用:2024届四川省成都市第七中学高三下学期5月模拟考试理科综合试题-高中化学
2 .  、
、 (主要指
(主要指 和
和 )是大气主要污染物之一。有效去除大气中的
)是大气主要污染物之一。有效去除大气中的 、
、 是环境保护的重要课题。
是环境保护的重要课题。
已知:
反应1: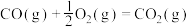
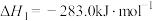
反应2:
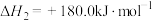
反应3:

反应4:
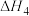
回答下列问题:
(1)计算
_______  。
。
(2)已知反应4在某催化剂作用下的反应历程如图。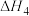
_______ (填“ ”或“
”或“ ”)0。
”)0。
②该反应历程的决速步骤为_______ 。
③可提高该反应中 平衡转化率的措施有
平衡转化率的措施有_______ (填两条)。
(3)向密闭容器中充入一定量的 和
和 ,保持总压为
,保持总压为 ,发生反应4.当
,发生反应4.当 时
时 的平衡转化率随温度
的平衡转化率随温度 以及
以及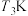 下NO的平衡转化率随投料比
下NO的平衡转化率随投料比 的变化关系如图:
的变化关系如图:_______ (填标号)。
A.气体的密度保持不变 B. 的浓度不变 C.
的浓度不变 C.
②表示 时
时 的平衡转化率随温度
的平衡转化率随温度 的变化关系曲线是(填“Ⅰ”或“II”),理由是
的变化关系曲线是(填“Ⅰ”或“II”),理由是_______ 。
③a、d两点对应的平衡常数大小比较为
_______ (填“>”“<”或“=”)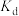 。
。
④b点对应条件下的压强平衡常数
_______  (
( 为用分压表示的平衡常数,分压=总压×物质的量分数,列出计算式即可)。
为用分压表示的平衡常数,分压=总压×物质的量分数,列出计算式即可)。
 、
、 (主要指
(主要指 和
和 )是大气主要污染物之一。有效去除大气中的
)是大气主要污染物之一。有效去除大气中的 、
、 是环境保护的重要课题。
是环境保护的重要课题。已知:
反应1:
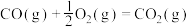
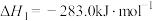
反应2:

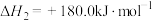
反应3:


反应4:

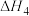
回答下列问题:
(1)计算

 。
。(2)已知反应4在某催化剂作用下的反应历程如图。

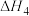
 ”或“
”或“ ”)0。
”)0。②该反应历程的决速步骤为
③可提高该反应中
 平衡转化率的措施有
平衡转化率的措施有(3)向密闭容器中充入一定量的
 和
和 ,保持总压为
,保持总压为 ,发生反应4.当
,发生反应4.当 时
时 的平衡转化率随温度
的平衡转化率随温度 以及
以及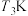 下NO的平衡转化率随投料比
下NO的平衡转化率随投料比 的变化关系如图:
的变化关系如图: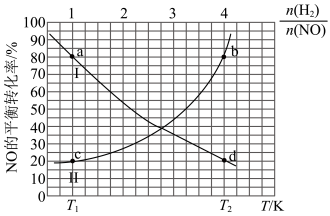
A.气体的密度保持不变 B.
 的浓度不变 C.
的浓度不变 C.
②表示
 时
时 的平衡转化率随温度
的平衡转化率随温度 的变化关系曲线是(填“Ⅰ”或“II”),理由是
的变化关系曲线是(填“Ⅰ”或“II”),理由是③a、d两点对应的平衡常数大小比较为

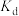 。
。④b点对应条件下的压强平衡常数

 (
( 为用分压表示的平衡常数,分压=总压×物质的量分数,列出计算式即可)。
为用分压表示的平衡常数,分压=总压×物质的量分数,列出计算式即可)。
您最近一年使用:0次
名校
3 . W、X、Y、Z、M是原子序数依次增大的短周期主族元素,其中X是形成化合物种类最多的元素,Y元素原子的最外层电子数是W的2倍,由五种元素组成的某电极材料的结构如图所示。下列说法一定正确的是

A.氢化物沸点: |
B.原子半径: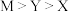 |
| C.由M单质和Y单质反应生成的化合物中可能存在共价键 |
| D.元素W的最高价氧化物的水化物为三元弱酸 |
您最近一年使用:0次
名校
解题方法
4 . 下列有关甲,乙两种有机物的说法正确的是
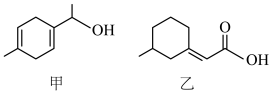
| A.甲的分子式为C9H12O |
| B.甲中所有原子可能共平面 |
| C.甲和乙均能与钠、氢氧化钠溶液反应 |
| D.甲和乙之间能发生取代反应 |
您最近一年使用:0次
名校
解题方法
5 . 设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是| A.0.1mol乙烷中含非极性键的数目为0.2NA |
B.1L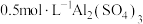 溶液中 溶液中 数目等于 数目等于 |
C.标准状况下,11.2L HF含有的电子数等于 |
| D.18g重水(D2O)中含有的中子数为9NA |
您最近一年使用:0次
名校
解题方法
6 . 化学与生活、科技及环境密切相关。下列说法正确的是
| A.我国北斗系统导航卫星应用于生活各方面,如手机、汽车等,其计算机的芯片材料是一种有机高分子材料 |
| B.主火炬燃料甲醇是以CO2为原料合成再生的,该合成法是实现“碳中和”的重要途径 |
| C.二氧化硫和NaClO都有漂白性,将两者混用漂白效果更好 |
| D.《新修本草》中有关于“青矾”(FeSO4·7H2O)的描述为:“本来绿色,新出窟未见风者,正如瑙璃……烧之赤色……”这里的赤色是析出了Cu单质 |
您最近一年使用:0次
名校
7 . 下列各组离子在指定溶液中, 一定能大量共存的是
A.无色溶液中: 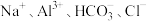 |
B.水电离的  浓度 浓度  的溶液中: 的溶液中:  |
C.使甲基橙变黄的溶液中:  |
D.无色溶液中: 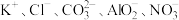 |
您最近一年使用:0次
名校
解题方法
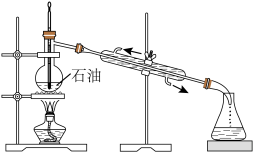
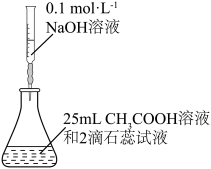
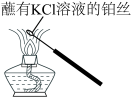
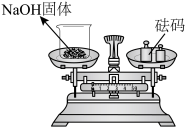
8 . 化学实验操作是进行科学实验的基础。下列操作合理的是
|
|
| A.石油分馏 | B.用NaOH标准溶液滴定未知浓度的 溶液 溶液 |
|
|
| C.观察K元素的焰色 | D.称量NaOH固体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-06-12更新
|
173次组卷
|
6卷引用:2024届四川省南充市西充县部分校高三下学期模拟联考理科综合试题-高中化学
名校
解题方法
9 . 2023年化学诺贝尔奖授予了三位研究量子点的科学家。量子点又称“人造原子”、“超原子”,是一种纳米级的半导体材料,在医疗,科技等多个领域有广泛的应用。
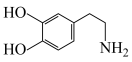
(1)聚多巴胺量子点具有广泛的光学吸收和荧光特性,可直接用于体内成像。多巴胺结构如下图所示。___________ ,其最高能层上有___________ 种运动状态不同的电子。
②多巴胺分子中碳原子的杂化方式为___________ ,1mol多巴胺中含有 键的数目为
键的数目为___________ 。
③多巴胺易溶于水,原因是___________ 。
(2)聚多巴胺量子点还可以通过吸附金属离子如 ,
, ,
, 等用于核磁共振成像(MRI)。
等用于核磁共振成像(MRI)。
① 中含有
中含有 ,其阴离子空间构型为
,其阴离子空间构型为___________ 。
②Mn的第三电离能大于Fe的第三电离能,原因是___________ 。
(3)CdS量子点是一种常见的量子点。某种CdS晶体的立方晶胞如下图所示。 的配位数为
的配位数为___________ 。
②若CdS晶体的密度为 ,则晶胞中
,则晶胞中 和
和 间的最短距离为
间的最短距离为___________ pm(列出计算式即可)。
(1)聚多巴胺量子点具有广泛的光学吸收和荧光特性,可直接用于体内成像。多巴胺结构如下图所示。
②多巴胺分子中碳原子的杂化方式为
 键的数目为
键的数目为③多巴胺易溶于水,原因是
(2)聚多巴胺量子点还可以通过吸附金属离子如
 ,
, ,
, 等用于核磁共振成像(MRI)。
等用于核磁共振成像(MRI)。①
 中含有
中含有 ,其阴离子空间构型为
,其阴离子空间构型为②Mn的第三电离能大于Fe的第三电离能,原因是
(3)CdS量子点是一种常见的量子点。某种CdS晶体的立方晶胞如下图所示。

 的配位数为
的配位数为②若CdS晶体的密度为
 ,则晶胞中
,则晶胞中 和
和 间的最短距离为
间的最短距离为
您最近一年使用:0次
2024-06-11更新
|
198次组卷
|
3卷引用:2024届四川省凉山州高三下学期三诊考试理科综合试题-高中化学
名校
解题方法
10 . 碳酸锂是制备锂电池的重要原料。一种由α—锂辉石(主要成分可用 表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下:
表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下: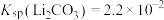 ,各离子沉淀pH范围:
,各离子沉淀pH范围:
回答下列问题:
(1)“煅烧”过程中 转化为
转化为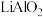 ,写出
,写出 与生石灰反应的化学反应方程式
与生石灰反应的化学反应方程式_______ 。
(2)硫酸作为浸取酸时需要加入少量硝酸,其作用是_______ ;“调节pH”步骤应当控制的pH范围为_______ ,
(3)写出“除锰”过程中的离子反应方程式_______ 。若“除钙”后滤液中Li+浓度为0.2mol/L,则该步骤后 浓度应该低于
浓度应该低于_______ mol/L。
(4)已知 、
、 的溶解度(g/100g水)如下表所示:
的溶解度(g/100g水)如下表所示:
“沉锂”后应该选择_______ ℃(选填“20”、“50”和“80”)蒸馏水洗涤,写出检验沉淀是否洗涤干净的操作_______ 。
(5)“沉锂”后所得碳酸锂再次经过“碳化”—“热解”步骤的目的是_______ 。将碳酸锂与 混合,在空气中焙烧可制备电池阴极材料
混合,在空气中焙烧可制备电池阴极材料 ,写出其化学反应方程式
,写出其化学反应方程式_______ 。
 表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下:
表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下:
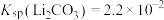 ,各离子沉淀pH范围:
,各离子沉淀pH范围:离子 |
|
|
|
|
开始沉淀pH | 7.6 | 2.7 | 3.8 | 8.3 |
沉淀完全pH | 9.7 | 3.2 | 5.2 | 9.8 |
(1)“煅烧”过程中
 转化为
转化为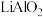 ,写出
,写出 与生石灰反应的化学反应方程式
与生石灰反应的化学反应方程式(2)硫酸作为浸取酸时需要加入少量硝酸,其作用是
(3)写出“除锰”过程中的离子反应方程式
 浓度应该低于
浓度应该低于(4)已知
 、
、 的溶解度(g/100g水)如下表所示:
的溶解度(g/100g水)如下表所示:T/℃ | 20 | 50 | 80 |
| 1.33 | 1.10 | 0.85 |
| 34.2 | 32.5 | 30.7 |
(5)“沉锂”后所得碳酸锂再次经过“碳化”—“热解”步骤的目的是
 混合,在空气中焙烧可制备电池阴极材料
混合,在空气中焙烧可制备电池阴极材料 ,写出其化学反应方程式
,写出其化学反应方程式
您最近一年使用:0次
2024-06-11更新
|
176次组卷
|
3卷引用:2024届四川省眉山市高三下学期第三次诊断考试理科综合试题 -高中化学