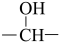2024·上海·模拟预测
1 . 人类利用二氧化碳合成淀粉对社会的发展起着重要作用,合成过程首先是利用二氧化碳制备甲醇,合成甲醇的反应为
 。回答下列问题:
。回答下列问题:
(1)已知:
①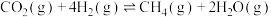
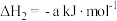 ;
;
②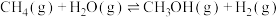
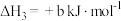 ;
;
③a、b均为大于零的数,且a>b。

___________ (用含a、b的式子表示) 。某研究小组设计合成
。某研究小组设计合成 的路线及
的路线及 的部分应用如图所示,图中熔融碳酸盐燃料电池的正极电极反应式为
的部分应用如图所示,图中熔融碳酸盐燃料电池的正极电极反应式为___________ 。___________ 。 的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。
的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。___________ 。
②结合图3及学过的知识推测,有水参与的历程,反应速率加快的原因是___________ 。
(4)在T℃时,将6mol (g)和12mol
(g)和12mol  (g)充入容积为10L的恒容容器中,只发生
(g)充入容积为10L的恒容容器中,只发生
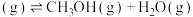 ,初始压强为
,初始压强为 kPa,测得体系中剩余
kPa,测得体系中剩余 (g)的物质的量随时间变化如图中状态Ⅰ所示。
(g)的物质的量随时间变化如图中状态Ⅰ所示。_______ mol/(L·min),该反应的平衡常数Kp=_______ kPa-2。(用平衡分压代替平衡浓度计算,列出计算式)
②保持投料量不变,仅改变某一个条件后,测得 随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是
随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是___________ 。
(5)一种可吸附甲醇的材料,其化学式为 ,部分晶体结构如图所示,其中
,部分晶体结构如图所示,其中 为平面结构。
为平面结构。

 。回答下列问题:
。回答下列问题:(1)已知:
①
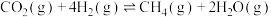
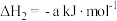 ;
;②
 ;
;③a、b均为大于零的数,且a>b。

 。某研究小组设计合成
。某研究小组设计合成 的路线及
的路线及 的部分应用如图所示,图中熔融碳酸盐燃料电池的正极电极反应式为
的部分应用如图所示,图中熔融碳酸盐燃料电池的正极电极反应式为
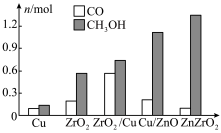
 的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。
的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。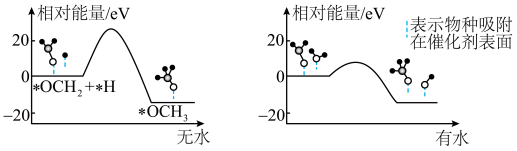
②结合图3及学过的知识推测,有水参与的历程,反应速率加快的原因是
(4)在T℃时,将6mol
 (g)和12mol
(g)和12mol  (g)充入容积为10L的恒容容器中,只发生
(g)充入容积为10L的恒容容器中,只发生
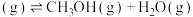 ,初始压强为
,初始压强为 kPa,测得体系中剩余
kPa,测得体系中剩余 (g)的物质的量随时间变化如图中状态Ⅰ所示。
(g)的物质的量随时间变化如图中状态Ⅰ所示。
②保持投料量不变,仅改变某一个条件后,测得
 随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是
随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是(5)一种可吸附甲醇的材料,其化学式为
 ,部分晶体结构如图所示,其中
,部分晶体结构如图所示,其中 为平面结构。
为平面结构。
A.该晶体中存在 氢键 氢键 |
B. 中C原子为 中C原子为 杂化 杂化 |
C.基态原子的未成对电子数: |
D.基态原子的第一电离能: |
您最近一年使用:0次
2 . 碳的多种同素异形体及一系列化合物广泛应用于科研、医疗、工农业生产等领域。
(1)写出基态C原子核外电子排布的轨道表示式_______ 。
(2)C原子在形成化合物时,可采取多种杂化方式。杂化轨道中s轨道成分越多,C元素的电负性越强,连接在该C原子上的H原子越容易电离。下列化合物中,最有可能在碱性体系中形成负离子的是_______。
(1)写出基态C原子核外电子排布的轨道表示式
(2)C原子在形成化合物时,可采取多种杂化方式。杂化轨道中s轨道成分越多,C元素的电负性越强,连接在该C原子上的H原子越容易电离。下列化合物中,最有可能在碱性体系中形成负离子的是_______。
A. | B. | C. | D.苯 |
您最近一年使用:0次
名校
解题方法
3 . T℃时,向2.0L的恒容密闭容器中充入1.0mol 和0.6mol
和0.6mol ,发生如下反应:
,发生如下反应: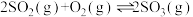 。20s时反应达到平衡,
。20s时反应达到平衡, 和
和 相等。
相等。
(1)0~20s内,
_______  。
。
(2)平衡后向容器中再充入0.4mol 和0.3mol
和0.3mol ,此时,
,此时, _______
_______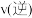 。
。
(3)相同温度下,起始投料变为0.5mol 和0.3mol
和0.3mol ,
, 的平衡转化率_______。
的平衡转化率_______。
 和0.6mol
和0.6mol ,发生如下反应:
,发生如下反应: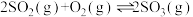 。20s时反应达到平衡,
。20s时反应达到平衡,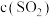 和
和 相等。
相等。(1)0~20s内,
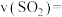
 。
。(2)平衡后向容器中再充入0.4mol
 和0.3mol
和0.3mol ,此时,
,此时, _______
_______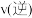 。
。| A.大于 | B.小于 | C.等于 | D.无法判断 |
(3)相同温度下,起始投料变为0.5mol
 和0.3mol
和0.3mol ,
, 的平衡转化率_______。
的平衡转化率_______。| A.增大 | B.不变 | C.减小 | D.无法判断 |
您最近一年使用:0次
4 . 大气中 能通过高温下与
能通过高温下与 反应进行协同转化处理。反应原理为:
反应进行协同转化处理。反应原理为: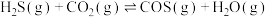 ,工业中测得的产物中有
,工业中测得的产物中有 、
、 、CO等副产物。
、CO等副产物。
(1)一定温度下,在恒容密闭容器中发生以上反应,下列条件能判断反应达到平衡状态的是___________。
(2)在573K下,向2L恒容密闭容器中通入2mol 和1mol
和1mol  ,反应达到平衡后水蒸气的物质的量分数为0.2。
,反应达到平衡后水蒸气的物质的量分数为0.2。
①上述条件下 的平衡转化率
的平衡转化率
___________ %。
②在上述平衡体系中再加2mol 和2mol
和2mol  ,通过数据说明平衡移动的方向
,通过数据说明平衡移动的方向___________ 。
(3)在不同温度下,向密闭容器甲、乙中分别充入2mol 和1mol
和1mol  ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。___________ 。
A.甲 B.乙 C.甲、乙中任一个
②1173K以后平衡转化率变化的原因可能是___________ 。
 能通过高温下与
能通过高温下与 反应进行协同转化处理。反应原理为:
反应进行协同转化处理。反应原理为: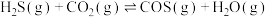 ,工业中测得的产物中有
,工业中测得的产物中有 、
、 、CO等副产物。
、CO等副产物。(1)一定温度下,在恒容密闭容器中发生以上反应,下列条件能判断反应达到平衡状态的是___________。
A.容器内 不再生成 不再生成 | B.容器内压强不再发生变化 |
| C.容器内气体密度不再发生变化 | D. |
(2)在573K下,向2L恒容密闭容器中通入2mol
 和1mol
和1mol  ,反应达到平衡后水蒸气的物质的量分数为0.2。
,反应达到平衡后水蒸气的物质的量分数为0.2。①上述条件下
 的平衡转化率
的平衡转化率
②在上述平衡体系中再加2mol
 和2mol
和2mol  ,通过数据说明平衡移动的方向
,通过数据说明平衡移动的方向(3)在不同温度下,向密闭容器甲、乙中分别充入2mol
 和1mol
和1mol  ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。
A.甲 B.乙 C.甲、乙中任一个
②1173K以后平衡转化率变化的原因可能是
您最近一年使用:0次
名校
5 . 缓释布洛芬具有解热、镇痛、抗炎等功效,一种合成缓释布洛芬的路线如下:
(1)化合物Ⅰ的分子式为___________ ,缓释布洛芬的结构简式为___________ 。
(2)化合物Ⅱ易溶于水的原因是___________ ,化合物Ⅳ+Ⅴ→Ⅵ的反应类型是___________ 。
(3)根据化合物Ⅲ的结构特征,分析预测其可能的化学性质,完成下表。
(4)写出Ⅲ→Ⅳ的化学方程式:___________ 。
(5)同时满足下列条件的化合物Ⅴ的同分异构体共有___________ 种(不考虑立体异构),其中核磁共振氢谱中峰面积比为6∶3∶2∶2∶1的结构简式为___________ 。
①属于芳香族化合物;②苯环上含有两个取代基。
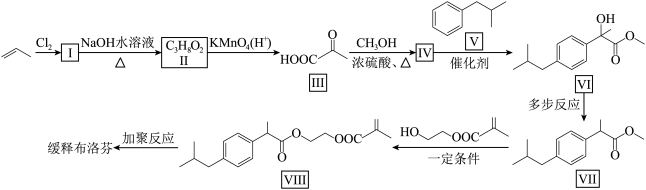
(1)化合物Ⅰ的分子式为
(2)化合物Ⅱ易溶于水的原因是
(3)根据化合物Ⅲ的结构特征,分析预测其可能的化学性质,完成下表。
| 序号 | 结构特征 | 可反应的试剂 | 反应形成的新结构 | 反应类型 |
| ① |
| 还原反应 | ||
| ② | Na | 取代反应 |
(4)写出Ⅲ→Ⅳ的化学方程式:
(5)同时满足下列条件的化合物Ⅴ的同分异构体共有
①属于芳香族化合物;②苯环上含有两个取代基。
您最近一年使用:0次
2024-05-07更新
|
1023次组卷
|
3卷引用:上海市华东师范大学第二附属中学(紫竹校区)2023-2024学年高三下学期三模考试 化学试题
上海市华东师范大学第二附属中学(紫竹校区)2023-2024学年高三下学期三模考试 化学试题广东省部分学校2024届高三百日冲刺联合学业质量监测(一模)化学试题(已下线)题型12 有机推断题(25题)-2024年高考化学常考点必杀300题(新高考通用)
6 .  时,将
时,将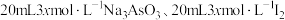 和
和 溶液混合,发生反应:
溶液混合,发生反应: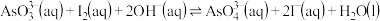 。溶液中
。溶液中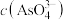 与反应时间(t)的关系如图所示。(忽略混合前后溶液体积的变化)
与反应时间(t)的关系如图所示。(忽略混合前后溶液体积的变化)
2.比较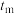 和
和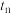 时的化学反应速率,其中
时的化学反应速率,其中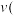 逆)较大的时刻为___________。
逆)较大的时刻为___________。
3.若平衡时溶液的 ,则该反应的平衡常数
,则该反应的平衡常数
___________ 。(用含 和
和 的代数式表示)
的代数式表示)
 时,将
时,将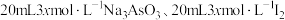 和
和 溶液混合,发生反应:
溶液混合,发生反应: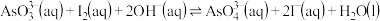 。溶液中
。溶液中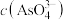 与反应时间(t)的关系如图所示。(忽略混合前后溶液体积的变化)
与反应时间(t)的关系如图所示。(忽略混合前后溶液体积的变化)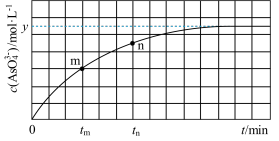
A.溶液的 不再变化 不再变化 | B.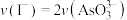 |
C.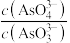 不再变化 不再变化 | D.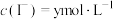 |
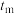 和
和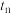 时的化学反应速率,其中
时的化学反应速率,其中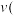 逆)较大的时刻为___________。
逆)较大的时刻为___________。A. | B.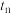 | C.两者相等 | D.无法比较 |
 ,则该反应的平衡常数
,则该反应的平衡常数
 和
和 的代数式表示)
的代数式表示)
您最近一年使用:0次
2024·上海·模拟预测
7 . 研究从含锌资源中获取Zn的途径具有重要意义。
Ⅰ.工业上酸浸提锌
氧化锌矿中含有ZnO、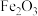 、FeO、PbO、
、FeO、PbO、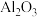 、CaO、
、CaO、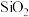 等。
等。
ⅰ.几种难溶电解质的
ⅱ.浸出液中主要金属正离子浓度
(1)浸出渣的主要成分有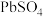 、
、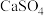 和
和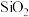 。PbO和
。PbO和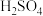 反应的离子方程式是
反应的离子方程式是___________ 。
(2)加入试剂a的目的是___________ 。
(3)电解前,含 溶液中铁和铝的离子浓度均需小于
溶液中铁和铝的离子浓度均需小于 ,应调节pH的范围是(忽略①和②导致的体积变化)___________。
,应调节pH的范围是(忽略①和②导致的体积变化)___________。
Ⅱ.实验室中氨浸提锌
ⅲ.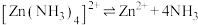
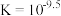
ⅳ.M的结构简式如图所示,R为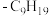 ,两个羟基中、酚羟基酸性较强。
,两个羟基中、酚羟基酸性较强。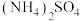 浸取ZnO发生反应的离子方程式是
浸取ZnO发生反应的离子方程式是___________ 。
(5)M能与 形成稳定的配合物X,相关反应为
形成稳定的配合物X,相关反应为 。
。
①补全图中X的结构并用“…”标出氢键___________ 。 的萃取,原因可能是
的萃取,原因可能是___________ 。
(6)从平衡移动的角度解释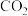 能提高有机溶液中X含量的原因:
能提高有机溶液中X含量的原因:___________ 。
Ⅰ.工业上酸浸提锌
氧化锌矿中含有ZnO、
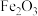 、FeO、PbO、
、FeO、PbO、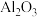 、CaO、
、CaO、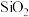 等。
等。
ⅰ.几种难溶电解质的

| 难溶电解质 |  |  | 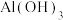 |  |
 | 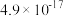 |  | 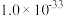 | 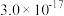 |
| 粒子 |  |  和Fe 和Fe | Al |
| 浓度(mol/L) | 0.3 | 0.1 | 0.1 |
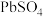 、
、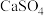 和
和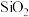 。PbO和
。PbO和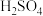 反应的离子方程式是
反应的离子方程式是(2)加入试剂a的目的是
(3)电解前,含
 溶液中铁和铝的离子浓度均需小于
溶液中铁和铝的离子浓度均需小于 ,应调节pH的范围是(忽略①和②导致的体积变化)___________。
,应调节pH的范围是(忽略①和②导致的体积变化)___________。| A.3.0~4.0 | B.4.0~5.0 | C.5.0~6.0 | D.6.0~7.0 |
Ⅱ.实验室中氨浸提锌
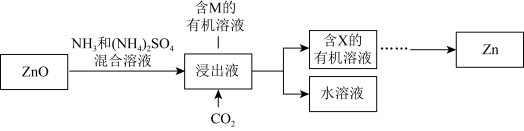
ⅲ.
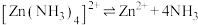
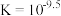
ⅳ.M的结构简式如图所示,R为
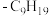 ,两个羟基中、酚羟基酸性较强。
,两个羟基中、酚羟基酸性较强。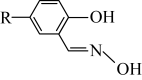
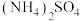 浸取ZnO发生反应的离子方程式是
浸取ZnO发生反应的离子方程式是(5)M能与
 形成稳定的配合物X,相关反应为
形成稳定的配合物X,相关反应为 。
。①补全图中X的结构并用“…”标出氢键

 的萃取,原因可能是
的萃取,原因可能是(6)从平衡移动的角度解释
 能提高有机溶液中X含量的原因:
能提高有机溶液中X含量的原因:
您最近一年使用:0次
8 . 黄铁矿(FeS2)在工业上有着重要的用途,黄铁矿在空气中煅烧的反应为:4FeS2+11O2 2Fe2O3+8SO2,生成的SO2可用于生产Na2SO3和H2SO4。FeS2立方晶胞如图,其晶胞边长为a nm。下列有关说法不正确的是
2Fe2O3+8SO2,生成的SO2可用于生产Na2SO3和H2SO4。FeS2立方晶胞如图,其晶胞边长为a nm。下列有关说法不正确的是
 2Fe2O3+8SO2,生成的SO2可用于生产Na2SO3和H2SO4。FeS2立方晶胞如图,其晶胞边长为a nm。下列有关说法不正确的是
2Fe2O3+8SO2,生成的SO2可用于生产Na2SO3和H2SO4。FeS2立方晶胞如图,其晶胞边长为a nm。下列有关说法不正确的是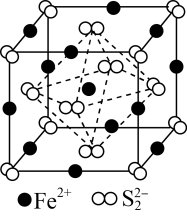
| A.FeS2中存在非极性共价键 |
B. 的空间构型为三角锥形 的空间构型为三角锥形 |
| C.SO2能使酸性高锰酸钾溶液褪色,说明SO2具有漂白性 |
D.晶胞中Fe2+位于S2-所形成的正八面体的体心,该正八面体的边长为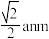 |
您最近一年使用:0次
2024·上海·模拟预测
解题方法
9 . 多丁纳德(化合物I)是一种治疗痛风的药物,以下为其合成路线之一(部分条件已略去)。___________ 。
(2)A→B的反应类型是___________。
(3)C的结构简式是___________ 。
(4)D→E的反应试剂和条件是___________ 。
(5)在D的同分异构体中,同时满足下列条件的结构简式是___________ 。
①含有苯环
②遇 溶液显紫色
溶液显紫色
③与 溶液反应放出
溶液反应放出
④核磁共振氢谱显示为五组峰,且峰面积比为2:2:2:1:1
(6)已知K的分子式为C7H7NS,F+K→G的方程式是___________ 。
(7)设计反应①和反应②的目的是___________ 。
(8)J→K的反应还可能生成高分子M,写出M的一种结构简式___________ 。

已知:
(2)A→B的反应类型是___________。
| A.加成反应 | B.取代反应 | C.消去反应 | D.氧化反应 |
(4)D→E的反应试剂和条件是
(5)在D的同分异构体中,同时满足下列条件的结构简式是
①含有苯环
②遇
 溶液显紫色
溶液显紫色③与
 溶液反应放出
溶液反应放出
④核磁共振氢谱显示为五组峰,且峰面积比为2:2:2:1:1
(6)已知K的分子式为C7H7NS,F+K→G的方程式是
(7)设计反应①和反应②的目的是
(8)J→K的反应还可能生成高分子M,写出M的一种结构简式
您最近一年使用:0次
名校
解题方法
10 . 将 通入
通入 溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体
溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体 ,则产生白色沉淀,制备气体
,则产生白色沉淀,制备气体 的试剂不能是
的试剂不能是
 通入
通入 溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体
溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体 ,则产生白色沉淀,制备气体
,则产生白色沉淀,制备气体 的试剂不能是
的试剂不能是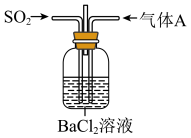
A. 和 和 | B.大理石和稀盐酸 |
C. 和浓硝酸 和浓硝酸 | D. 和浓盐酸 和浓盐酸 |
您最近一年使用:0次
2024-04-27更新
|
59次组卷
|
13卷引用:化学(上海A卷)-学易金卷:2023年高考第一次模拟考试卷
(已下线)化学(上海A卷)-学易金卷:2023年高考第一次模拟考试卷【区级联考】北京市西城区2018-2019学年高一第一学期期末考试化学试题【全国百强校】四川省成都外国语学校2018-2019学年高一下学期入学考试化学试题四川省威远中学2018-2019学年高一下学期期中考试化学试题河北安平中学2020届高三上学期第二次月考化学试题鲁科版(2019)高一必修第一册第三章B 素养拓展区 过综合 章末素养综合检测(已下线)小题必刷19 硫及其化合物——2021年高考化学一轮复习小题必刷(通用版)江西省上饶市铅山县第一中学2020-2021学年上学期高一联考(自招班)化学试题山西省阳泉市第一中学校2022-2023学年高一下学期期中考试化学试题(已下线)专题突破卷04?非金属及其化合物?-2024年高考化学一轮复习考点通关卷(新教材新高考) 天津市滨海新区田家炳中学2023-2024学年高三上学期第二次月考化学试题安徽省淮北市第一中学2023-2024学年高一下学期3月月考化学试题云南省大理白族自治州祥云祥华中学2023-2024学年高一下学期3月月考化学试题