1 . 某校化学兴趣小组同学猜想自来水中可能含有大量Cu2+、Ca2+、Mg2+和某些阴离子,从而进行了三组实验:
①取适量自来水于试管中,滴加足量的NaOH溶液,产生白色沉淀;
②过滤后取滤液于试管中,滴加足量的Na2CO3溶液,又有白色沉淀生成;
③另取适量自来水于试管中,滴加足量稀硝酸后再滴加AgNO3溶液,也产生白色沉淀。
请回答以下问题:
(1)不用做实验就可排除的离子是___________ 。
(2)通过实验可初步确定自来水中___________ (填“含有”或“不含有”)大量Ca2+、Mg2+;判断依据的离子方程式有___________ 。
(3)自来水中所含阴离子可以确定有___________ ,理由是___________ 。
(4)确定实验②中滴加的Na2CO3溶液已过量的检验方法是___________ 。
①取适量自来水于试管中,滴加足量的NaOH溶液,产生白色沉淀;
②过滤后取滤液于试管中,滴加足量的Na2CO3溶液,又有白色沉淀生成;
③另取适量自来水于试管中,滴加足量稀硝酸后再滴加AgNO3溶液,也产生白色沉淀。
请回答以下问题:
(1)不用做实验就可排除的离子是
(2)通过实验可初步确定自来水中
(3)自来水中所含阴离子可以确定有
(4)确定实验②中滴加的Na2CO3溶液已过量的检验方法是
您最近一年使用:0次
2023-10-08更新
|
166次组卷
|
19卷引用:天津市东丽区2020-2021学年高一上学期期末考试化学试题
天津市东丽区2020-2021学年高一上学期期末考试化学试题天津市西青区2019-2020学年高一上学期期末考试化学试题(已下线)专题3 从海水中获得的化学物质 综合评价-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)湖南师范大学附属中学2020-2021学年高一下学期期末考试化学试题天津市西青区杨柳青第一中学2021-2022学年高一下学期期末适应性测试化学试题云南省昆明市第十中学2021-2022学年高一上学期10月月考化学试题广东省梅州市兴宁市叶塘中学2021-2022学年高一上学期摸底考试化学试题第2章《元素与物质世界》期中复习检测试卷2019年10月16日《每日一题》2019-2020学年高一化学人教必修1——常见离子的检验辽宁省朝阳市柳城高中2019-2020学年高一上学期期中考试化学试题步步为赢 高一化学寒假作业:作业七 阶段检测(二)广东省揭阳市第三中学2020-2021学年高一上学期第一次阶段考化学试题(已下线)【浙江新东方】39贵州省贵阳市花溪第六中学2022-2023学年高一上学期期中考试化学试题安徽亳州市利辛县启明中学2022-2023学年高一上学期期末考试化学试题陕西省商洛市洛南中学2022-2023学年高一上学期12月月考化学试题甘肃省兰州市教育局第四片区联考2023-2024学年高一上学期期中考试化学试题新疆石河子第一中学2023-2024学年高一上学期9月月考化学试题(已下线)BBWYhjhx1001.pdf
名校
解题方法
2 . 完成下列问题。
(1)实验室用碳酸钙与盐酸反应制取 气体,反应的离子方程式为
气体,反应的离子方程式为___________ ,常用澄清石灰水检验 气体的离子方程式为
气体的离子方程式为___________ 。
(2)将表面附有铁锈(主要成分为 )的铁钉放入稀硫酸中一段时间,开始反应的离子方程式为
)的铁钉放入稀硫酸中一段时间,开始反应的离子方程式为___________ ;反应片刻后,可观察到有气体产生,其离子方程式为___________ 。
(3)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
①用小苏打片( )治疗胃酸过多的离子方程式为
)治疗胃酸过多的离子方程式为___________ 。
②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是 ],反应的离子方程式为
],反应的离子方程式为___________ 。
(1)实验室用碳酸钙与盐酸反应制取
 气体,反应的离子方程式为
气体,反应的离子方程式为 气体的离子方程式为
气体的离子方程式为(2)将表面附有铁锈(主要成分为
 )的铁钉放入稀硫酸中一段时间,开始反应的离子方程式为
)的铁钉放入稀硫酸中一段时间,开始反应的离子方程式为(3)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
①用小苏打片(
 )治疗胃酸过多的离子方程式为
)治疗胃酸过多的离子方程式为②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是
 ],反应的离子方程式为
],反应的离子方程式为
您最近一年使用:0次
2023-08-23更新
|
226次组卷
|
8卷引用:天津北京师范大学静海附属学校2021-2022学年高一上学期第一次调研测试化学试题
名校
3 . 已知烷烃A的密度是相同条件下H2密度的15倍。
(1)烷烃A的电子式为___________ 。
(2)烷烃A与丙烷C3H8互为___________ 。
a.同系物 b.同位素
c.同分异构体 d.同素异形体
(3)A与Cl2发生反应生成一氯代物的化学方程式为___________ 。
(4)A燃烧的化学方程式为___________ 。
(1)烷烃A的电子式为
(2)烷烃A与丙烷C3H8互为
a.同系物 b.同位素
c.同分异构体 d.同素异形体
(3)A与Cl2发生反应生成一氯代物的化学方程式为
(4)A燃烧的化学方程式为
您最近一年使用:0次
名校
解题方法
4 . 某化学研究性学习小组为了了解从工业溴中提纯溴的方法。查阅了有关资料知:Br2的沸点为59℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如图装置简图:
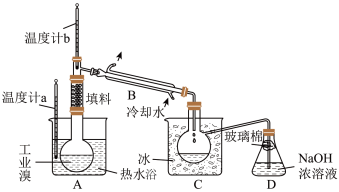
(1)图中仪器B的名称是_______ 。
(2)整套实验装置中仪器连接均不能用橡胶塞和橡胶管。其原因是_______ 。

(1)图中仪器B的名称是
(2)整套实验装置中仪器连接均不能用橡胶塞和橡胶管。其原因是
您最近一年使用:0次
5 . 写出下列正确的化学方程式
(1)乙烯制聚乙烯:_______ ;
(2)乙醇与钠:_______ ;
(3)乙醇的燃烧:_______ ;
(4)乙烯与水:_______ ;
(5)淀粉水解:_______ ;
(6)冶炼金属镁:_______ ;
(7)冶炼金属铝:_______ ;
(8)铝热法炼铁:_______ 。
(1)乙烯制聚乙烯:
(2)乙醇与钠:
(3)乙醇的燃烧:
(4)乙烯与水:
(5)淀粉水解:
(6)冶炼金属镁:
(7)冶炼金属铝:
(8)铝热法炼铁:
您最近一年使用:0次
6 . 利用电化学原理,将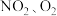 和熔融
和熔融 制成燃料电池,模拟工业电解法来处理含
制成燃料电池,模拟工业电解法来处理含 的废水,如图所示;电解过程中溶液发生反应:
的废水,如图所示;电解过程中溶液发生反应: 。
。
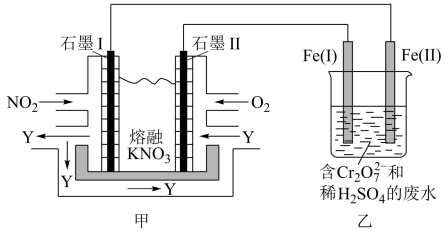
(1)甲池工作时, 转变成绿色硝化剂Y,Y是
转变成绿色硝化剂Y,Y是 ,可循环使用。则石墨II是电池的
,可循环使用。则石墨II是电池的_______ (填“正”或“负”)极;石墨I附近发生的电极反应式为_______ 。
(2)工作时,甲池内的 向
向_______ (填“石墨I”或“石墨II”)极移动;在相同条件下,消耗的 和
和 的体积比为
的体积比为_______ 。
(3)乙池中 (I)棒上发生的电极反应为
(I)棒上发生的电极反应为_______ 。
(4)若溶液中减少了 ,则电路中至少转移了
,则电路中至少转移了_______  电子。
电子。
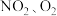 和熔融
和熔融 制成燃料电池,模拟工业电解法来处理含
制成燃料电池,模拟工业电解法来处理含 的废水,如图所示;电解过程中溶液发生反应:
的废水,如图所示;电解过程中溶液发生反应: 。
。
(1)甲池工作时,
 转变成绿色硝化剂Y,Y是
转变成绿色硝化剂Y,Y是 ,可循环使用。则石墨II是电池的
,可循环使用。则石墨II是电池的(2)工作时,甲池内的
 向
向 和
和 的体积比为
的体积比为(3)乙池中
 (I)棒上发生的电极反应为
(I)棒上发生的电极反应为(4)若溶液中减少了
 ,则电路中至少转移了
,则电路中至少转移了 电子。
电子。
您最近一年使用:0次
2023-02-14更新
|
203次组卷
|
7卷引用:天津市静海区第一中学2021-2022学年高三上学期12月调研考试化学试题
天津市静海区第一中学2021-2022学年高三上学期12月调研考试化学试题(已下线)第19讲 电解池 金属的电化学腐蚀与防护(精练)-2022年高考化学一轮复习讲练测福建省南安第一中学2017-2018学年高二上学期期中考试化学试题山东师范大学附属中学2021届高三上学期期中考试(11月)化学试题(已下线)第六章 化学反应与能量 第38练 电解原理的综合应用(已下线)热点题型训练 电化学串联装置的两大模型(已下线)电化学原理及应用
名校
解题方法
7 . Ⅰ.现有下列十种物质:①液态氯化氢;②小苏打;③固体纯碱;④二氧化碳;⑤葡萄糖;⑥氯化镁;⑦ ;⑧氨水;⑨
;⑧氨水;⑨ ;⑩硫酸铁溶液。
;⑩硫酸铁溶液。
(1)上述十种物质中,属于电解质的有___________ ,属于非电解质的有___________ 。
(2)④的电子式为___________ 。
(3)用电子式表示⑥的形成过程___________ 。
(4)除去③中少量②的操作是___________ ,化学方程式为___________ 。
(5)⑦中含有的化学键为___________ 。
(6)⑨在水溶液中的电离方程式为___________ 。
Ⅱ.写出下列反应的离子方程式(已知还原性: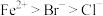 ):
):
(7)向 溶液中通入少量
溶液中通入少量 (
( 与
与 的微粒数的比值
的微粒数的比值 )
)___________ ;
(8)向 溶液中通入
溶液中通入 ,
, 与
与 的化学计量数之比为1∶l∶
的化学计量数之比为1∶l∶___________ 。
 ;⑧氨水;⑨
;⑧氨水;⑨ ;⑩硫酸铁溶液。
;⑩硫酸铁溶液。(1)上述十种物质中,属于电解质的有
(2)④的电子式为
(3)用电子式表示⑥的形成过程
(4)除去③中少量②的操作是
(5)⑦中含有的化学键为
(6)⑨在水溶液中的电离方程式为
Ⅱ.写出下列反应的离子方程式(已知还原性:
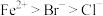 ):
):(7)向
 溶液中通入少量
溶液中通入少量 (
( 与
与 的微粒数的比值
的微粒数的比值 )
)(8)向
 溶液中通入
溶液中通入 ,
, 与
与 的化学计量数之比为1∶l∶
的化学计量数之比为1∶l∶
您最近一年使用:0次
解题方法
8 . 如图装置所示,是用氢氧燃料电池B进行的某电解实验:

(1)若电池B使用了亚氨基锂(Li2NH)固体作为储氢材料,其储氢原理是:Li2NH+H2=LiNH2+LiH,则下列说法中正确的是_____ 。
(2)在电池B工作时:
①若用固体Ca(HSO4)2为电解质传递H+,则电子由_____ 极流出,H+向_____ 极移动。(填“a”或“b”)
②b极上的电极反应式为:____ 。
③外电路中,每转移0.1mol电子,在a极消耗____ L的H2(标准状况下)。
(3)若A中X、Y都是惰性电极,电解液W是滴有酚酞的饱和NaCl溶液,则B工作时:
①电解池中X极上的电极反应式是____ ,在X极这边观察到的现象是_____ 。
②检验Y电极上反应产物的方法是____ 。
③若A中其它均不改变,只将电极Y换成铁棒,可实现的实验目的是_____ 。

(1)若电池B使用了亚氨基锂(Li2NH)固体作为储氢材料,其储氢原理是:Li2NH+H2=LiNH2+LiH,则下列说法中正确的是
| A.Li2NH中N的化合价是-1 |
| B.该反应中H2既是氧化剂又是还原剂 |
| C.Li+和H+的离子半径相等 |
| D.此法储氢和钢瓶储氢的原理相同 |
①若用固体Ca(HSO4)2为电解质传递H+,则电子由
②b极上的电极反应式为:
③外电路中,每转移0.1mol电子,在a极消耗
(3)若A中X、Y都是惰性电极,电解液W是滴有酚酞的饱和NaCl溶液,则B工作时:
①电解池中X极上的电极反应式是
②检验Y电极上反应产物的方法是
③若A中其它均不改变,只将电极Y换成铁棒,可实现的实验目的是
您最近一年使用:0次
解题方法
9 . 电解质溶液中存在着多种平衡,请回答下列问题:
(1)常温下,相同pH的氢氧化钠和醋酸钠溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。
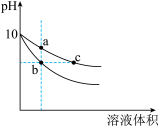
①b、c两点溶液的导电能力比较:b_______ c(填“<”“>”或“=”)
②a、b、c三点溶液中水的电离程度由大到小的顺序:_______ 。
(2)AgCl能溶于氨水,发生反应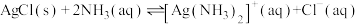 ,其平衡常数
,其平衡常数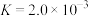 ,现用1L某浓度氨水(溶质视为NH3)完全溶解0.1molAgCl,所需氨水浓度至少为
,现用1L某浓度氨水(溶质视为NH3)完全溶解0.1molAgCl,所需氨水浓度至少为_______ mol/L(已知 =2.24)。
=2.24)。
(3)25℃时,有如下两个反应:
①CH3COOH+NaCN=CH3COONa+HCN
②HNO2+CH3COONa=NaNO2+CH3COOH
该温度下CH3COOH、HCN和HNO2三种弱酸的电离常数由大到小的顺序是:_______ 。
(4)25℃时,0.1mol/L的CH3COOH溶液加适量水稀释的过程中,下列表达式的数值保持不变的是_______ 。
a.c(H+) b.c(H+)•c(OH-) c. d.
d.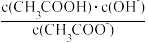
(5)已知铷(Rb)是制造光电管的材料,它与锂同主族。常温下,将amolCH3COORb固体溶于水配成溶液,向该溶液中滴加bLcmol/L醋酸溶液后,溶液呈中性,则c=_______ (用含a、b的式子表示;已知常温下,CH3COOH电离平衡常数Ka=1.75×10-5)。
(1)常温下,相同pH的氢氧化钠和醋酸钠溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。

①b、c两点溶液的导电能力比较:b
②a、b、c三点溶液中水的电离程度由大到小的顺序:
(2)AgCl能溶于氨水,发生反应
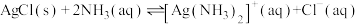 ,其平衡常数
,其平衡常数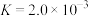 ,现用1L某浓度氨水(溶质视为NH3)完全溶解0.1molAgCl,所需氨水浓度至少为
,现用1L某浓度氨水(溶质视为NH3)完全溶解0.1molAgCl,所需氨水浓度至少为 =2.24)。
=2.24)。(3)25℃时,有如下两个反应:
①CH3COOH+NaCN=CH3COONa+HCN
②HNO2+CH3COONa=NaNO2+CH3COOH
该温度下CH3COOH、HCN和HNO2三种弱酸的电离常数由大到小的顺序是:
(4)25℃时,0.1mol/L的CH3COOH溶液加适量水稀释的过程中,下列表达式的数值保持不变的是
a.c(H+) b.c(H+)•c(OH-) c.
 d.
d.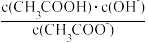
(5)已知铷(Rb)是制造光电管的材料,它与锂同主族。常温下,将amolCH3COORb固体溶于水配成溶液,向该溶液中滴加bLcmol/L醋酸溶液后,溶液呈中性,则c=
您最近一年使用:0次
10 . 请回答下列问题。
(1)25 ℃时,浓度为0.1 mol·L-1的6种溶液:①HCl;②CH3COOH;③Ba(OH)2;④Na2CO3;⑤KCl;⑥NH4Cl。溶液pH由小到大的顺序为_________ (填编号)。
(2)25 ℃时,醋酸的电离常数Ka=1.7×10-5,则该温度下CH3COONa的水解平衡常数Kh=_________ (保留到小数点后一位)。
(3)25 ℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈_________ (填“酸性”“中性”或“碱性”),请写出溶液中离子浓度间的一个等式:_________ 。
(4)25 ℃时,醋酸的电离常数Ka=1.7×10-5,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3·H2O的电离常数Kb=_________ 。
(1)25 ℃时,浓度为0.1 mol·L-1的6种溶液:①HCl;②CH3COOH;③Ba(OH)2;④Na2CO3;⑤KCl;⑥NH4Cl。溶液pH由小到大的顺序为
(2)25 ℃时,醋酸的电离常数Ka=1.7×10-5,则该温度下CH3COONa的水解平衡常数Kh=
(3)25 ℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈
(4)25 ℃时,醋酸的电离常数Ka=1.7×10-5,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3·H2O的电离常数Kb=
您最近一年使用:0次
2022-12-02更新
|
88次组卷
|
2卷引用:天津市实验中学滨海学校黄南民族班2021-2022学年高二上学期期中质量监测化学试题



