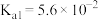1 . 水合肼 常用于生产火箭燃料,其沸点是
常用于生产火箭燃料,其沸点是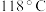 ,受热易分解。尿素法合成水合肼的基本流程如图所示。
,受热易分解。尿素法合成水合肼的基本流程如图所示。

回答下列问题:
(1) 是二元弱碱,在水中的电离方式与氨相似,写出
是二元弱碱,在水中的电离方式与氨相似,写出 第二步电离的方程式:
第二步电离的方程式:___________ 。
(2)已知次氯酸钠与盐酸混合能够生成 ,说明氧化性
,说明氧化性
___________  (填“>”或“<”)。实验发现,
(填“>”或“<”)。实验发现, 与烧碱溶液反应可以生成
与烧碱溶液反应可以生成 ,说明
,说明 与
与 的氧化性强弱关系与
的氧化性强弱关系与___________ 有关。
(3) 强碱性溶液与尿素
强碱性溶液与尿素 水溶液加热制备水合肼的离子方程式为
水溶液加热制备水合肼的离子方程式为___________ 。
(4)常通过减压蒸馏从反应后的混合溶液中获得水合肼,采用该操作的原因是___________ 。
(5)水合肼与硫酸反应生成的盐是农业上重要的杀虫剂、灭菌剂,写出水合肼与硫酸反应生成的碱式盐的化学式:___________ 。
(6)电化学方法制备 的装置如图所示。其中双极膜是阴、阳复合膜,层间的
的装置如图所示。其中双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。

①双极膜中产生的___________ (填“ ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。
②若电路中转移2mol电子,理论上负极区溶液增重___________ g。
 常用于生产火箭燃料,其沸点是
常用于生产火箭燃料,其沸点是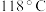 ,受热易分解。尿素法合成水合肼的基本流程如图所示。
,受热易分解。尿素法合成水合肼的基本流程如图所示。
回答下列问题:
(1)
 是二元弱碱,在水中的电离方式与氨相似,写出
是二元弱碱,在水中的电离方式与氨相似,写出 第二步电离的方程式:
第二步电离的方程式:(2)已知次氯酸钠与盐酸混合能够生成
 ,说明氧化性
,说明氧化性
 (填“>”或“<”)。实验发现,
(填“>”或“<”)。实验发现, 与烧碱溶液反应可以生成
与烧碱溶液反应可以生成 ,说明
,说明 与
与 的氧化性强弱关系与
的氧化性强弱关系与(3)
 强碱性溶液与尿素
强碱性溶液与尿素 水溶液加热制备水合肼的离子方程式为
水溶液加热制备水合肼的离子方程式为(4)常通过减压蒸馏从反应后的混合溶液中获得水合肼,采用该操作的原因是
(5)水合肼与硫酸反应生成的盐是农业上重要的杀虫剂、灭菌剂,写出水合肼与硫酸反应生成的碱式盐的化学式:
(6)电化学方法制备
 的装置如图所示。其中双极膜是阴、阳复合膜,层间的
的装置如图所示。其中双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。
①双极膜中产生的
 ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。②若电路中转移2mol电子,理论上负极区溶液增重
您最近一年使用:0次
2 . 短周期元素在自然界中比较常见,它们的化合物及其合金在社会生活中有着很重要的作用。请回答下列问题:
(1)硫代硫酸盐可用作浸金试剂。硫代硫酸根( )可看作是
)可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。
①基态O原子的核外电子中,两种自旋状态的电子数之比为________ 。 的空间结构是
的空间结构是________ 。
②浸金时, 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成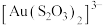 。分别判断
。分别判断 中的中心S原子和端基S原子能否做配位原子并说明理由:
中的中心S原子和端基S原子能否做配位原子并说明理由:_______ 。
(2)一定条件下,将F插入石墨层间可得到具有润滑性的层状结构化合物 ,其单层局部结构如图所示:
,其单层局部结构如图所示: 中C原子的杂化方式为
中C原子的杂化方式为________ ,与石墨相比, 的导电性将
的导电性将________ ,原因是________ 。

(3)①呋喃(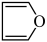 )和吡咯(
)和吡咯(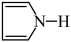 )均是重要化工原料,请解释呋喃沸点低于吡咯沸点的原因
)均是重要化工原料,请解释呋喃沸点低于吡咯沸点的原因_____ 。
②卤代乙酸可增强乙酸的酸性,则酸性:三氯乙酸( )
)___ 三氟乙酸( )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。
(4)Mg-Fe合金是当前储氢密度最高的储氢材料之一,其晶胞结构如图所示。
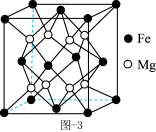
①距离Fe原子最近的Mg原子个数是_______ 。
②若该晶胞的棱长为a pm,阿伏加德罗常数的值为 ,则该合金的密度为
,则该合金的密度为______  。
。
(1)硫代硫酸盐可用作浸金试剂。硫代硫酸根(
 )可看作是
)可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。①基态O原子的核外电子中,两种自旋状态的电子数之比为
 的空间结构是
的空间结构是②浸金时,
 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成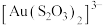 。分别判断
。分别判断 中的中心S原子和端基S原子能否做配位原子并说明理由:
中的中心S原子和端基S原子能否做配位原子并说明理由:(2)一定条件下,将F插入石墨层间可得到具有润滑性的层状结构化合物
 ,其单层局部结构如图所示:
,其单层局部结构如图所示: 中C原子的杂化方式为
中C原子的杂化方式为 的导电性将
的导电性将
(3)①呋喃(
 )和吡咯(
)和吡咯( )均是重要化工原料,请解释呋喃沸点低于吡咯沸点的原因
)均是重要化工原料,请解释呋喃沸点低于吡咯沸点的原因②卤代乙酸可增强乙酸的酸性,则酸性:三氯乙酸(
 )
) )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。(4)Mg-Fe合金是当前储氢密度最高的储氢材料之一,其晶胞结构如图所示。

①距离Fe原子最近的Mg原子个数是
②若该晶胞的棱长为a pm,阿伏加德罗常数的值为
 ,则该合金的密度为
,则该合金的密度为 。
。
您最近一年使用:0次
名校
3 . Ⅰ.某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系________ (填“属于”或“不属于”)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断待测试样为_____ (填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=______ mol·L-1。
Ⅱ.氧化还原反应在工农业生产、日常生活中具有广泛用途,贯穿古今。
(3)“维生素C可以将食物中的Fe3+转化为Fe2+,说明维生素C______ 具有(填“氧化性”或“还原性”)。
(4)二氧化氯是一种高效消毒剂。工业上制备ClO2的反应为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①该反应中每生成1molClO2分子,转移电子的数目为_____ 。
②ClO2在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为Cl-除去,下列试剂能实现其转化过程的是
),需要将其转化为Cl-除去,下列试剂能实现其转化过程的是_____ 。
A.O2 B.FeCl2 C.KCl D.KMnO4
(1)PM2.5分散在空气中形成的分散系
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ |  |  |  | Cl- |
| 浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
Ⅱ.氧化还原反应在工农业生产、日常生活中具有广泛用途,贯穿古今。
(3)“维生素C可以将食物中的Fe3+转化为Fe2+,说明维生素C
(4)二氧化氯是一种高效消毒剂。工业上制备ClO2的反应为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①该反应中每生成1molClO2分子,转移电子的数目为
②ClO2在杀菌消毒的过程中会生成副产物亚氯酸盐(
 ),需要将其转化为Cl-除去,下列试剂能实现其转化过程的是
),需要将其转化为Cl-除去,下列试剂能实现其转化过程的是A.O2 B.FeCl2 C.KCl D.KMnO4
您最近一年使用:0次
2024-02-14更新
|
66次组卷
|
2卷引用:河南省漯河市高级中学2023-2024学年高一上学期模拟预测化学试题
解题方法
4 . 含铁化合物在生产、生活中有广泛的应用。下图是一种太阳能电池工作原理的示意图,其中电解质溶液为 和
和 的混合溶液。
的混合溶液。 中,中心离子为
中,中心离子为___________ 。
(2)电池工作时,下列描述正确的是___________。
(3)正极上发生的电极反应为___________ 。
氮化铁晶体可应用于磁记录材料领域,其晶胞结构如下图所示:
(5)该氮化铁晶体的化学式为___________ 。
A.FeN B.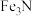 C.
C. D.
D.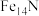
结合图中数据,计算该晶胞的密度
___________  。(设
。(设 为阿伏加德罗常数,用含r和
为阿伏加德罗常数,用含r和 的代数式表示,
的代数式表示, )
)
向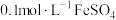 溶液中持续通入
溶液中持续通入 至饱和,有微量黑色的FeS沉淀生成,该溶液中
至饱和,有微量黑色的FeS沉淀生成,该溶液中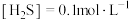 。(忽略
。(忽略 浓度的变化和溶液体积的变化)
浓度的变化和溶液体积的变化)
已知常温下,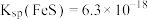 ,
, 的电离常数分别为:
的电离常数分别为: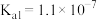 、
、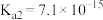 。
。
(6)写出生成黑色沉淀的离子方程式___________ 。溶液中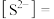
___________  ;溶液中
;溶液中
___________  。
。
 和
和 的混合溶液。
的混合溶液。
 中,中心离子为
中,中心离子为(2)电池工作时,下列描述正确的是___________。
| A.电极a为正极 | B. 向电极a移动 向电极a移动 |
| C.电子由电极a经导线流向电极b | D.电极b上发生氧化反应 |
(3)正极上发生的电极反应为
氮化铁晶体可应用于磁记录材料领域,其晶胞结构如下图所示:

| A.2 | B.4 | C.6 | D.8 |
(5)该氮化铁晶体的化学式为
A.FeN B.
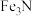 C.
C. D.
D.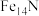
结合图中数据,计算该晶胞的密度

 。(设
。(设 为阿伏加德罗常数,用含r和
为阿伏加德罗常数,用含r和 的代数式表示,
的代数式表示, )
)向
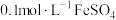 溶液中持续通入
溶液中持续通入 至饱和,有微量黑色的FeS沉淀生成,该溶液中
至饱和,有微量黑色的FeS沉淀生成,该溶液中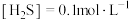 。(忽略
。(忽略 浓度的变化和溶液体积的变化)
浓度的变化和溶液体积的变化)已知常温下,
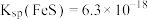 ,
, 的电离常数分别为:
的电离常数分别为: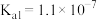 、
、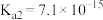 。
。(6)写出生成黑色沉淀的离子方程式
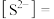
 ;溶液中
;溶液中
 。
。
您最近一年使用:0次
2024-01-13更新
|
258次组卷
|
2卷引用:上海市四区联考2023-2024学年高三上学期化学一模试卷
名校
5 . 工业排放的某些烟气中含有二氧化硫等大气污染物,对其进行脱硫治理不仅可以防止有害物质排放,还可以生产其他有用的产品。
(1) 分子的空间结构和分子的极性分别为___________。
分子的空间结构和分子的极性分别为___________。
(2)第一电离能: ,结合核外电子排布相关知识,说明其原因
,结合核外电子排布相关知识,说明其原因___________ 。
沿海地区的某煤电厂开发出海水脱硫的新工艺,流程如下图所示: ,
, 的电离常数如下表所示:
的电离常数如下表所示:
(3)在吸收塔内,烟气应从吸收塔的___________ 通入,与塔顶喷淋的海水充分接触。
A.上部 B.中部 C.下部
(4)吸收塔内温度不宜过高,原因可能是___________ 。(列举1条)吸收塔内 和海水中
和海水中 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(5)若煤电厂排放烟气量为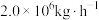 ,其中含
,其中含 为0.15%,该烟气经海水脱硫处理后
为0.15%,该烟气经海水脱硫处理后 为
为 ,则脱硫率
,则脱硫率
___________ 。( )
)
(6)离子液体(ILs)也可以用来处理工业烟气。ILs的负离子吸收 后生成
后生成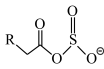 。欲确定
。欲确定 中虚线框内基团的结构,可采用的分析方法有___________。
中虚线框内基团的结构,可采用的分析方法有___________。
工业上还可用 溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。
溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。
(7)为使 再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。
再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。
(8)使用 溶液脱硫时,溶液的pH通常需控制在
溶液脱硫时,溶液的pH通常需控制在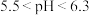 。结合
。结合 的性质和下图,分析pH不宜过小和过大的原因
的性质和下图,分析pH不宜过小和过大的原因___________ 。
(1)
 分子的空间结构和分子的极性分别为___________。
分子的空间结构和分子的极性分别为___________。| A.直线形,非极性 | B.直线形,极性 | C.角形,非极性 | D.角形,极性 |
(2)第一电离能:
 ,结合核外电子排布相关知识,说明其原因
,结合核外电子排布相关知识,说明其原因沿海地区的某煤电厂开发出海水脱硫的新工艺,流程如下图所示:
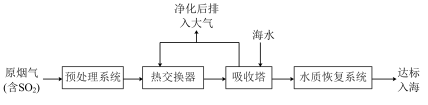
 ,
, 的电离常数如下表所示:
的电离常数如下表所示:| 弱酸 |  |  |
 | 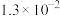 | 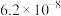 |
 | 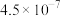 | 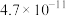 |
(3)在吸收塔内,烟气应从吸收塔的
A.上部 B.中部 C.下部
(4)吸收塔内温度不宜过高,原因可能是
 和海水中
和海水中 发生反应的离子方程式为
发生反应的离子方程式为(5)若煤电厂排放烟气量为
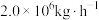 ,其中含
,其中含 为0.15%,该烟气经海水脱硫处理后
为0.15%,该烟气经海水脱硫处理后 为
为 ,则脱硫率
,则脱硫率
 )
)(6)离子液体(ILs)也可以用来处理工业烟气。ILs的负离子吸收
 后生成
后生成 。欲确定
。欲确定 中虚线框内基团的结构,可采用的分析方法有___________。
中虚线框内基团的结构,可采用的分析方法有___________。| A.原子发射光谱 | B.红外光谱 | C.核磁共振氢谱 | D.晶体X射线衍射 |
工业上还可用
 溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。
溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。(7)为使
 再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。
再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。A. | B.CaO | C. | D.NaOH |
(8)使用
 溶液脱硫时,溶液的pH通常需控制在
溶液脱硫时,溶液的pH通常需控制在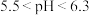 。结合
。结合 的性质和下图,分析pH不宜过小和过大的原因
的性质和下图,分析pH不宜过小和过大的原因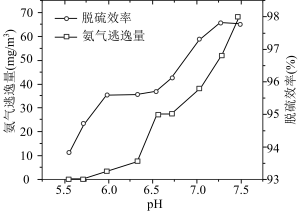
您最近一年使用:0次
2024-01-13更新
|
302次组卷
|
3卷引用:上海市四区联考2023-2024学年高三上学期化学一模试卷
6 . Ⅰ.某化学兴趣小组的同学学了金属的电化学腐蚀,对教材叙述[钢铁在酸性环境中发生析氢腐蚀;在酸性很弱或呈中性,溶有 的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
(1)用图1所示装置进行实验:打开a________ (填仪器名称)的活塞,加入1mL溶液,测得压强随时间变化曲线如图2。
(2)同学乙认为甲的结论不科学,锥形瓶内压强变大还可能是___________ ,提出改进措施___________ 。改进后,再次实验,证明甲、乙的猜想均正确,请在图2绘制出改进后的曲线___________ 。
(3)同学丙认为甲、乙的实验不具代表性,建议用不同浓度的酸进行实验。在改进后的装置中分别用 、
、 的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是
的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是___________ 。
(4)对于图3中 时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中
时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中 浓度随时间的变化曲线如图4。
浓度随时间的变化曲线如图4。 时,压强几乎不随时间改变是因为
时,压强几乎不随时间改变是因为___________ 。
综上,小组同学得出结论:教材表述科学严谨。
Ⅱ.拓展研究:
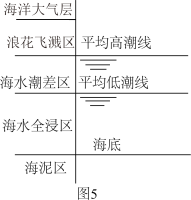
(5)侯保荣院士专门研究海洋钢架结构桥海洋大气层梁腐蚀,他发现腐蚀最严重的是浪花飞溅区浪花飞溅区(海洋环境分区如图5),请你解释原因___________ 。 浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的
浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的 完全转化为FeS,请写出该铁合金腐蚀的总反应
完全转化为FeS,请写出该铁合金腐蚀的总反应___________ (离子方程式)。___________ (任写一点即可)。
 的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。(1)用图1所示装置进行实验:打开a
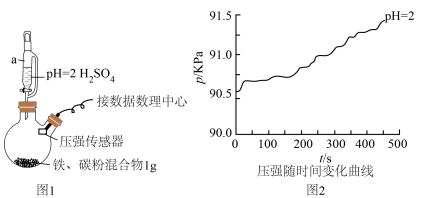
(2)同学乙认为甲的结论不科学,锥形瓶内压强变大还可能是
(3)同学丙认为甲、乙的实验不具代表性,建议用不同浓度的酸进行实验。在改进后的装置中分别用
 、
、 的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是
的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是(4)对于图3中
 时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中
时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中 浓度随时间的变化曲线如图4。
浓度随时间的变化曲线如图4。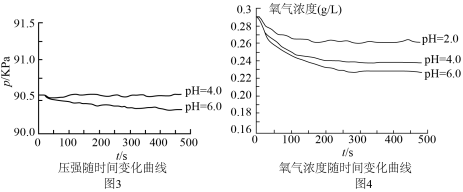
 时,压强几乎不随时间改变是因为
时,压强几乎不随时间改变是因为综上,小组同学得出结论:教材表述科学严谨。
Ⅱ.拓展研究:
(5)侯保荣院士专门研究海洋钢架结构桥海洋大气层梁腐蚀,他发现腐蚀最严重的是浪花飞溅区浪花飞溅区(海洋环境分区如图5),请你解释原因
 浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的
浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的 完全转化为FeS,请写出该铁合金腐蚀的总反应
完全转化为FeS,请写出该铁合金腐蚀的总反应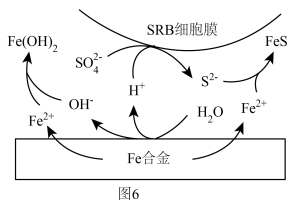
您最近一年使用:0次
2024-01-05更新
|
962次组卷
|
3卷引用:2024届广东东莞中学、广州二中、惠州一中、深圳实验、珠海一中、中山纪念中学六校高三上学期第三次联考化学
7 . 铅及其化合物用途多样。查资料得知 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:
(1)铅是碳的同族元索,铅原子基态价电子排布式为___________ ,常见价态为_____ 和_____ 。
(2) 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为___________ 。
(3) 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为___________ ; 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为___________ 。
(4) 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即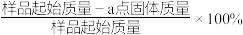 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为___________ 。 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:
①
②
上述过程中 的作用是
的作用是___________ ,请设计实验方案证明 的作用
的作用___________ 。
 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:(1)铅是碳的同族元索,铅原子基态价电子排布式为
(2)
 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为(3)
 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为(4)
 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即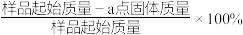 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为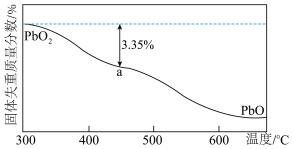
 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:①

②

上述过程中
 的作用是
的作用是 的作用
的作用
您最近一年使用:0次
名校
解题方法
8 . 绿色甲醇 是2023年杭州亚运会主火炬燃料,制备绿色甲醇分为三个阶段:利用可再生能源制绿氢、
是2023年杭州亚运会主火炬燃料,制备绿色甲醇分为三个阶段:利用可再生能源制绿氢、 的捕集、
的捕集、 和
和 一步法制甲醇。
一步法制甲醇。
(1)磁场辅助光电分解水制氢的工作原理如下[磁场辅助光照电极材料促使单位时间内产生更多的“电子”和“空穴”( ,具有强氧化性),驱动并加快电极反应]。
,具有强氧化性),驱动并加快电极反应]。
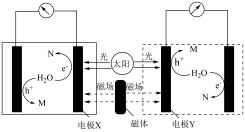
①电极X为______ (填“阴”或“阳”)极。
②理论上生成的气体M与N的质量之比为______ 。
③在酸性介质中生成M的电极反应式为______ 。
(2)工业上从高炉气中捕集 的示意图如图所示。
的示意图如图所示。
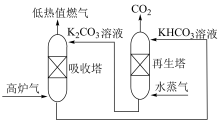
①高炉气从“吸收塔”底部通入, 溶液从塔顶喷洒,这样做的优点是
溶液从塔顶喷洒,这样做的优点是____________ 。
②若从“吸收塔”出来的盐溶液中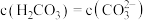 ,则该溶液的pH为
,则该溶液的pH为______
[该条件下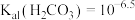 、
、 ,不考虑其他因素对pH的影响]。
,不考虑其他因素对pH的影响]。
③为研究温度对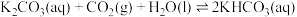 的影响,将一定量的
的影响,将一定量的 溶液置于密闭容器中,并充入一定量的
溶液置于密闭容器中,并充入一定量的 气体,保持其他初始实验条件不变,分别在不同温度下,经过相同时间测得
气体,保持其他初始实验条件不变,分别在不同温度下,经过相同时间测得 气体的浓度如图所示:
气体的浓度如图所示:
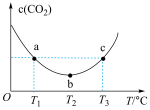
化学平衡常数
______ 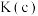 (填“>”“<”或“=”);
(填“>”“<”或“=”); 温度范围内,容器内
温度范围内,容器内 气体浓度呈减小的趋势,其原因是
气体浓度呈减小的趋势,其原因是______ 。
 是2023年杭州亚运会主火炬燃料,制备绿色甲醇分为三个阶段:利用可再生能源制绿氢、
是2023年杭州亚运会主火炬燃料,制备绿色甲醇分为三个阶段:利用可再生能源制绿氢、 的捕集、
的捕集、 和
和 一步法制甲醇。
一步法制甲醇。(1)磁场辅助光电分解水制氢的工作原理如下[磁场辅助光照电极材料促使单位时间内产生更多的“电子”和“空穴”(
 ,具有强氧化性),驱动并加快电极反应]。
,具有强氧化性),驱动并加快电极反应]。
①电极X为
②理论上生成的气体M与N的质量之比为
③在酸性介质中生成M的电极反应式为
(2)工业上从高炉气中捕集
 的示意图如图所示。
的示意图如图所示。
①高炉气从“吸收塔”底部通入,
 溶液从塔顶喷洒,这样做的优点是
溶液从塔顶喷洒,这样做的优点是②若从“吸收塔”出来的盐溶液中
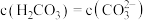 ,则该溶液的pH为
,则该溶液的pH为[该条件下
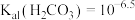 、
、 ,不考虑其他因素对pH的影响]。
,不考虑其他因素对pH的影响]。③为研究温度对
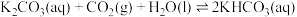 的影响,将一定量的
的影响,将一定量的 溶液置于密闭容器中,并充入一定量的
溶液置于密闭容器中,并充入一定量的 气体,保持其他初始实验条件不变,分别在不同温度下,经过相同时间测得
气体,保持其他初始实验条件不变,分别在不同温度下,经过相同时间测得 气体的浓度如图所示:
气体的浓度如图所示:
化学平衡常数

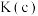 (填“>”“<”或“=”);
(填“>”“<”或“=”); 温度范围内,容器内
温度范围内,容器内 气体浓度呈减小的趋势,其原因是
气体浓度呈减小的趋势,其原因是
您最近一年使用:0次
2023-12-13更新
|
315次组卷
|
3卷引用:河南省部分学校2023-2024学年高三上学期12月大联考模拟预测化学试题
名校
9 . 已知 部分弱电解质的电离平衡常数如下表:
部分弱电解质的电离平衡常数如下表:
(1)过量 与
与 反应的离子方程式为
反应的离子方程式为__________________ .
(2)浓度均为 的①
的① 溶液 ②
溶液 ②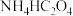 溶液 ③
溶液 ③ 溶液 ④氨水 ⑤
溶液 ④氨水 ⑤ 溶液 ⑥
溶液 ⑥ 溶液中
溶液中 由大到小的顺序为
由大到小的顺序为_________ (填序号)。
(3) 的
的 溶液中
溶液中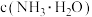
_________ 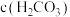 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)由 滴定
滴定 溶液过程中得
溶液过程中得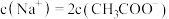 的溶液的溶质为
的溶液的溶质为_________ (填化学式)
(5)浓度均为 的
的 和
和 混合溶液中除
混合溶液中除 外的其他离子浓度的等量关系为
外的其他离子浓度的等量关系为_________ .
(6)已知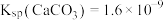 ,则
,则 饱和溶液中的最多的含碳微粒是
饱和溶液中的最多的含碳微粒是_________ (填微粒符号)。
 部分弱电解质的电离平衡常数如下表:
部分弱电解质的电离平衡常数如下表: |  |  |  | ||
|  | 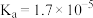 | 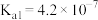 |  | 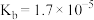 |
 与
与 反应的离子方程式为
反应的离子方程式为(2)浓度均为
 的①
的① 溶液 ②
溶液 ②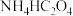 溶液 ③
溶液 ③ 溶液 ④氨水 ⑤
溶液 ④氨水 ⑤ 溶液 ⑥
溶液 ⑥ 溶液中
溶液中 由大到小的顺序为
由大到小的顺序为(3)
 的
的 溶液中
溶液中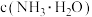
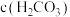 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)由
 滴定
滴定 溶液过程中得
溶液过程中得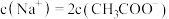 的溶液的溶质为
的溶液的溶质为(5)浓度均为
 的
的 和
和 混合溶液中除
混合溶液中除 外的其他离子浓度的等量关系为
外的其他离子浓度的等量关系为(6)已知
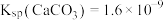 ,则
,则 饱和溶液中的最多的含碳微粒是
饱和溶液中的最多的含碳微粒是
您最近一年使用:0次
10 . 卤素单质及化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)日前,日本悍然将含有 、
、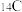 等多种放射性核素的核污染水排入大海,对海洋生态造成极大危害。
等多种放射性核素的核污染水排入大海,对海洋生态造成极大危害。
① 与
与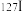 互称为
互称为___________ ,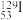 原子中含有中子数为
原子中含有中子数为___________ 。
② 常用作食盐中的补碘剂,其化学名称是
常用作食盐中的补碘剂,其化学名称是___________ 。
(2)①液溴极易挥发,实验室保存时为防止其挥发,通常会加入___________ 液封(填字母)。
a.水 b.煤油 c.
②海水提取溴时,常利用热空气将溴吹入 溶液,已知反应生成了两种盐,其中一种为
溶液,已知反应生成了两种盐,其中一种为 。写出
。写出 与
与 反应的离子方程式:
反应的离子方程式:___________ 。
(3) 是现今最常用的自来水消毒剂,可利用反应
是现今最常用的自来水消毒剂,可利用反应 制备,该反应中氧化剂与还原剂的物质的量之比为
制备,该反应中氧化剂与还原剂的物质的量之比为___________ ,每生成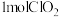 转移的电子数为
转移的电子数为___________ 。
(4)①氟气具有极强的氧化性,可与所有金属反应,但在室温下与铁、铜等块状金属反应却并不明显,可能的原因是___________ 。
②-40℃时, 与冰反应生成HFO和HF,HFO的电子式是
与冰反应生成HFO和HF,HFO的电子式是___________ ,请写出HFO与水发生反应生成两种化合物的化学方程式___________ 。
(1)日前,日本悍然将含有
 、
、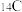 等多种放射性核素的核污染水排入大海,对海洋生态造成极大危害。
等多种放射性核素的核污染水排入大海,对海洋生态造成极大危害。①
 与
与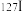 互称为
互称为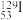 原子中含有中子数为
原子中含有中子数为②
 常用作食盐中的补碘剂,其化学名称是
常用作食盐中的补碘剂,其化学名称是(2)①液溴极易挥发,实验室保存时为防止其挥发,通常会加入
a.水 b.煤油 c.

②海水提取溴时,常利用热空气将溴吹入
 溶液,已知反应生成了两种盐,其中一种为
溶液,已知反应生成了两种盐,其中一种为 。写出
。写出 与
与 反应的离子方程式:
反应的离子方程式:(3)
 是现今最常用的自来水消毒剂,可利用反应
是现今最常用的自来水消毒剂,可利用反应 制备,该反应中氧化剂与还原剂的物质的量之比为
制备,该反应中氧化剂与还原剂的物质的量之比为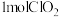 转移的电子数为
转移的电子数为(4)①氟气具有极强的氧化性,可与所有金属反应,但在室温下与铁、铜等块状金属反应却并不明显,可能的原因是
②-40℃时,
 与冰反应生成HFO和HF,HFO的电子式是
与冰反应生成HFO和HF,HFO的电子式是
您最近一年使用:0次