名校
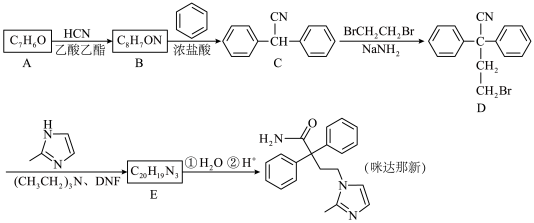
1 . 某研究小组通过下列途径合成药物咪达那新:
(1)物质A的名称为______ 。
(2)化合物D中官能团名称为______ 。
(3)化合物E的结构简式是______ ;物质E与 以物质的量1:1发生反应,可得咪达那新,则其反应类型为
以物质的量1:1发生反应,可得咪达那新,则其反应类型为______ 。
(4)写出C→D的化学方程式______ 。
(5)写出同时符合下列条件的化合物C的同分异构体的结构简式______ (写出两种)。
①分子中含有苯环;
② 谱和IR谱检测表明:苯环上共有5种不同化学环境的氢原子,有
谱和IR谱检测表明:苯环上共有5种不同化学环境的氢原子,有 。
。
(6)某研究小组用乙醇和2-甲基咪唑(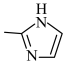 )为原料合成
)为原料合成 ,设计该合成路线
,设计该合成路线______ (用流程图表示,无机试剂任选)。
(1)物质A的名称为
(2)化合物D中官能团名称为
(3)化合物E的结构简式是
 以物质的量1:1发生反应,可得咪达那新,则其反应类型为
以物质的量1:1发生反应,可得咪达那新,则其反应类型为(4)写出C→D的化学方程式
(5)写出同时符合下列条件的化合物C的同分异构体的结构简式
①分子中含有苯环;
②
 谱和IR谱检测表明:苯环上共有5种不同化学环境的氢原子,有
谱和IR谱检测表明:苯环上共有5种不同化学环境的氢原子,有 。
。(6)某研究小组用乙醇和2-甲基咪唑(
 )为原料合成
)为原料合成 ,设计该合成路线
,设计该合成路线
您最近一年使用:0次
名校
解题方法
2 . 甲烷水蒸气催化重整(SMR)是传统制取富氢混合气的重要方法。回答下列问题:
(1)已知1000K时,下列反应的平衡常数和反应热:
①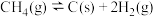
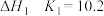
②
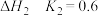
③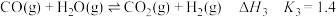
④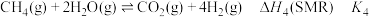
则 时,
时,
______ (用 、
、 、
、 来表示),
来表示),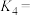
______ 。
(2)在进入催化重整装置前,先要对原料气进行脱硫操作,使其浓度为0.5ppm以下。脱硫的目的为______ 。
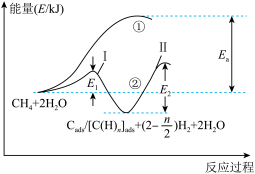
(3)下图为不同温度条件下电流强度对 转化率的影响。由图可知,电流对不同催化剂、不同温度条件下的甲烷水蒸气催化重整反应均有着促进作用,则可推知
转化率的影响。由图可知,电流对不同催化剂、不同温度条件下的甲烷水蒸气催化重整反应均有着促进作用,则可推知
______ 0(填“>”或“<”)。
第一步: 催化裂解生成
催化裂解生成 和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如
和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如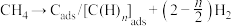 ;
;
第二步:碳(或碳氢物种)和 反应生成
反应生成 和
和 ,如
,如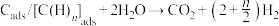 。
。 关系为:①
关系为:①______ ②(填以“>”、“<”或“=”);控制整个过程②反应速率的是第______ 步,其原因为______ 。
(1)已知1000K时,下列反应的平衡常数和反应热:
①
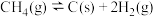
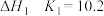
②

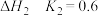
③
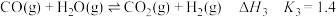
④
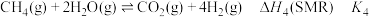
则
 时,
时,
 、
、 、
、 来表示),
来表示),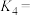
(2)在进入催化重整装置前,先要对原料气进行脱硫操作,使其浓度为0.5ppm以下。脱硫的目的为
(3)下图为不同温度条件下电流强度对
 转化率的影响。由图可知,电流对不同催化剂、不同温度条件下的甲烷水蒸气催化重整反应均有着促进作用,则可推知
转化率的影响。由图可知,电流对不同催化剂、不同温度条件下的甲烷水蒸气催化重整反应均有着促进作用,则可推知

第一步:
 催化裂解生成
催化裂解生成 和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如
和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如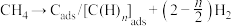 ;
;第二步:碳(或碳氢物种)和
 反应生成
反应生成 和
和 ,如
,如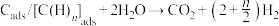 。
。
 关系为:①
关系为:①
您最近一年使用:0次
名校
解题方法
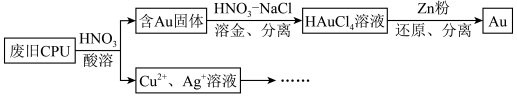
3 . 用如图方法回收废旧CPU中的单质Au(金),Ag和Cu。
(1)酸溶后经______ 操作、将混合物分离。
(2)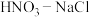 与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
①Au溶于稀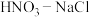 溶液会生成
溶液会生成 ,试写出此溶液中所发生的离子方程式:
,试写出此溶液中所发生的离子方程式:______ 。
②关于溶金的下列说法正确的是______ 。
a.用到了 的氧化性
的氧化性
b.王水中浓盐酸的主要作用是增强溶液的酸性
c.用浓盐酸与 也可使Au溶解
也可使Au溶解
(3)若用Zn粉将溶液中的1mol 完全还原,则参加反应的Zn的物质的量是
完全还原,则参加反应的Zn的物质的量是______ mol。
(4)用适当浓度的盐酸、NaCl溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收Cu和Ag(图中标注的试剂和物质均不同)。______ ,物质2是______ 。

(1)酸溶后经
(2)
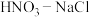 与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。①Au溶于稀
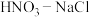 溶液会生成
溶液会生成 ,试写出此溶液中所发生的离子方程式:
,试写出此溶液中所发生的离子方程式:②关于溶金的下列说法正确的是
a.用到了
 的氧化性
的氧化性b.王水中浓盐酸的主要作用是增强溶液的酸性
c.用浓盐酸与
 也可使Au溶解
也可使Au溶解(3)若用Zn粉将溶液中的1mol
 完全还原,则参加反应的Zn的物质的量是
完全还原,则参加反应的Zn的物质的量是(4)用适当浓度的盐酸、NaCl溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收Cu和Ag(图中标注的试剂和物质均不同)。
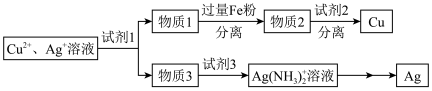
您最近一年使用:0次
名校
解题方法
4 . 钛白( )是重要的化工原料,呈白色粉末,不溶于水。制取钛白的方法主要有两种。
)是重要的化工原料,呈白色粉末,不溶于水。制取钛白的方法主要有两种。
方法一:气相氧化法。反应原理为 。实验室模拟制备二氧化钛的气相氧化装置如图(部分夹持装置已略去)。
。实验室模拟制备二氧化钛的气相氧化装置如图(部分夹持装置已略去)。
已知: 熔点为-24.19℃,沸点为136.4℃,在空气中发烟,生成二氧化钛固体和白雾。
熔点为-24.19℃,沸点为136.4℃,在空气中发烟,生成二氧化钛固体和白雾。
(1)实验装置的连接顺序为a→______ →b→c。
(2)写出 在空气中发烟的化学方程式
在空气中发烟的化学方程式______ 。
(3)A装置中用于添加液体的仪器名称为______ ;B装置球形冷凝管主要冷凝回流的物质为______ 。
(4)C装置的加热方式为______ (填“水浴加热”或“油浴加热”);D装置中的试剂为______ 。
方法二:硫酸法。先制得可溶性钛液, 易水解生成钛酸,进而制得钛白。现需要测定钛液中的含量 首先用铝片将其还原为
易水解生成钛酸,进而制得钛白。现需要测定钛液中的含量 首先用铝片将其还原为 ,再用0.0200
,再用0.0200 标准溶液滴定(反应原理为
标准溶液滴定(反应原理为 )。
)。
(5)滴定时可选用指示剂为______ ,滴定终点的判断______ ;钛液中的 浓度为
浓度为______  。
。
 )是重要的化工原料,呈白色粉末,不溶于水。制取钛白的方法主要有两种。
)是重要的化工原料,呈白色粉末,不溶于水。制取钛白的方法主要有两种。方法一:气相氧化法。反应原理为
 。实验室模拟制备二氧化钛的气相氧化装置如图(部分夹持装置已略去)。
。实验室模拟制备二氧化钛的气相氧化装置如图(部分夹持装置已略去)。已知:
 熔点为-24.19℃,沸点为136.4℃,在空气中发烟,生成二氧化钛固体和白雾。
熔点为-24.19℃,沸点为136.4℃,在空气中发烟,生成二氧化钛固体和白雾。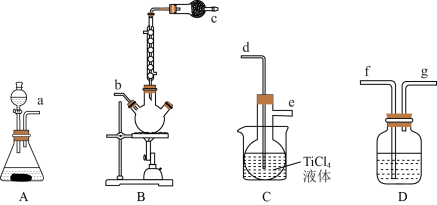
(1)实验装置的连接顺序为a→
(2)写出
 在空气中发烟的化学方程式
在空气中发烟的化学方程式(3)A装置中用于添加液体的仪器名称为
(4)C装置的加热方式为
方法二:硫酸法。先制得可溶性钛液,
 易水解生成钛酸,进而制得钛白。现需要测定钛液中的含量 首先用铝片将其还原为
易水解生成钛酸,进而制得钛白。现需要测定钛液中的含量 首先用铝片将其还原为 ,再用0.0200
,再用0.0200 标准溶液滴定(反应原理为
标准溶液滴定(反应原理为 )。
)。滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.11 | 8.61 |
2 | 25.00 | 7.51 | 15.00 |
3 | 25.00 | 0.30 | 7.81 |
(5)滴定时可选用指示剂为
 浓度为
浓度为 。
。
您最近一年使用:0次
5 . 一种太空生命保障系统利用电解水供氧,生成的氢气与宇航员呼出的二氧化碳在催化剂作用下生成水和甲烷,水可循环使用。
(1)已知 与
与 的燃烧热分别为
的燃烧热分别为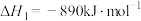 ,
, ;
;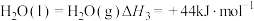 ,写出
,写出 与
与 生成
生成 和
和 的热化学方程式
的热化学方程式_________________ 。
(2)一定温度下,在恒容密闭容器中 与
与 反应生成
反应生成 和
和 。
。
①能说明该反应达到平衡状态的是_________________ (填字母)。
A. B.容器内压强一定
B.容器内压强一定
C.气体平均相对分子质量一定 D.混合气体密度一定
②已知容器的容积为 ,初始加入
,初始加入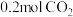 ,和
,和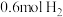 ,反应平衡后测得
,反应平衡后测得 的转化率为
的转化率为 ,则该反应的平衡常数为
,则该反应的平衡常数为_________________ 。
③温度不变,往②平衡状态中再加入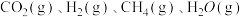 各
各 ,则此时反应速率
,则此时反应速率
_________________ 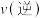 。(填“
。(填“ ”“
”“ ”或“
”或“ ")
")
(3)工业上在一定条件下利用 与
与 可直接合成有机中间体二甲醚:
可直接合成有机中间体二甲醚: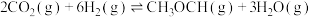 。
。
当 时,实验测得
时,实验测得 的平衡转化率随温度及压强变化如图所示:
的平衡转化率随温度及压强变化如图所示:
_________________ (填“ ”或“
”或“ ”)0。
”)0。
②图中压强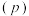 由大到小的顺序是
由大到小的顺序是_________________ 。
(1)已知
 与
与 的燃烧热分别为
的燃烧热分别为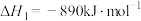 ,
, ;
;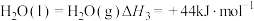 ,写出
,写出 与
与 生成
生成 和
和 的热化学方程式
的热化学方程式(2)一定温度下,在恒容密闭容器中
 与
与 反应生成
反应生成 和
和 。
。①能说明该反应达到平衡状态的是
A.
 B.容器内压强一定
B.容器内压强一定C.气体平均相对分子质量一定 D.混合气体密度一定
②已知容器的容积为
 ,初始加入
,初始加入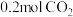 ,和
,和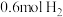 ,反应平衡后测得
,反应平衡后测得 的转化率为
的转化率为 ,则该反应的平衡常数为
,则该反应的平衡常数为③温度不变,往②平衡状态中再加入
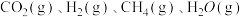 各
各 ,则此时反应速率
,则此时反应速率
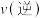 。(填“
。(填“ ”“
”“ ”或“
”或“ ")
")(3)工业上在一定条件下利用
 与
与 可直接合成有机中间体二甲醚:
可直接合成有机中间体二甲醚: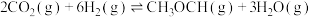 。
。当
 时,实验测得
时,实验测得 的平衡转化率随温度及压强变化如图所示:
的平衡转化率随温度及压强变化如图所示: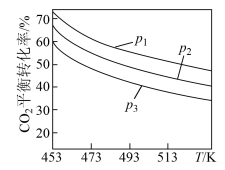

 ”或“
”或“ ”)0。
”)0。②图中压强
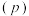 由大到小的顺序是
由大到小的顺序是
您最近一年使用:0次
解题方法
6 . 镍主要用于合金及用作催化剂,也可用来制造货币等。以镍废渣(主要成分为 ,还含有
,还含有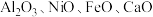 和
和 为原料制备纯镍的流程如图,回答下列问题:
为原料制备纯镍的流程如图,回答下列问题:_____________ (填化学式):常温下,“酸浸”中硫酸浓度与镍浸出率的关系如图所示,硫酸浓度大于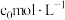 后,镍浸出率降低的可能原因是
后,镍浸出率降低的可能原因是_____________ 。_________________________________________________ (用离子方程式表示)。
(3)请设计实验确认“氧化”过程中的杂质离子已经被完全转化_____________________________________ 。
(4)“沉铝”时 的作用是
的作用是_________________ ,“操作 ”包括蒸发浓缩、
”包括蒸发浓缩、_____________ 、过滤、洗涤。
 ,还含有
,还含有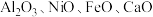 和
和 为原料制备纯镍的流程如图,回答下列问题:
为原料制备纯镍的流程如图,回答下列问题: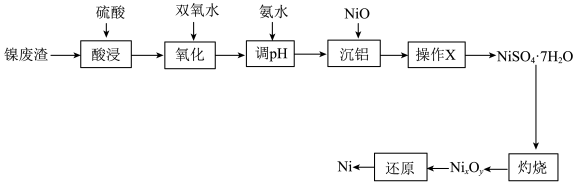
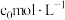 后,镍浸出率降低的可能原因是
后,镍浸出率降低的可能原因是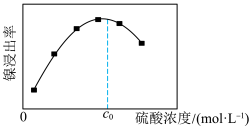
(3)请设计实验确认“氧化”过程中的杂质离子已经被完全转化
(4)“沉铝”时
 的作用是
的作用是 ”包括蒸发浓缩、
”包括蒸发浓缩、
您最近一年使用:0次
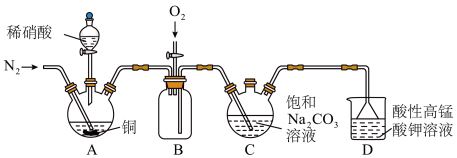
7 . 亚硝酸钠 主要用于医药、食品保鲜、染料等行业。某小组拟利用氮氧化物(可用
主要用于医药、食品保鲜、染料等行业。某小组拟利用氮氧化物(可用 表示)制备亚硝酸钠,实验装置如图。
表示)制备亚硝酸钠,实验装置如图。
已知: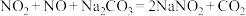 ,
,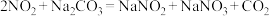
 溶液和饱和
溶液和饱和 液在加热条件下反应可制得
液在加热条件下反应可制得 ,该反应的化学方程式为
,该反应的化学方程式为_________________ ;实验时装置B中应间断性通入适量的 ,其目的是
,其目的是_________________ 。
(2)装置C中盛装饱和 溶液的仪器的名称是
溶液的仪器的名称是_________________ ; 不能单独被纯碱溶液吸收,为了使
不能单独被纯碱溶液吸收,为了使 全被纯碱溶液吸收且产品纯度最高,
全被纯碱溶液吸收且产品纯度最高,
_________________ 。
(3)装置D的作用是_________________ ,采用“倒置漏斗”措施的目的是_________________
(4)设计实验探究 的性质。制备
的性质。制备 实验完毕后,从装置C中分离出
实验完毕后,从装置C中分离出 固体粗产品(不含
固体粗产品(不含 杂质),取少量
杂质),取少量粗产品 配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如下表。
上述实验_________ (填标号)的结论不严谨;你判断的依据是:_____________________________________________ 。
 主要用于医药、食品保鲜、染料等行业。某小组拟利用氮氧化物(可用
主要用于医药、食品保鲜、染料等行业。某小组拟利用氮氧化物(可用 表示)制备亚硝酸钠,实验装置如图。
表示)制备亚硝酸钠,实验装置如图。已知:
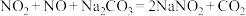 ,
,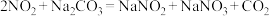
 溶液和饱和
溶液和饱和 液在加热条件下反应可制得
液在加热条件下反应可制得 ,该反应的化学方程式为
,该反应的化学方程式为 ,其目的是
,其目的是(2)装置C中盛装饱和
 溶液的仪器的名称是
溶液的仪器的名称是 不能单独被纯碱溶液吸收,为了使
不能单独被纯碱溶液吸收,为了使 全被纯碱溶液吸收且产品纯度最高,
全被纯碱溶液吸收且产品纯度最高,
(3)装置D的作用是
(4)设计实验探究
 的性质。制备
的性质。制备 实验完毕后,从装置C中分离出
实验完毕后,从装置C中分离出 固体粗产品(不含
固体粗产品(不含 杂质),取少量
杂质),取少量| 实验 | 实验操作及现象 | 结论 |
| 甲 | 滴入无色酚酞溶液中,无色酚酞溶液变红 |  是弱酸 是弱酸 |
| 乙 | 滴入少量酸性 淀粉溶液中,振荡,酸性 淀粉溶液中,振荡,酸性 淀粉溶液变蓝 淀粉溶液变蓝 | 酸性条件下, 具有氧化性 具有氧化性 |
| 丙 | 滴入少量酸性 溶液中,振荡,酸性 溶液中,振荡,酸性 溶液褪色 溶液褪色 | 酸性条件下, 有还原性 有还原性 |
您最近一年使用:0次
名校
解题方法
8 . 钠是一种活泼金属,其单质及化合物在科研、生产中有重要的作用。
(1)基态钠原子核外电子的空间运动状态有___________ 种。
(2)冰晶石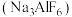 是铝电解的助熔剂,其晶胞与氯化钠的晶胞结构相似(如图所示),
是铝电解的助熔剂,其晶胞与氯化钠的晶胞结构相似(如图所示),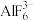 占据的位置相当于氯化钠晶胞中
占据的位置相当于氯化钠晶胞中 占据的位置。
占据的位置。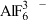 是正八面体结构,中心原子的杂化方式是
是正八面体结构,中心原子的杂化方式是___________ (填字母)。
A. B.
B. C.
C. D.
D.
② 晶体中存在的作用力有
晶体中存在的作用力有___________ (填字母)。
A.非极性共价键 B.配位键 C.范德华力 D.离子键
(3) 与
与 均为第三周期元素,
均为第三周期元素, 熔点明显高于
熔点明显高于 ,其原因是
,其原因是___________ 。
(4)硼氢化钠是一种常用的还原剂和催化剂。硼氢化钠的晶胞结构如图所示。 ,硼氢化钠溶于水的化学方程式为
,硼氢化钠溶于水的化学方程式为___________ ,硼氢化钠晶胞中与 紧邻的
紧邻的 个数是
个数是___________ 。
(5)有研究表明,在超高压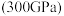 下,金属钠和氦之间可形成化合物电子盐(即电子是阴离子),在这一结构中,钠离子主要是按照简单立方排列的(如图1),并且形成
下,金属钠和氦之间可形成化合物电子盐(即电子是阴离子),在这一结构中,钠离子主要是按照简单立方排列的(如图1),并且形成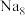 立方体空隙,电子对(2e-)和氦原子交替分布填充在立方体的中心。晶体结构俯视图如图2所示:
立方体空隙,电子对(2e-)和氦原子交替分布填充在立方体的中心。晶体结构俯视图如图2所示: 的最短距离为
的最短距离为___________  (用含a的代数式表示)。
(用含a的代数式表示)。
(1)基态钠原子核外电子的空间运动状态有
(2)冰晶石
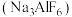 是铝电解的助熔剂,其晶胞与氯化钠的晶胞结构相似(如图所示),
是铝电解的助熔剂,其晶胞与氯化钠的晶胞结构相似(如图所示),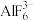 占据的位置相当于氯化钠晶胞中
占据的位置相当于氯化钠晶胞中 占据的位置。
占据的位置。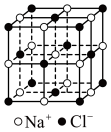
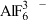 是正八面体结构,中心原子的杂化方式是
是正八面体结构,中心原子的杂化方式是A.
 B.
B. C.
C. D.
D.
②
 晶体中存在的作用力有
晶体中存在的作用力有A.非极性共价键 B.配位键 C.范德华力 D.离子键
(3)
 与
与 均为第三周期元素,
均为第三周期元素, 熔点明显高于
熔点明显高于 ,其原因是
,其原因是(4)硼氢化钠是一种常用的还原剂和催化剂。硼氢化钠的晶胞结构如图所示。
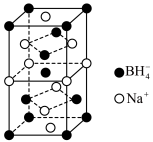
 ,硼氢化钠溶于水的化学方程式为
,硼氢化钠溶于水的化学方程式为 紧邻的
紧邻的 个数是
个数是(5)有研究表明,在超高压
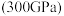 下,金属钠和氦之间可形成化合物电子盐(即电子是阴离子),在这一结构中,钠离子主要是按照简单立方排列的(如图1),并且形成
下,金属钠和氦之间可形成化合物电子盐(即电子是阴离子),在这一结构中,钠离子主要是按照简单立方排列的(如图1),并且形成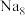 立方体空隙,电子对(2e-)和氦原子交替分布填充在立方体的中心。晶体结构俯视图如图2所示:
立方体空隙,电子对(2e-)和氦原子交替分布填充在立方体的中心。晶体结构俯视图如图2所示: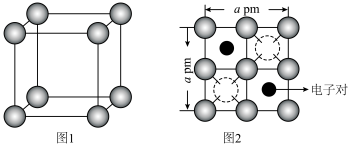
 的最短距离为
的最短距离为 (用含a的代数式表示)。
(用含a的代数式表示)。
您最近一年使用:0次
解题方法
9 . CH3OH是一种绿色能源,也是一种化工原料。回答下列问题:
Ⅰ.合成甲醇。
工业上常用CO和H2制备CH3OH,反应原理是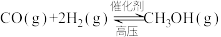
 。
。
(1)已知:①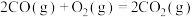
 kJ⋅mol
kJ⋅mol
②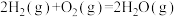
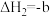 kJ⋅mol
kJ⋅mol
③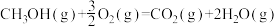
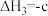 kJ⋅mol
kJ⋅mol
上述反应的
___________ kJ⋅mol (用含a、b、c的代数式表示)。
(用含a、b、c的代数式表示)。
(2)在恒温恒容密闭容器中充入1 mol 和1 mol
和1 mol  合成
合成 。下列情况表明该反应一定达到平衡状态的是___________(填字母)。
。下列情况表明该反应一定达到平衡状态的是___________(填字母)。
(3)向体积相同的甲、乙恒容密闭容器中均充入1 mol 和3 mol
和3 mol  同时发生反应合成
同时发生反应合成 ,相对甲,乙仅改变温度,测得甲醇的物质的量与时间的关系如图所示。
,相对甲,乙仅改变温度,测得甲醇的物质的量与时间的关系如图所示。___________ (填“高于”或“低于”)乙,判断依据是___________ 。
②
___________ (填“>”“<”或“=”)0,判断依据是___________ 。
③若容器体积为1 L,甲容器中0~4 min内用H2表示的平均反应速率为___________ mol⋅L ⋅min
⋅min 。
。
Ⅱ.可用于合成有机物。
近日,中国科学院大连化学物理研究所丁云杰团队利用Rh单核配合物催化剂以和CO为原料合成了CH3COOH,相关反应为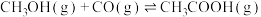 、
、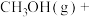
 。
。
(4)以CH3OH和CO为原料,从原子利用率分析,合成___________ (填“CH3COOH”或“CH3COOCH3”)是最理想的绿色化学工艺。
(5)一定温度下,总压强保持1.5a kPa,向反应器中充入1 mol 和1 mol
和1 mol  ,在一定条件下合成
,在一定条件下合成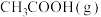 和
和 。达到平衡时,
。达到平衡时, 的转化率为60%,
的转化率为60%,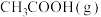 的选择性为80%,(
的选择性为80%,( 的选择性
的选择性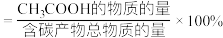 )。该温度下合成
)。该温度下合成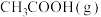 反应的平衡常数
反应的平衡常数
___________  (用含a的代数式表示,
(用含a的代数式表示, 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。
Ⅰ.合成甲醇。
工业上常用CO和H2制备CH3OH,反应原理是
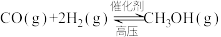
 。
。(1)已知:①
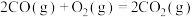
 kJ⋅mol
kJ⋅mol
②
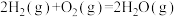
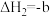 kJ⋅mol
kJ⋅mol
③
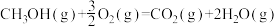
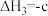 kJ⋅mol
kJ⋅mol
上述反应的

 (用含a、b、c的代数式表示)。
(用含a、b、c的代数式表示)。(2)在恒温恒容密闭容器中充入1 mol
 和1 mol
和1 mol  合成
合成 。下列情况表明该反应一定达到平衡状态的是___________(填字母)。
。下列情况表明该反应一定达到平衡状态的是___________(填字母)。| A.气体压强不随时间变化 | B.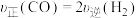 |
| C.气体密度不随时间变化 | D.气体平均摩尔质量不随时间变化 |
(3)向体积相同的甲、乙恒容密闭容器中均充入1 mol
 和3 mol
和3 mol  同时发生反应合成
同时发生反应合成 ,相对甲,乙仅改变温度,测得甲醇的物质的量与时间的关系如图所示。
,相对甲,乙仅改变温度,测得甲醇的物质的量与时间的关系如图所示。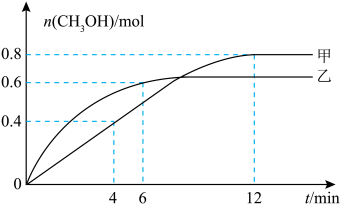
②

③若容器体积为1 L,甲容器中0~4 min内用H2表示的平均反应速率为
 ⋅min
⋅min 。
。Ⅱ.可用于合成有机物。
近日,中国科学院大连化学物理研究所丁云杰团队利用Rh单核配合物催化剂以和CO为原料合成了CH3COOH,相关反应为
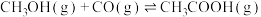 、
、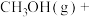
 。
。(4)以CH3OH和CO为原料,从原子利用率分析,合成
(5)一定温度下,总压强保持1.5a kPa,向反应器中充入1 mol
 和1 mol
和1 mol  ,在一定条件下合成
,在一定条件下合成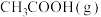 和
和 。达到平衡时,
。达到平衡时, 的转化率为60%,
的转化率为60%,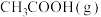 的选择性为80%,(
的选择性为80%,( 的选择性
的选择性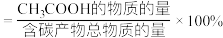 )。该温度下合成
)。该温度下合成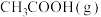 反应的平衡常数
反应的平衡常数
 (用含a的代数式表示,
(用含a的代数式表示, 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
名校
解题方法
10 . 磁性材料氮化铁镍合金应用广泛。
(1)基态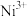 核外电子排布式为
核外电子排布式为_______ 。基态 原子与基态
原子与基态 原子核外未成对电子数之比为
原子核外未成对电子数之比为_______ 。
(2)丁二酮肟(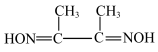 )是检验
)是检验 的灵敏试剂。丁二酮肟分子中碳原子轨道的杂化类型为
的灵敏试剂。丁二酮肟分子中碳原子轨道的杂化类型为_______ ,除 以外的非金属元素的第一电离能由小到大的顺序为
以外的非金属元素的第一电离能由小到大的顺序为_______ (用元素符号表示)。
(3)如图为一种含镍配合物及其配体。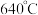 可发生置换反应,产物之一的晶胞结构如图,该反应的化学方程式为
可发生置换反应,产物之一的晶胞结构如图,该反应的化学方程式为_______ ;该晶胞中与铁原子最近且距离相等的铁原子个数为_______ 个。
(1)基态
 核外电子排布式为
核外电子排布式为 原子与基态
原子与基态 原子核外未成对电子数之比为
原子核外未成对电子数之比为(2)丁二酮肟(
 )是检验
)是检验 的灵敏试剂。丁二酮肟分子中碳原子轨道的杂化类型为
的灵敏试剂。丁二酮肟分子中碳原子轨道的杂化类型为 以外的非金属元素的第一电离能由小到大的顺序为
以外的非金属元素的第一电离能由小到大的顺序为(3)如图为一种含镍配合物及其配体。

①物质 在一定条件下水解生成邻羟基苯甲醛(
在一定条件下水解生成邻羟基苯甲醛( ),其沸点为
),其沸点为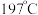 ,而对羟基苯甲醛(
,而对羟基苯甲醛(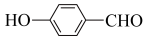 )的沸点为
)的沸点为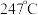 ,导致两种物质沸点相差较大的原因是
,导致两种物质沸点相差较大的原因是
②由于 原子上存在孤电子对,使含氮分子有碱性。
原子上存在孤电子对,使含氮分子有碱性。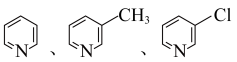 的碱性与
的碱性与 原子电子云密度有关,电子云密度越大、碱性越强,由此判断这三种物质中碱性最弱的是
原子电子云密度有关,电子云密度越大、碱性越强,由此判断这三种物质中碱性最弱的是
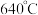 可发生置换反应,产物之一的晶胞结构如图,该反应的化学方程式为
可发生置换反应,产物之一的晶胞结构如图,该反应的化学方程式为
您最近一年使用:0次



