1 . 车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。
(1)汽车尾气中的 、
、 、
、 等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①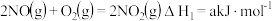
②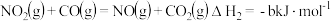
③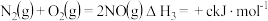
则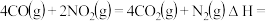
_______ kJ/mol。
(2)改善能源结构是治理雾霾问题的最直接有效途径。甲醇是一种清洁能源,可用水煤气在催化剂下制备,其反应为: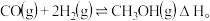 将
将 和
和 充入一容积为
充入一容积为 的密闭容器中,分别在
的密闭容器中,分别在 、
、 下发生反应,根据如图回答问题:
下发生反应,根据如图回答问题:
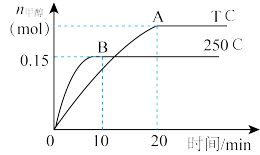
①写出该反应的平衡常数表达式
_______ ;反应达平衡后,其他条件不变,若缩小容积, 体积分数
体积分数_______ (填“增大”、“减小”或“不变”)。
②250℃时,反应前 的平均速率
的平均速率
_______ ,平衡时 的转化率
的转化率
_______ 。
③温度比较:T℃_______ 250℃(填“ ”“
”“ ”或“
”或“ ”);ΔH
”);ΔH_______ 0(填“ ”、“
”、“ ”或“
”或“ ”)
”)
(3)炭黑是雾霾的重要颗粒物,研究发现它能活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化 下列说法不正确的是_______。
下列说法不正确的是_______。

(1)汽车尾气中的
 、
、 、
、 等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。已知:①
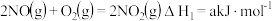
②
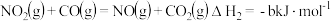
③
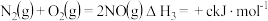
则
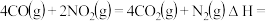
(2)改善能源结构是治理雾霾问题的最直接有效途径。甲醇是一种清洁能源,可用水煤气在催化剂下制备,其反应为:
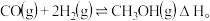 将
将 和
和 充入一容积为
充入一容积为 的密闭容器中,分别在
的密闭容器中,分别在 、
、 下发生反应,根据如图回答问题:
下发生反应,根据如图回答问题:
①写出该反应的平衡常数表达式

 体积分数
体积分数②250℃时,反应前
 的平均速率
的平均速率
 的转化率
的转化率
③温度比较:T℃
 ”“
”“ ”或“
”或“ ”);ΔH
”);ΔH ”、“
”、“ ”或“
”或“ ”)
”)(3)炭黑是雾霾的重要颗粒物,研究发现它能活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化
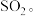 下列说法不正确的是_______。
下列说法不正确的是_______。
A.每活化一个氧分子吸收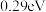 能量 能量 |
B.水可使氧分子活化反应的活化能降低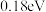 |
C.氧分子的活化是 键的断裂与 键的断裂与 键的生成过程 键的生成过程 |
D.炭黑颗粒是大气中 转化为 转化为 的催化剂 的催化剂 |
您最近一年使用:0次
2022-12-03更新
|
62次组卷
|
3卷引用:安徽省滁州市定远县育才学校2021-2022学年高二上学期期中考试(实验班)化学试题
解题方法
2 . 请回答下列问题:
(1)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。在一容积为 的密闭容器内,充入
的密闭容器内,充入 与
与 并发生反应:
并发生反应: 的平衡转化率与温度,压强的关系如图所示。
的平衡转化率与温度,压强的关系如图所示。

①A、 两点对应的压强大小关系是pA
两点对应的压强大小关系是pA_______ pB(填“ ”、“
”、“ ”或“
”或“ ”)
”)
②A、 、
、 三点的平衡常数
三点的平衡常数 、
、 、
、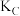 的大小关系是
的大小关系是_______ 。
③在 压强、
压强、 时,该反应的平衡常数
时,该反应的平衡常数
_______ , 、
、 的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,
的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下, 、
、 、
、 。此时v(正)
。此时v(正)_______ v(逆)。(填“ ”“
”“ ”或“
”或“ ”)
”)
(2)氨气是工业制硝酸的主要原料。 时,
时, 和
和 可能发生如下反应:
可能发生如下反应:
①4NH3(g)+5O2(g) 4NO(g)+6H2O(l) ΔH=-907kJ/mol
4NO(g)+6H2O(l) ΔH=-907kJ/mol
②4NH3(g)+3O2(g) 2N2(g)+6H2O(l) ΔH=-1269kJ/mol
2N2(g)+6H2O(l) ΔH=-1269kJ/mol
其中②是副反应,若要减少副反应,提高 的产率,最合理的措施是
的产率,最合理的措施是_______ ; 时
时 和
和 反应生成
反应生成 的热化学方程式为
的热化学方程式为_______ 。
(1)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。在一容积为
 的密闭容器内,充入
的密闭容器内,充入 与
与 并发生反应:
并发生反应: 的平衡转化率与温度,压强的关系如图所示。
的平衡转化率与温度,压强的关系如图所示。
①A、
 两点对应的压强大小关系是pA
两点对应的压强大小关系是pA ”、“
”、“ ”或“
”或“ ”)
”)②A、
 、
、 三点的平衡常数
三点的平衡常数 、
、 、
、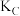 的大小关系是
的大小关系是③在
 压强、
压强、 时,该反应的平衡常数
时,该反应的平衡常数
 、
、 的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,
的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下, 、
、 、
、 。此时v(正)
。此时v(正) ”“
”“ ”或“
”或“ ”)
”) (2)氨气是工业制硝酸的主要原料。
 时,
时, 和
和 可能发生如下反应:
可能发生如下反应:①4NH3(g)+5O2(g)
 4NO(g)+6H2O(l) ΔH=-907kJ/mol
4NO(g)+6H2O(l) ΔH=-907kJ/mol②4NH3(g)+3O2(g)
 2N2(g)+6H2O(l) ΔH=-1269kJ/mol
2N2(g)+6H2O(l) ΔH=-1269kJ/mol其中②是副反应,若要减少副反应,提高
 的产率,最合理的措施是
的产率,最合理的措施是 时
时 和
和 反应生成
反应生成 的热化学方程式为
的热化学方程式为
您最近一年使用:0次
3 . 写出铁和硫酸铜溶液反应离子方程式_____ ,硫酸铜溶液是_____ 颜色,方程式中氧化剂是____ ,氧化产物是_____ ,二者氧化性强弱顺序是_____ 。
您最近一年使用:0次
4 . 用惰性电极电解硫酸钠溶液时,已知阳极电子转移为1mol,问阴极所得产物及物质的量_______ 。
您最近一年使用:0次
5 . 某化学兴趣小组为了制取并探究氨气性质,按下列装置(夹持装置已略去)进行实验。

【实验探究】
(1)实验室制氨气的化学方程式_______ 利用上述原理,应选用下图中_______ 发生装置进行实验。

(2)F装置中倒置漏斗的作用_______ 。
(3)某同学用排空气法收集一圆底烧瓶氨气做喷泉实验,结果发现液面只上升到圆底烧瓶的一半,该同学认为收集到的氨气不纯,请你求出混合气体的摩尔质量为_______ g/mol,最终所得溶液的浓度为_______ mol/L。

(4)氨气的用途很广,可以作为工业制硝酸的原料,写出氨气催化生成NO的化学方程式_______ 。
(5)硝酸工业尾气中的NO、NO2进入大气后,会形成光化学烟雾、破坏臭氧层等。可用氢氧化钠溶液对含氮氧化物的废气进行处理,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+NaNO3+H2O,将一定量NO和NO2的混合气体通入300mL5mol·L-1NaOH溶液中,恰好被完全吸收,则标准状况下NO最多为_______ L。

【实验探究】
(1)实验室制氨气的化学方程式

(2)F装置中倒置漏斗的作用
(3)某同学用排空气法收集一圆底烧瓶氨气做喷泉实验,结果发现液面只上升到圆底烧瓶的一半,该同学认为收集到的氨气不纯,请你求出混合气体的摩尔质量为

(4)氨气的用途很广,可以作为工业制硝酸的原料,写出氨气催化生成NO的化学方程式
(5)硝酸工业尾气中的NO、NO2进入大气后,会形成光化学烟雾、破坏臭氧层等。可用氢氧化钠溶液对含氮氧化物的废气进行处理,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+NaNO3+H2O,将一定量NO和NO2的混合气体通入300mL5mol·L-1NaOH溶液中,恰好被完全吸收,则标准状况下NO最多为
您最近一年使用:0次
6 . 氯及其化合物在工业生产中具有很重要的作用。
(1)舍勒制氯气的方法至今仍是实验室制氯气的常用方法,其离子方程式为:_______ 。要想得到纯净干燥的氯气,一般先通入饱和的食盐水,然后再通入浓硫酸中。饱和食盐水的作用:①_______ ②降低氯气在水中的溶解度。试通过平衡移动的原理分析饱和食盐水降低氯气在水中的溶解度。原因是:_______ 。
(2)氯的化合物 在有机合成中占有很重要的作用。一般可以通过在一硬质玻璃烧瓶中加入过量
在有机合成中占有很重要的作用。一般可以通过在一硬质玻璃烧瓶中加入过量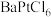 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)来制取。已知:氯铂酸钡
,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)来制取。已知:氯铂酸钡 固体加热时部分分解为
固体加热时部分分解为 、
、 和
和 ,T℃时平衡常数
,T℃时平衡常数 。在T℃,碘蒸气初始压强为30.0kPa。T℃平衡时,测得烧瓶中压强为40.2kPa,则
。在T℃,碘蒸气初始压强为30.0kPa。T℃平衡时,测得烧瓶中压强为40.2kPa,则
_______ kPa,反应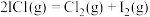 的平衡常数
的平衡常数
_______ 。
(3)氯的许多化合物为疫情防控提供了强有力的物质支撑。已知:
①次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数 [
[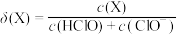 ,X为
,X为 或
或 与pH的关系如图所示。
与pH的关系如图所示。 的电离常数
的电离常数 值为
值为_______ 。

② 常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为
常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为 、
、 、
、 的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到
的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到 溶液。上述过程中,生成
溶液。上述过程中,生成 的反应属于歧化反应,每生成1mol
的反应属于歧化反应,每生成1mol 消耗
消耗 的量为
的量为_______ mol;产生“气泡”的化学方程式为_______ 。
③84消毒液的主要成分为 和
和 。已知25℃时,下列酸的电离平衡常数如下:
。已知25℃时,下列酸的电离平衡常数如下:
写出少量的 通入84消毒液中的离子方程式:
通入84消毒液中的离子方程式:_______ 。
④二氯异氰尿酸钠是一种常用的消毒剂,具有很强的氧化性,对各种致病性微生物如病毒、细菌芽孢、真菌等有很强的杀生作用,是一种适用范围广,高效的杀菌剂,二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。
已知:实验检测原理为:
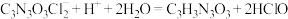



准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量 溶液,密封在暗处静置5min;用
溶液,密封在暗处静置5min;用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。
滴定终点的现象是:_______ ,该样品有效氯=_______ 。
(1)舍勒制氯气的方法至今仍是实验室制氯气的常用方法,其离子方程式为:
(2)氯的化合物
 在有机合成中占有很重要的作用。一般可以通过在一硬质玻璃烧瓶中加入过量
在有机合成中占有很重要的作用。一般可以通过在一硬质玻璃烧瓶中加入过量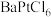 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)来制取。已知:氯铂酸钡
,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)来制取。已知:氯铂酸钡 固体加热时部分分解为
固体加热时部分分解为 、
、 和
和 ,T℃时平衡常数
,T℃时平衡常数 。在T℃,碘蒸气初始压强为30.0kPa。T℃平衡时,测得烧瓶中压强为40.2kPa,则
。在T℃,碘蒸气初始压强为30.0kPa。T℃平衡时,测得烧瓶中压强为40.2kPa,则
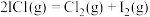 的平衡常数
的平衡常数
(3)氯的许多化合物为疫情防控提供了强有力的物质支撑。已知:
①次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数
 [
[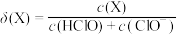 ,X为
,X为 或
或 与pH的关系如图所示。
与pH的关系如图所示。 的电离常数
的电离常数 值为
值为
②
 常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为
常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为 、
、 、
、 的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到
的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到 溶液。上述过程中,生成
溶液。上述过程中,生成 的反应属于歧化反应,每生成1mol
的反应属于歧化反应,每生成1mol 消耗
消耗 的量为
的量为③84消毒液的主要成分为
 和
和 。已知25℃时,下列酸的电离平衡常数如下:
。已知25℃时,下列酸的电离平衡常数如下:| 化学式 |  |  |  |
| 电离平衡常数 |  |   |  |
 通入84消毒液中的离子方程式:
通入84消毒液中的离子方程式:④二氯异氰尿酸钠是一种常用的消毒剂,具有很强的氧化性,对各种致病性微生物如病毒、细菌芽孢、真菌等有很强的杀生作用,是一种适用范围广,高效的杀菌剂,二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。
已知:实验检测原理为:
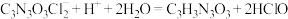



准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量
 溶液,密封在暗处静置5min;用
溶液,密封在暗处静置5min;用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。滴定终点的现象是:
您最近一年使用:0次
2022-04-16更新
|
166次组卷
|
2卷引用:安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题
7 . 化学和生活密切相关,下列生产生活中实例不能用勒夏特列原理解释的是
| A.摇晃后的可乐开启后有大量气泡 |
| B.合成氨工业中温度选择400-500℃ |
| C.酸遇紫色石蕊试剂变红 |
| D.生产硫酸的过程中用过量的空气和二氧化硫反应 |
您最近一年使用:0次
2022-04-16更新
|
210次组卷
|
3卷引用:安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题
安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题(已下线)2.4 化学反应的调控-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
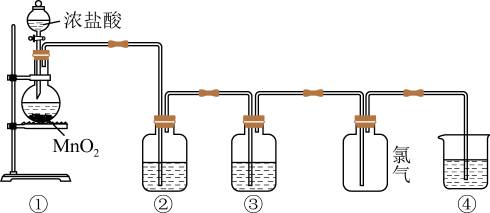
8 . 最近池州市市民为了创建文明城市,经常用到含氯消毒剂。其中“84消毒液”有效成分为次氯酸钠,它也是抗疫消毒剂之一,可由氯气和氢氧化钠溶液反应后制得。为制备并探究氯气,某化学兴趣小组设计下列实验装置。请回答:
(1)下列分析中不正确的是___________。
(2)该方法制氯气的化学方程式为___________ 。将8.7g 与含
与含 14.6g的浓盐酸共热制
14.6g的浓盐酸共热制 ,甲同学认为恰好完全反应可制得
,甲同学认为恰好完全反应可制得 体积V=
体积V=___________ L(精确到小数点后一位)(常温下,氯气的密度为2.91g/L),乙同学认为制得 的体积小于VL,你认为
的体积小于VL,你认为___________ (填“甲”或“乙”)同学正确。
(3)氯气有多种性质:
①在盛有氯气集气瓶中放入湿润的淀粉碘化钾(KI)试纸,发现试纸变蓝(已知淀粉遇 变蓝色)。涉及化学反应的离子方程式为
变蓝色)。涉及化学反应的离子方程式为___________ ,该反应体现氯气具有___________ 性。
②“84消毒液”对棉麻织品有腐蚀作用,对有色物质有褪色作用,禁用于毛、麻丝织品消毒。写出制得“84消毒液”的离子方程式___________ 。
③氯气溶于水,得到具有杀菌、漂白作用的氯水。氯水中具有漂白作用的粒子是___________ (填化学式)。氯水用强光照射,数字化实验显示溶液的pH减小、氯离子浓度逐渐增大、氧气体积分数增大。请用化学方程式解释:___________ 。
(4)实验室还可用高锰酸钾不需要加热快速地制取氯气,反应的化学方程式如下: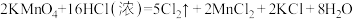
①请用双线桥标出该反应电子转移的方向和数目_____ 。
②该反应中___________ 元素被氧化,_____ 元素发生还原反应(用元素符号填写)。若生成n个氯气分子,反应中转移___________ 个电子。
(1)下列分析中不正确的是___________。

| A.①中缺少加热装置 |
B.②中盛放的饱和 溶液可以除去氯气中的氯化氢气体 溶液可以除去氯气中的氯化氢气体 |
| C.③盛装浓硫酸的装置可以用盛装碱石灰的装置代替 |
D.④中盛装 溶液的烧杯必须要用小漏斗倒扣液面上方,防止倒吸 溶液的烧杯必须要用小漏斗倒扣液面上方,防止倒吸 |
 与含
与含 14.6g的浓盐酸共热制
14.6g的浓盐酸共热制 ,甲同学认为恰好完全反应可制得
,甲同学认为恰好完全反应可制得 体积V=
体积V= 的体积小于VL,你认为
的体积小于VL,你认为(3)氯气有多种性质:
①在盛有氯气集气瓶中放入湿润的淀粉碘化钾(KI)试纸,发现试纸变蓝(已知淀粉遇
 变蓝色)。涉及化学反应的离子方程式为
变蓝色)。涉及化学反应的离子方程式为②“84消毒液”对棉麻织品有腐蚀作用,对有色物质有褪色作用,禁用于毛、麻丝织品消毒。写出制得“84消毒液”的离子方程式
③氯气溶于水,得到具有杀菌、漂白作用的氯水。氯水中具有漂白作用的粒子是
(4)实验室还可用高锰酸钾不需要加热快速地制取氯气,反应的化学方程式如下:
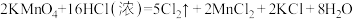
①请用双线桥标出该反应电子转移的方向和数目
②该反应中
您最近一年使用:0次
9 . 化学是一门以实验为基础的学科,研究小组需要经常做实验。
(1)某研究小组甲模仿侯德榜制备纯碱,反应原理如下: 即向饱和食盐水中通入足量氨气至饱和,然后通入过量二氧化碳,析出溶解度
即向饱和食盐水中通入足量氨气至饱和,然后通入过量二氧化碳,析出溶解度___________ (填较小或较大)的碳酸氢钠。欲得到纯碱,该研究小组将固体过滤、洗涤后,还需进行的操作是___________ (选装置)。
A. B.
B. C.
C. D.
D.
反应的化学方程式是_______ 。
(2)某研究小组乙在探究 的性质实验时,发现
的性质实验时,发现 样品与过量水反应,待完全反应不再产生氧气后,得溶液M。溶液M可使酸性
样品与过量水反应,待完全反应不再产生氧气后,得溶液M。溶液M可使酸性 溶液褪色,同时放出氧气。小组成员查阅资料表明,
溶液褪色,同时放出氧气。小组成员查阅资料表明, 与水反应还可生成
与水反应还可生成 。
。
① 与水反应生成
与水反应生成 的反应是否属于氧化还原反应
的反应是否属于氧化还原反应___________ (填是、否)。
②写出 与水反应的离子反应方程式
与水反应的离子反应方程式___________ 。
③完成并配平该反应的离子方程式:______ ______ +______
+______ +_____
+_____ =______
=______ +___
+___ +______
+______
(1)某研究小组甲模仿侯德榜制备纯碱,反应原理如下:
 即向饱和食盐水中通入足量氨气至饱和,然后通入过量二氧化碳,析出溶解度
即向饱和食盐水中通入足量氨气至饱和,然后通入过量二氧化碳,析出溶解度A.
 B.
B. C.
C. D.
D.
反应的化学方程式是
(2)某研究小组乙在探究
 的性质实验时,发现
的性质实验时,发现 样品与过量水反应,待完全反应不再产生氧气后,得溶液M。溶液M可使酸性
样品与过量水反应,待完全反应不再产生氧气后,得溶液M。溶液M可使酸性 溶液褪色,同时放出氧气。小组成员查阅资料表明,
溶液褪色,同时放出氧气。小组成员查阅资料表明, 与水反应还可生成
与水反应还可生成 。
。①
 与水反应生成
与水反应生成 的反应是否属于氧化还原反应
的反应是否属于氧化还原反应②写出
 与水反应的离子反应方程式
与水反应的离子反应方程式③完成并配平该反应的离子方程式:
 +______
+______ +_____
+_____ =______
=______ +___
+___ +______
+______
您最近一年使用:0次
2022-03-31更新
|
250次组卷
|
4卷引用:安徽省池州市贵池区2021-2022学年高一上学期期中考试化学试题
安徽省池州市贵池区2021-2022学年高一上学期期中考试化学试题(已下线)期中测试卷-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)(已下线)期中测试卷一【测试范围:第一、二章】-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)四川省南充市嘉陵区四川省南充市嘉陵第一中学2023-2024学年高一上学期11月期中考试化学试题
10 . 近期学习了物质的分类及转化,请用所学习的知识试写出三种制取 的方法,并用化学方程式表示,并标明反应类型(填四种基本反应类型或氧化还原反应)。
的方法,并用化学方程式表示,并标明反应类型(填四种基本反应类型或氧化还原反应)。
(1)___________ 反应类型___________
(2)___________ 反应类型___________
(3)___________ 反应类型___________
 的方法,并用化学方程式表示,并标明反应类型(填四种基本反应类型或氧化还原反应)。
的方法,并用化学方程式表示,并标明反应类型(填四种基本反应类型或氧化还原反应)。(1)
(2)
(3)
您最近一年使用:0次



