名校
解题方法
1 . 化学让生活更美好,各类水处理剂能让水质得到提升达到饮用水的标准。生活中较常见的水处理剂有:氯气、次氯酸钠、漂白粉(主要成分为次氯酸钙)、二氧化氯、明矾、硫酸铁、高铁酸钠等等。
(1)氯气常用于自来水的消毒,请写出舍勒研究软锰矿时发现氯气的化学方程式:___________ 。
(2)氯气能用于制备易于保存、使用方便的漂白液,但若温度过高会发生副反应生成NaCl、NaClO3。请写出在加热时,当NaOH与Cl2反应生成的n(NaClO):n(NaClO3)=5:1时,NaOH与Cl2反应的化学方程式:___________ 。
(3)下列有关水资源及水质净化的说法,不正确的是___________(填序号)。
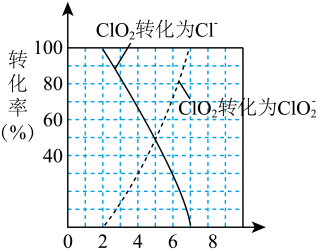
(4)近年来有科学家提出,氯气消毒时,会与水中的有机物发生反应,生成的有机氯化物可能对人体有害。因此,人们已开始研究并试用新的自来水消毒剂,如二氧化氯(ClO2)、臭氧等。ClO2被世界卫生组织(WHO)列为A级高效、安全灭菌消毒剂,将逐渐取代Cl2成为自来水的消毒剂。ClO2气体具有强氧化性,其还原产物ClO 、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:
、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:___________ 。某工厂污水中含CN﹣amg/L,现用ClO2将CN﹣氧化,生成了两种无毒无害的气体,处理50m3这种污水,至少需要ClO2___________ mol。
(5)高铁酸钠(Na2FeO4)在水中既能消毒杀菌,其产物Fe(OH)3胶体又能净水除去悬浮杂质,是一种理想的水处理剂。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,Cl2、ClO2(pH≤2时)、Na2FeO4三种消毒杀菌剂的消毒效率由大到小的顺序是___________ 。
(1)氯气常用于自来水的消毒,请写出舍勒研究软锰矿时发现氯气的化学方程式:
(2)氯气能用于制备易于保存、使用方便的漂白液,但若温度过高会发生副反应生成NaCl、NaClO3。请写出在加热时,当NaOH与Cl2反应生成的n(NaClO):n(NaClO3)=5:1时,NaOH与Cl2反应的化学方程式:
(3)下列有关水资源及水质净化的说法,不正确的是___________(填序号)。
| A.将自来水煮沸烧开后再饮用更健康、因为能除去残留的Cl2及溶于其中的Cl﹣ |
| B.自来水用于洗涤后得到的含磷污水是很好的肥料,可灌溉庄稼,能直接排放到自然界水体中 |
| C.煤、石油的燃烧和汽车排放的尾气都会引起大气污染,且会出现酸雨等环境问题 |
| D.纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子有较强的物理吸附 |
 、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:
、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:(5)高铁酸钠(Na2FeO4)在水中既能消毒杀菌,其产物Fe(OH)3胶体又能净水除去悬浮杂质,是一种理想的水处理剂。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,Cl2、ClO2(pH≤2时)、Na2FeO4三种消毒杀菌剂的消毒效率由大到小的顺序是

您最近一年使用:0次
名校
解题方法
2 . 如图是部分短周期金属及非金属元素的化合价与原子序数的关系图,R元素最高价氧化物对应的水化物表示为HmROn,下列说法正确的是


| A.元素L、M、T为金属元素,都只能形成一种氧化物 |
| B.一定条件下,X的单质能与R的最高价氧化物对应的水化物HmROn反应 |
| C.RO2通入足量的Fe(NO3)3稀溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,说明氧化性:HNO3>稀HmROn>Fe3+ |
| D.根据金属活动性顺序可知,金属单质Fe与L、M单质类似,都可以与酸反应生成H2和相应的盐,并在一定条件下可以与水反应生成H2和相应的碱 |
您最近一年使用:0次
名校
3 . 针对下列实验现象的结论或解释正确的是
| 选项 | 操作及现象 | 结论或解释 |
| A | 用洁净铂丝蘸取某溶液进行焰色试验,火焰呈黄色 | 该溶液是钠盐 |
| B | 用镊子从煤油中取出钠,切一小块,银白色迅速变暗 | 钠和氧气反应生成的Na2O为黑色 |
| C | 向碳酸钠溶液中通入二氧化碳气体,无明显现象 | 该过程没有发生化学反应 |
| D | 向包裹着Na2O2的脱脂棉吹气,棉花燃烧 | 该反应放出大量的热和氧气 |
A. | B. | C. | D. |
您最近一年使用:0次
名校
解题方法
4 . 下面是有关钠及其化合物性质的探究实验。
(1)金属钠的密度比水___ (填“大”或“小”),实验室中金属钠通常保存在___ 中,取一小块金属钠投入水中,写出该反应的离子方程式___ 。
(2)取Na2O2固体放入试管中,加适量水,有气体放出,写出该反应的离子方程式___ ,继续向上述试管中滴入1〜2滴酚酞溶液,可观察到的现象是___ 。
(1)金属钠的密度比水
(2)取Na2O2固体放入试管中,加适量水,有气体放出,写出该反应的离子方程式
您最近一年使用:0次
名校
解题方法
5 . 回答下列问题:
I.
(1)已知拆开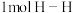 键、
键、 键、
键、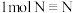 键分别需要的能量时
键分别需要的能量时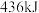 、
、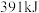 、
、 (以上数据均为物质处于气态测得),则
(以上数据均为物质处于气态测得),则 与
与 反应生成
反应生成 的热化学方程式为
的热化学方程式为______
(2)氮氧化合物是造成光化学烟雾的主要气体。已知:
① 平衡常数:
平衡常数: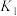
② 平衡常数:
平衡常数: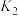
则反应 的
的
______ (用 表示);平衡常数为
表示);平衡常数为
______ (用 表示)。
表示)。
II.化学小组用滴定法测定 溶液物质的量浓度:取
溶液物质的量浓度:取 草酸晶体(
草酸晶体( ,摩尔质量
,摩尔质量 )溶于水配成
)溶于水配成 溶液,取
溶液,取 溶液置于锥形瓶中,加入适量稀
溶液置于锥形瓶中,加入适量稀 酸化,再用
酸化,再用 溶液滴定至终点,重复滴定三次,平均消耗
溶液滴定至终点,重复滴定三次,平均消耗 溶液
溶液 。发生的反应为:
。发生的反应为: 。
。

(3)实验中所需的定量仪器有_______ (填仪器名称)。
(4)如图中显示滴定终点时的度数是______  。
。
(5)滴定到达终点的现象是:当滴入最后半滴 溶液时,刚好使锥形瓶中的溶液
溶液时,刚好使锥形瓶中的溶液____ ,且半分钟内不变色时,即到终点,停止滴定。
(6)该 溶液的物质的量浓度为
溶液的物质的量浓度为______  。
。
(7)若出现下列情况,测定 溶液的物质的量浓度偏高的是____
溶液的物质的量浓度偏高的是____
I.
(1)已知拆开
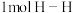 键、
键、 键、
键、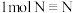 键分别需要的能量时
键分别需要的能量时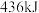 、
、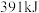 、
、 (以上数据均为物质处于气态测得),则
(以上数据均为物质处于气态测得),则 与
与 反应生成
反应生成 的热化学方程式为
的热化学方程式为(2)氮氧化合物是造成光化学烟雾的主要气体。已知:
①
 平衡常数:
平衡常数: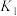
②
 平衡常数:
平衡常数: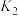
则反应
 的
的
 表示);平衡常数为
表示);平衡常数为
 表示)。
表示)。II.化学小组用滴定法测定
 溶液物质的量浓度:取
溶液物质的量浓度:取 草酸晶体(
草酸晶体( ,摩尔质量
,摩尔质量 )溶于水配成
)溶于水配成 溶液,取
溶液,取 溶液置于锥形瓶中,加入适量稀
溶液置于锥形瓶中,加入适量稀 酸化,再用
酸化,再用 溶液滴定至终点,重复滴定三次,平均消耗
溶液滴定至终点,重复滴定三次,平均消耗 溶液
溶液 。发生的反应为:
。发生的反应为: 。
。
(3)实验中所需的定量仪器有
(4)如图中显示滴定终点时的度数是
 。
。(5)滴定到达终点的现象是:当滴入最后半滴
 溶液时,刚好使锥形瓶中的溶液
溶液时,刚好使锥形瓶中的溶液(6)该
 溶液的物质的量浓度为
溶液的物质的量浓度为 。
。(7)若出现下列情况,测定
 溶液的物质的量浓度偏高的是____
溶液的物质的量浓度偏高的是____| A.滴定前用蒸馏水冲洗锥形瓶 |
B.装 溶液的滴定管用蒸馏水洗后,未润洗 溶液的滴定管用蒸馏水洗后,未润洗 |
C.若在滴定过程中不慎将数滴 溶液滴在锥形瓶外 溶液滴在锥形瓶外 |
D.装 溶液的滴定管滴至终点时俯视读数 溶液的滴定管滴至终点时俯视读数 |
您最近一年使用:0次
名校
6 . 常温下,下列有关电解质溶液的叙述错误的是
A.将 的 的 溶液加水稀释后,由水电离产生的 溶液加水稀释后,由水电离产生的 保持不变 保持不变 |
| B.若电离平衡正向移动,但弱电解质的电离度不一定增大 |
C.用 试纸测 试纸测 值时在使用之前不能用蒸馏水润湿 值时在使用之前不能用蒸馏水润湿 |
D.某 溶液中 溶液中 ,由水电离出的 ,由水电离出的 |
您最近一年使用:0次
2021-12-21更新
|
106次组卷
|
2卷引用:重庆市万州第二高级中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
7 . “碳中和”是当代新兴的一种环保形式,其中“碳中和”形式中的一个重要反应是
 。某化学实验小组在容积为
。某化学实验小组在容积为 的密闭容器甲中,加入
的密闭容器甲中,加入 的
的 和
和 的
的 ,在催化剂存在和
,在催化剂存在和 的条件下加热,发生上述反应,反应中
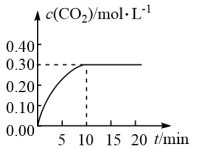
的条件下加热,发生上述反应,反应中 的浓度随时间变化情况如下图:
的浓度随时间变化情况如下图:
(1)已知
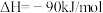

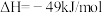
则反应:

___________ 
(2)下列能够判定容器甲中可逆反应达到平衡的标志是___________
(3)根据上图数据,计算 时间段内
时间段内 的化学反应速率
的化学反应速率
___________  ;
;
(4)当反应达到平衡后,若将容器甲升温至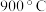 ,平衡将会
,平衡将会___________ 移动(填“向正反应方向”、“向逆反应方向”或“不”);再次达到平衡时该反应的化学平衡常数
___________ 1(填“ ”、“
”、“ ”或“
”或“ ”);
”);
(5)在催化剂存在和 的条件下,在另一容器乙中,某时刻测得各物质的浓度为:
的条件下,在另一容器乙中,某时刻测得各物质的浓度为: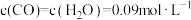 、
、 ,则此时正、逆反应速率的大小
,则此时正、逆反应速率的大小
___________  (填“
(填“ ”、“
”、“ ”或“
”或“ ”);
”);
(6)若 下容器甲达到平衡后,再充入
下容器甲达到平衡后,再充入 的水蒸气,重新达到平衡时,
的水蒸气,重新达到平衡时, 的转化率
的转化率___________ (填“增大”、“减小”或“不变”), 的浓度
的浓度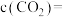
___________  。
。

 。某化学实验小组在容积为
。某化学实验小组在容积为 的密闭容器甲中,加入
的密闭容器甲中,加入 的
的 和
和 的
的 ,在催化剂存在和
,在催化剂存在和 的条件下加热,发生上述反应,反应中
的条件下加热,发生上述反应,反应中 的浓度随时间变化情况如下图:
的浓度随时间变化情况如下图:
(1)已知

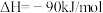

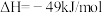
则反应:



(2)下列能够判定容器甲中可逆反应达到平衡的标志是___________
A. 的消耗速率等于 的消耗速率等于 的生成速率 的生成速率 | B.混合气体的平均密度不再变化 |
| C.密闭容器内的总压强不再变化 | D.密闭容器内的 键数目不再变化 键数目不再变化 |
 时间段内
时间段内 的化学反应速率
的化学反应速率
 ;
;(4)当反应达到平衡后,若将容器甲升温至
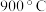 ,平衡将会
,平衡将会
 ”、“
”、“ ”或“
”或“ ”);
”);(5)在催化剂存在和
 的条件下,在另一容器乙中,某时刻测得各物质的浓度为:
的条件下,在另一容器乙中,某时刻测得各物质的浓度为: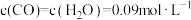 、
、 ,则此时正、逆反应速率的大小
,则此时正、逆反应速率的大小
 (填“
(填“ ”、“
”、“ ”或“
”或“ ”);
”);(6)若
 下容器甲达到平衡后,再充入
下容器甲达到平衡后,再充入 的水蒸气,重新达到平衡时,
的水蒸气,重新达到平衡时, 的转化率
的转化率 的浓度
的浓度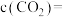
 。
。
您最近一年使用:0次
2021-12-13更新
|
353次组卷
|
2卷引用:重庆市育才中学2021-2022学年度高二上学期期中测试化学试题
名校
8 . 已知 时,部分弱酸的电离常数
时,部分弱酸的电离常数 如下表所示:
如下表所示:
回答下列问题:
(1)四种酸 、
、 、
、 、
、 的酸性从强到弱的顺序是
的酸性从强到弱的顺序是___________ ;
(2) 时,将
时,将 溶液和
溶液和 溶液等体积混合,所得溶液呈
溶液等体积混合,所得溶液呈___________ (填“酸”、“中”或“碱”)性;相对于纯水体系而言,所得溶液中水的电离程度受到___________ (填“促进”、“抑制”或“既不促进也不抑制”)。
(3) 时,向
时,向 的
的 溶液中逐滴加入
溶液中逐滴加入 溶液,得到的混合溶液呈酸性。
溶液,得到的混合溶液呈酸性。
①写出混合溶液中的电荷守恒式___________ ;
②比较混合溶液中的离子浓度大小___________ ;
③针对该混合溶液,下列说法正确的是___________
A.混合溶液中虽然呈酸性,但仍存在
B.若向混合溶液中继续滴加蒸馏水,溶液酸性会减弱, 的数值会增大
的数值会增大
C.混合溶液存在
D.若想要混合溶液呈中性,则可继续向混合溶液中加入 溶液
溶液
(4)若向 溶液中通入少量
溶液中通入少量 气体,写出发生反应的离子方程式
气体,写出发生反应的离子方程式___________ 。
 时,部分弱酸的电离常数
时,部分弱酸的电离常数 如下表所示:
如下表所示:| 弱酸 |  |  |  |  |
电离常数 | 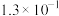 |  |  | 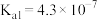  |
回答下列问题:
(1)四种酸
 、
、 、
、 、
、 的酸性从强到弱的顺序是
的酸性从强到弱的顺序是(2)
 时,将
时,将 溶液和
溶液和 溶液等体积混合,所得溶液呈
溶液等体积混合,所得溶液呈(3)
 时,向
时,向 的
的 溶液中逐滴加入
溶液中逐滴加入 溶液,得到的混合溶液呈酸性。
溶液,得到的混合溶液呈酸性。①写出混合溶液中的电荷守恒式
②比较混合溶液中的离子浓度大小
③针对该混合溶液,下列说法正确的是
A.混合溶液中虽然呈酸性,但仍存在

B.若向混合溶液中继续滴加蒸馏水,溶液酸性会减弱,
 的数值会增大
的数值会增大C.混合溶液存在

D.若想要混合溶液呈中性,则可继续向混合溶液中加入
 溶液
溶液(4)若向
 溶液中通入少量
溶液中通入少量 气体,写出发生反应的离子方程式
气体,写出发生反应的离子方程式
您最近一年使用:0次
2021-12-10更新
|
318次组卷
|
2卷引用:重庆市育才中学2021-2022学年度高二上学期期中测试化学试题
9 . 已知硫酸亚铁铵晶体[ ,摩尔质量为
,摩尔质量为 ]可用作净水剂、颜料、媒染剂、鞣革、防腐剂等,它在空气中不易被氧化,易溶于水,不溶于乙醇。回答下列问题:
]可用作净水剂、颜料、媒染剂、鞣革、防腐剂等,它在空气中不易被氧化,易溶于水,不溶于乙醇。回答下列问题:
Ⅰ、制备过程
步骤1:制备硫酸亚铁溶液:将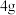 铁粉和
铁粉和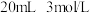 硫酸置于锥形瓶中,保证溶液
硫酸置于锥形瓶中,保证溶液 。水浴加热至几乎不产生气泡,趁热过滤掉残余的少量铁粉。
。水浴加热至几乎不产生气泡,趁热过滤掉残余的少量铁粉。
步骤2:获得硫酸亚铁铵晶体:向滤液中加入一定量的硫酸铵溶液,然后蒸发浓缩、冷却结晶、过滤、洗涤、晾干。
(1)步骤1中,加入过量铁粉的目的是___________ ;由于加入的铁粉不纯,反应过程中会产生少量 ,可以用
,可以用 溶液进行吸收处理,发生的反应为:
溶液进行吸收处理,发生的反应为: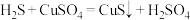 ,试从沉淀溶解平衡的角度解释
,试从沉淀溶解平衡的角度解释 沉淀生成的原因:
沉淀生成的原因:___________ 。
(2)步骤2中,所用到的硫酸铵溶液呈酸性,原因是___________ (用离子方程式表示);
Ⅱ、定量分析——氧化还原滴定法
称取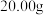 制得的硫酸亚铁铵晶体溶于稀硫酸,加水配制成
制得的硫酸亚铁铵晶体溶于稀硫酸,加水配制成 溶液,取
溶液,取 于锥形瓶中,然后用
于锥形瓶中,然后用 的酸性高锰酸钾溶液进行滴定。
的酸性高锰酸钾溶液进行滴定。
(3)滴定过程中高锰酸钾溶液应装在___________ 仪器中;(填“ ”或“
”或“ ”)
”)

(4)滴定过程中,酸性高锰酸钾溶液将 氧化为
氧化为 ,发生的离子方程式为
,发生的离子方程式为___________ ;
(5)如何判断滴定终点___________ ;
(6)若进行平行滴定三次,消耗 溶液的体积如下表所示:
溶液的体积如下表所示:
则制得的硫酸亚铁铵晶体纯度(质量分数)为___________ (用百分数表示,保留四位有效数字);
(7)上表中第一次的数据大于后两次的数据,其原因可能是___________
 ,摩尔质量为
,摩尔质量为 ]可用作净水剂、颜料、媒染剂、鞣革、防腐剂等,它在空气中不易被氧化,易溶于水,不溶于乙醇。回答下列问题:
]可用作净水剂、颜料、媒染剂、鞣革、防腐剂等,它在空气中不易被氧化,易溶于水,不溶于乙醇。回答下列问题:Ⅰ、制备过程
步骤1:制备硫酸亚铁溶液:将
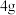 铁粉和
铁粉和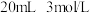 硫酸置于锥形瓶中,保证溶液
硫酸置于锥形瓶中,保证溶液 。水浴加热至几乎不产生气泡,趁热过滤掉残余的少量铁粉。
。水浴加热至几乎不产生气泡,趁热过滤掉残余的少量铁粉。步骤2:获得硫酸亚铁铵晶体:向滤液中加入一定量的硫酸铵溶液,然后蒸发浓缩、冷却结晶、过滤、洗涤、晾干。
(1)步骤1中,加入过量铁粉的目的是
 ,可以用
,可以用 溶液进行吸收处理,发生的反应为:
溶液进行吸收处理,发生的反应为: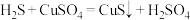 ,试从沉淀溶解平衡的角度解释
,试从沉淀溶解平衡的角度解释 沉淀生成的原因:
沉淀生成的原因:(2)步骤2中,所用到的硫酸铵溶液呈酸性,原因是
Ⅱ、定量分析——氧化还原滴定法
称取
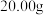 制得的硫酸亚铁铵晶体溶于稀硫酸,加水配制成
制得的硫酸亚铁铵晶体溶于稀硫酸,加水配制成 溶液,取
溶液,取 于锥形瓶中,然后用
于锥形瓶中,然后用 的酸性高锰酸钾溶液进行滴定。
的酸性高锰酸钾溶液进行滴定。(3)滴定过程中高锰酸钾溶液应装在
 ”或“
”或“ ”)
”)
(4)滴定过程中,酸性高锰酸钾溶液将
 氧化为
氧化为 ,发生的离子方程式为
,发生的离子方程式为(5)如何判断滴定终点
(6)若进行平行滴定三次,消耗
 溶液的体积如下表所示:
溶液的体积如下表所示:| 实验次数 | 第一次 | 第二次 | 第三次 |
消耗 溶液的体积/ 溶液的体积/ | 24.52 | 24.02 | 23.98 |
(7)上表中第一次的数据大于后两次的数据,其原因可能是___________
| A.第一次滴定前滴定管尖嘴有气泡,滴定后气泡消失; |
| B.第一次滴定用的锥形瓶用待测液润洗过 |
| C.第一次滴定结束时,俯视读取酸性高锰酸钾溶液的体积 |
| D.第一次滴定结束时,有一滴酸性高锰酸钾溶液悬挂在滴定管尖嘴处 |
您最近一年使用:0次
名校
10 . 1836年丹尼尔发明了世界上第一个实用电池,下图是实验室模拟原电池原理组装的丹尼尔电池,盐桥中装有饱和 溶液的琼胶,回答下列问题。
溶液的琼胶,回答下列问题。
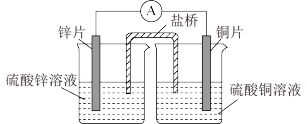
(1)上图装置中能量的转化形式为___________ 能转化为___________ 能;
(2)在该原电池中,___________ 是负极材料(填“锌片”或“铜片”),铜片一极发生___________ 反应(填“氧化”或“还原”);
(3)当该原电池开始工作时,盐桥中的 的移动方向是
的移动方向是___________ (请在下列选项中选择)
A. 流向硫酸锌溶液 B. 流向硫酸铜溶液
(4)该原电池的正极电极反应式为___________ ;当电路中转移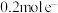 时,锌片溶解的质量为
时,锌片溶解的质量为___________  。
。
 溶液的琼胶,回答下列问题。
溶液的琼胶,回答下列问题。
(1)上图装置中能量的转化形式为
(2)在该原电池中,
(3)当该原电池开始工作时,盐桥中的
 的移动方向是
的移动方向是A. 流向硫酸锌溶液 B. 流向硫酸铜溶液
(4)该原电池的正极电极反应式为
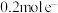 时,锌片溶解的质量为
时,锌片溶解的质量为 。
。
您最近一年使用:0次
2021-12-09更新
|
890次组卷
|
5卷引用:重庆市育才中学2021-2022学年度高二上学期期中测试化学试题
重庆市育才中学2021-2022学年度高二上学期期中测试化学试题(已下线)第四单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)黑龙江省绥化市庆安县第一中学2022-2023学年高二上学期期中考试化学试题黑龙江省绥化市庆安县第一中学2022-2023学年高二上学期期中考试化学试题新疆哈密市第八中学2021-2022学年高二上学期期末考试化学试题



