名校
解题方法
1 . 向一个容积为2 L的密闭容器中充入4 mol/LA和6 mol/LB,在恒温恒容下发生反应:4A(g)+6B(g) 4C(g)+xD(g),经5 min后达到平衡状态,测得A的浓度为2 mol/L、测得D的化学反应速率为0.4 mol/(L•min)。
4C(g)+xD(g),经5 min后达到平衡状态,测得A的浓度为2 mol/L、测得D的化学反应速率为0.4 mol/(L•min)。
(1)到达平衡前v正_____ v逆(填“>”或者“<”),到达平衡后v正_____ v逆(填“>”、“<”或者“=”)。
(2)增大压强反应速率_____ (填“加快”或者“减慢”),降低温度反应速率_____ (填“加快”或者“减慢”)。
(3)反应开始至平衡时,C的浓度增加了_____ ,以B的浓度变化表示该反应的平均速率v(B)=_____ 。
(4)到达平衡后A的转化率为_____ 。
(5)D的化学计量数x为_____ 。
(6)该条件下反应一段时间,下列能说明反应达到平衡状态的是_____ 。
(7)随着反应的进行发现正反应速率逐渐减小,其原因是_____ 。
(8)反应前与到达平衡后的压强之比为_____ 。
 4C(g)+xD(g),经5 min后达到平衡状态,测得A的浓度为2 mol/L、测得D的化学反应速率为0.4 mol/(L•min)。
4C(g)+xD(g),经5 min后达到平衡状态,测得A的浓度为2 mol/L、测得D的化学反应速率为0.4 mol/(L•min)。(1)到达平衡前v正
(2)增大压强反应速率
(3)反应开始至平衡时,C的浓度增加了
(4)到达平衡后A的转化率为
(5)D的化学计量数x为
(6)该条件下反应一段时间,下列能说明反应达到平衡状态的是
| A.气体的密度保持不变 | B.气体的压强保持不变的状态 |
| C.4v正(A)=6v逆(B) | D.B与C浓度保持不变的状态 |
(8)反应前与到达平衡后的压强之比为
您最近一年使用:0次
2022-12-20更新
|
241次组卷
|
2卷引用:四川省成都东部新区养马中学2020-2021学年高一下学期期中考试化学试题
2 . 化学在环境、生产和生活中有着广泛的应用,下列说法中不正确的是
| A.化学反应一定伴随能量变化 |
| B.普通锌锰干电池不含环境污染物,可以随意丢弃 |
| C.门捷列夫制作了第一张元素周期表 |
| D.目前中国仍然以火力发电为主,火力发电效能低污染大,我们应尽快开发出新能源 |
您最近一年使用:0次
3 . 回答下列问题:
(1)配平并用“双线桥”表示“KMnO4 +H2C2O4+H2SO4→K2SO4 +MnSO4 +CO2↑+H2O”电子转移的方向和数目:__________________ 。
(2)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑,被还原的元素是______ ,当生成标准状况下33.6L的N2时,转移电子的数目为______ 。
(3)在肉制品加工中,使用的护色剂——亚硝酸钠(NaNO2)必须严格控制用量,以确保食用安全。若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒、解毒过程的说法中,正确的是 。
(4)在反应2H2S + SO2 = 3S↓ + 2H2O中,氧化产物与还原产物的物质的量之比为______ 。
(5)在强酸性溶液中可发生如下反应:2Mn2++5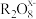 +8H2O=16H++10
+8H2O=16H++10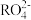 +2
+2 ,这个反应可定性地检验Mn2+的存在。在反应中充当氧化剂的
,这个反应可定性地检验Mn2+的存在。在反应中充当氧化剂的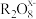 中,x的值是
中,x的值是______ 。
(1)配平并用“双线桥”表示“KMnO4 +H2C2O4+H2SO4→K2SO4 +MnSO4 +CO2↑+H2O”电子转移的方向和数目:
(2)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑,被还原的元素是
(3)在肉制品加工中,使用的护色剂——亚硝酸钠(NaNO2)必须严格控制用量,以确保食用安全。若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒、解毒过程的说法中,正确的是 。
| A.亚硝酸钠是还原剂 | B.维生素C是氧化剂 |
| C.亚硝酸钠被还原 | D.维生素C能把铁离子还原成为亚铁离子 |
(5)在强酸性溶液中可发生如下反应:2Mn2++5
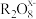 +8H2O=16H++10
+8H2O=16H++10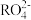 +2
+2 ,这个反应可定性地检验Mn2+的存在。在反应中充当氧化剂的
,这个反应可定性地检验Mn2+的存在。在反应中充当氧化剂的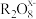 中,x的值是
中,x的值是
您最近一年使用:0次
2022-12-20更新
|
117次组卷
|
2卷引用:四川省遂宁卓同国际学校2021-2022学年高一上学期期中考试化学试题
名校
4 . 有以下几种物质∶①液态HI ②硫酸氢钠溶液 ③亚硫酸 ④蔗糖 ⑤乙醇 ⑥氯水 ⑦NH3 ⑧氨水 ⑨碳酸氢钠 ⑩稀硫酸
(1)属于电解质的是_______ ,属于弱电解质的是_______ ,能导电的是_______ 。
(2)碳酸氢钠的电离方程式为_______ ,硫酸氢钠在熔融状态下的电离方程式_______ 。
(3)常温下,当①③⑩三种酸溶液的物质的量浓度相同时,c(H+)由大到小的顺序是_______ ;若①③⑩三种酸溶液的pH相等,则中和等体积等物质的量浓度的氢氧化钠溶液,所需酸溶液的体积由大到小的顺序是_______ 。
(4)已知298K时,NH3·H2O的电离平衡常数为Kb=1.8×10-5,求0.1mo/L氨水的c(OH-)=_______ mol/L。(注∶平衡时的NH3·H2O浓度可近似等于0.1mol/L, 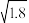 =1.34)
=1.34)
(1)属于电解质的是
(2)碳酸氢钠的电离方程式为
(3)常温下,当①③⑩三种酸溶液的物质的量浓度相同时,c(H+)由大到小的顺序是
(4)已知298K时,NH3·H2O的电离平衡常数为Kb=1.8×10-5,求0.1mo/L氨水的c(OH-)=
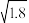 =1.34)
=1.34)
您最近一年使用:0次
2022-12-03更新
|
88次组卷
|
2卷引用:四川省邻水实验学校2021-2022学年高二上学期期中考试化学试题
解题方法
5 . 中国政府承诺“努力争取2060年前实现碳中和”,“碳中和”是使碳排放与碳吸收达平衡,实现二氧化碳相对“零排放”。为了实现碳中和,从实际出发,以下措施不可行的是
| A.鼓励拼车或乘坐公共交通出行 |
| B.推广垃圾分类处理,加强资源回收利用 |
| C.禁止使用煤、石油等化石能源 |
| D.采用物理或化学方法,捕集或吸收废气中的二氧化碳 |
您最近一年使用:0次
6 . 用所学知识填写下列空白:(填代号)
(1)下列物质:①金属铜 ②固态NaCl ③O2 ④盐酸 ⑤石墨 ⑥酒精水溶液 ⑦KOH水溶液 ⑧熔融状态的KNO3 ⑨葡萄糖。属于电解质的是_________ ;属于非电解质是_________ ;能导电的是_________ 。
(2)已知t℃时,Kw=1×10-12,则在t℃时将pH=11Ba(OH)2溶液a L与pH=1的HCl溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=_________ 。
(3)现有三种一元酸HA、HB、HC在相同温度下他们的电离平衡常数依次为K1=3.53×10-4,K2=2.95×10-8,K3=4.93×10-10。那么1 mol/L的HA、HB、HC的水溶液的pH由小到大的顺序是_________ 。
(4)常温下,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的c(OHˉ)分别为a mol·L-1与b mol·L-1,则a与b的比值为_________ 。
(1)下列物质:①金属铜 ②固态NaCl ③O2 ④盐酸 ⑤石墨 ⑥酒精水溶液 ⑦KOH水溶液 ⑧熔融状态的KNO3 ⑨葡萄糖。属于电解质的是
(2)已知t℃时,Kw=1×10-12,则在t℃时将pH=11Ba(OH)2溶液a L与pH=1的HCl溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=
(3)现有三种一元酸HA、HB、HC在相同温度下他们的电离平衡常数依次为K1=3.53×10-4,K2=2.95×10-8,K3=4.93×10-10。那么1 mol/L的HA、HB、HC的水溶液的pH由小到大的顺序是
(4)常温下,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的c(OHˉ)分别为a mol·L-1与b mol·L-1,则a与b的比值为
您最近一年使用:0次
解题方法
7 . 已知反应:FeO(s)+CO(g)  Fe(s)+CO2(g) ΔH>0。
Fe(s)+CO2(g) ΔH>0。
(1)此反应的平衡常数表达式为K=_______ 。
(2)温度降低,则K值_______ (填“增大”“减小”或“不变”)。
(3)已知1100℃时,K=0.263,此时测得c(CO2)=0.025 mol/L,c(CO)=0.1 mol/L,此时该反应_______ (填“处于”或“不处于”)化学平衡状态,化学反应速率:正反应速率_______ (填“>”“<”或“=”)逆反应速率,其原因是_______ 。
(4)分析下列反应,在任何温度下均能自发进行的是_______
 Fe(s)+CO2(g) ΔH>0。
Fe(s)+CO2(g) ΔH>0。(1)此反应的平衡常数表达式为K=
(2)温度降低,则K值
(3)已知1100℃时,K=0.263,此时测得c(CO2)=0.025 mol/L,c(CO)=0.1 mol/L,此时该反应
(4)分析下列反应,在任何温度下均能自发进行的是_______
A.2N2(g)+O2(g)  2N2O(g) ΔH= +163 kJ/mol 2N2O(g) ΔH= +163 kJ/mol |
B.Ag(s)+ Cl2(g) Cl2(g)  AgCl(s) ΔH= -127 kJ/mol AgCl(s) ΔH= -127 kJ/mol |
C.HgO(s)  Hg(1)+ Hg(1)+ O2(g) ΔH= +91 kJ/mol O2(g) ΔH= +91 kJ/mol |
D.H2O2(1)   O2(g)+H2O(1) ΔH= -98 kJ/mol O2(g)+H2O(1) ΔH= -98 kJ/mol |
您最近一年使用:0次
8 . 胶体与人类生活有密切的关系,下列现象不能用胶体知识解答的是


| A.江河入海口处易形成三角洲 |
| B.树林中出现的晨曦(如图) |
| C.AlCl3溶液中滴加NaOH溶液先出现白色沉淀然后溶解 |
| D.针对严重肾病患者的血液透析治疗 |
您最近一年使用:0次
解题方法
9 . 混合物的分离提纯在生产生活中有着重要的意义。已知某工业废水中含有大量FeSO4,还含有较多的Cu2+、Na+以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及固体单质。

(1)步骤1的操作是_______ ,试剂X是_______ 。
(2)分别写出步骤2的化学方程式_______ ,反应类型_______ ,步骤3的化学方程式_______ ,反应类型_______ 。
(3)步骤4所涉及的操作是蒸发浓缩、_______ 、过滤、洗涤、干燥。
(4)洗涤固体单质的目的是洗去固体表面带有的少量溶液,通过检验洗涤液中是否还含有溶液中的离子,即可得知固体是否已经洗涤干净。设计实验检验步骤3所得的固体单质是否已经洗涤干净了:取最后一次洗涤液于试管中,_______
(5)根据下图分析为避免溶液中的Na+对回收的FeSO4·7H2O晶体的纯度产生影响,应该将溶液温度控制在_______ 以上。

(6)若步骤2中加入的Fe质量为11.2 kg,步骤3中固体混合物质量减少5.6 kg,则该流程回收的铜单质的质量为_______ 。

(1)步骤1的操作是
(2)分别写出步骤2的化学方程式
(3)步骤4所涉及的操作是蒸发浓缩、
(4)洗涤固体单质的目的是洗去固体表面带有的少量溶液,通过检验洗涤液中是否还含有溶液中的离子,即可得知固体是否已经洗涤干净。设计实验检验步骤3所得的固体单质是否已经洗涤干净了:取最后一次洗涤液于试管中,
(5)根据下图分析为避免溶液中的Na+对回收的FeSO4·7H2O晶体的纯度产生影响,应该将溶液温度控制在

(6)若步骤2中加入的Fe质量为11.2 kg,步骤3中固体混合物质量减少5.6 kg,则该流程回收的铜单质的质量为
您最近一年使用:0次
解题方法
10 . 下列判断正确的是
| A.因为共价键有饱和性和方向性,所以原子晶体不遵循“紧密堆积”原理 |
| B.稳定性按 HF、HCl、HBr、HI 逐渐减弱,根本原因是 F、Cl、Br、I 非金属性减弱 |
| C.晶体中一定存在化学键,金属晶体熔点一定很高 |
| D.固体 SiO2 一定是晶体 |
您最近一年使用:0次



