1 . 某烃与H2反应后能生成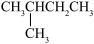 ,则该烃不可能是
,则该烃不可能是
A.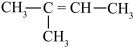 | B.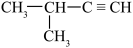 |
C.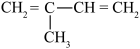 | D.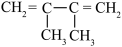 |
| A.它的元素符号为O |
| B.它的核外电子排布式为1s22s22p63s23p4 |
| C.可以与H2化合生成液态化合物 |
D.其电子排布图为 |
A. mol⋅L mol⋅L 的溶液 的溶液 |
B. 的溶液 的溶液 |
| C.使石蕊试液呈紫色的溶液 |
| D.酸与碱恰好完全反应生成正盐的溶液 |
(1)如图为氢氧燃料电池的构造示意图,根据电子运动方向,可知氧气从
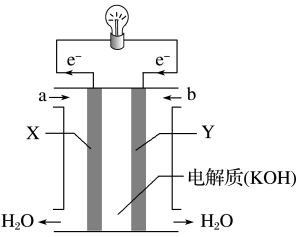
A极:2H2+2O2--4e-=2H2O
B极:O2+4e-=2O2-
则A极是电池的
(3)微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为:
Zn+2OH-2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH-
总反应为Ag2O+Zn=ZnO+2Ag
①Zn是
②电子由
③在使用过程中,电解质溶液中KOH的物质的量
(1)溶液①呈酸性的原因是
(2)溶液③的电离方程式为
(3)在上述①、②、 ③、④溶液中c (
 )浓度由大到小的顺序是
)浓度由大到小的顺序是(4)25℃时,将pH=9的NaOH溶液与p=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(5)25℃时,向0.1mol/L FeCl3溶液中加入④溶液,若Fe(OH)3的Ksp=1×10-39,当铁离子恰好完全沉淀时[当c(Fe3+)小于10-6mol/L时,可忽略不计],溶液的pH=
6 . I.已知A、B、C、D、E、F、G、H8种短周期元素的原子半径和某些化合价如下表所示:
元素 | A | B | C | D | E | F | G | H |
化合价 | -2 | +5、-3 | +4、-4 | +6、-2 | +2 | +1 | +7、-1 | +4、-4 |
原子半径/nm | 0.073 | 0.075 | 0.077 | 0.102 | 0.130 | 0.154 | 0.099 | 0.111 |
(1)元素D在元素周期表中的位置为
 与元素
与元素 所形成的晶体属于
所形成的晶体属于(2)如图中阴影部分所示区域的元素称为

A.Ba B.Fe C.Br D.Rb
Ⅱ.现有A、B、C、D、E、F、G、H元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
A | 核外电子数和电子层数相等 |
B | 形成化合物种类最多的元素 |
C | 基态原子的核外p能级电子数比s能级电子数少1 |
D | 基态原子的核外p轨道中有两个未成对电子 |
E | 气态基态原子的第一至第四电离能分别是I1=738kJ/mol,I2=1451kJ/mol,I3=7733kJ/mol,I4=10540kJ/mol |
F | 主族序数与周期数的差为4 |
G | 前四周期中电负性最小的元素 |
H | 位于元素周期表中的第11列 |
(4)某同学推断E元素基态原子的核外电子轨道表示式如图。该同学所画的电子轨道表示式违背了
 远远大于
远远大于 ,其原因是
,其原因是
(5)D、E、F三种元素的简单离子半径由大到小的顺序是
(6)H位于元素周期表中
 位于同一周期,其原子基态时未成对电子数在同周期中最多的元素是
位于同一周期,其原子基态时未成对电子数在同周期中最多的元素是(7)写出一种由A、B、C、D四种元素组成离子化合物
7 .  是一种高效清洁的火箭燃料。
是一种高效清洁的火箭燃料。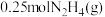 完全燃烧生成
完全燃烧生成 和
和 时,放出133.5 kJ热量。则下列热化学方程式正确的是
时,放出133.5 kJ热量。则下列热化学方程式正确的是
A.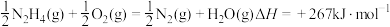 |
B. |
C. |
D.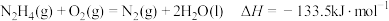 |
(1)基态碳原子的核外电子排布式为
(2)下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据。
| 元素 | I1/eV | I2/eV | I3/eV |
| 甲 | 5.7 | 47.4 | 71.8 |
| 乙 | 7.7 | 15.1 | 80.3 |
| 丙 | 13.0 | 23.9 | 40.0 |
| 丁 | 15.7 | 27.6 | 40.7 |
| A.甲的金属性比乙强 | B.乙有+1价 |
| C.丙不可能为非金属元素 | D.丁一定为金属元素 |
| 元素 | Mn | Fe | |
| 电离能/(kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(4)卤族元素F、Cl、Br、I的电负性由小到大的顺序是
(5)基态B原子的价电子轨道表示式为
 、
、 和
和 元素的前四级电离能变化趋势。下列说法正确的是
元素的前四级电离能变化趋势。下列说法正确的是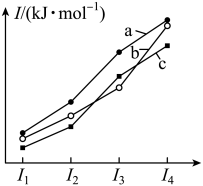
A.元素电负性: |
B.简单氢化物的稳定性: |
C.简单氢化物的相对分子质量: |
D.对应最高价氧化物的水化物的酸性强弱: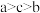 |
 进行过程中,当其他条件不变时,
进行过程中,当其他条件不变时, 的体积分数
的体积分数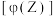 与温度
与温度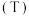 、压强
、压强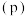 的关系如图所示。下列叙述正确的是
的关系如图所示。下列叙述正确的是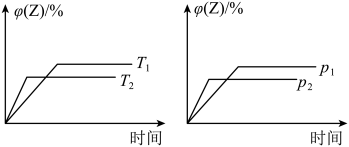
A.达到平衡后,加入催化剂, 的体积分数增大 的体积分数增大 |
| B.达到平衡后,升高温度,平衡向逆反应方向移动 |
C.化学方程式中,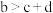 |
D.达到平衡后,增加 的量,平衡向正反应方向移动 的量,平衡向正反应方向移动 |



