名校
解题方法
1 . 下列关于各图像的解释或得出的结论不正确 的是

A.由甲图可知,反应在 时刻可能改变了压强或使用了催化剂 时刻可能改变了压强或使用了催化剂 |
| B.由乙图可知,反应在m点可能达到了平衡状态 |
C.由丙图可知,C点: |
D.由丁图可知,交点A表示反应一定处于平衡状态,此时 |
您最近一年使用:0次
2023-12-29更新
|
319次组卷
|
9卷引用:广西防城港市实验高级中学2023-2024学年高二上学期期中考试化学试题
广西防城港市实验高级中学2023-2024学年高二上学期期中考试化学试题陕西省西北工业大学附属中学2022-2023学年高一下学期期末考试化学试题(已下线)考点25 化学反应速率与平衡图象(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省永州市第一中学2023-2024学年高二上学期9月月考化学试题(已下线)广东省深圳中学2023-2024学年高二上学期11月期中考试化学试题四川省资阳市2021-2022学年高二上学期期末考试化学试题湖南省长沙市长郡梅溪湖中学2022-2023学年高二上学期第三次月考化学试题湖南省岳阳县第一中学2022-2023学年高二上学期11月期中测试化学试题河南省许昌高级中学2023-2024学年高一下学期4月月考化学试题
名校
解题方法
2 . 电子工业中,可用FeCl3-HCl溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
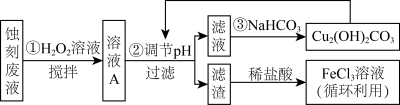
已知: Fe3+在溶液中会发生水解,当溶液呈酸性时可以抑制其水解
(1)步骤①中,为加快反应速率,除搅拌外,还可以___________ (任写一点)
(2)步骤②过滤中,用到的玻璃仪器,除烧杯外,还需要___________
(3)用FeCl3—HCl溶液刻蚀铜板时反应的离子方程式为___________ 。
(4)FeCl3蚀刻液中加入盐酸的目的是___________ 。
(5)步骤①中加入H2O2溶液的目的是(用离子方程式表示)___________ 。
(6)生成氢氧化物沉淀的pH如下表根据表中数据推测调节pH的范围是___________ 。
(7)上述流程路线中,除FeCl3溶液外,还可用于循环利用的物质是___________ 。

已知: Fe3+在溶液中会发生水解,当溶液呈酸性时可以抑制其水解
(1)步骤①中,为加快反应速率,除搅拌外,还可以
(2)步骤②过滤中,用到的玻璃仪器,除烧杯外,还需要
(3)用FeCl3—HCl溶液刻蚀铜板时反应的离子方程式为
(4)FeCl3蚀刻液中加入盐酸的目的是
(5)步骤①中加入H2O2溶液的目的是(用离子方程式表示)
(6)生成氢氧化物沉淀的pH如下表根据表中数据推测调节pH的范围是
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
(7)上述流程路线中,除FeCl3溶液外,还可用于循环利用的物质是
您最近一年使用:0次
名校
解题方法
3 . 二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0°C,浓度高时极易爆炸。某研究小组在实验室按如图所示的装置,用干燥的氯气与固体亚氯酸钠制备二氧化氯,请回答下列问题:

(1)B装置使用的试液X为___________ ,其作用是___________ 。
(2)装置E的作用是___________ 。
(3)装置D中冰水的主要作用是___________ ,往D中通入氯气的同时还通入干燥的空气,其主要目的是___________ 。
(4)装置D内发生反应的化学方程式为___________ 。
(5)工业上可在酸性条件下用双氧水与NaClO3反应制备ClO2,该反应的离子方程式为___________ 。

(1)B装置使用的试液X为
(2)装置E的作用是
(3)装置D中冰水的主要作用是
(4)装置D内发生反应的化学方程式为
(5)工业上可在酸性条件下用双氧水与NaClO3反应制备ClO2,该反应的离子方程式为
您最近一年使用:0次
4 . 丙烯是一种重要的化工原料。可在一固定容积的密闭容器中由丙烷催化脱氢制备。
(1)已知: ①C3H8(g)=C3H6(g)+H2(g) _______。
_______。
②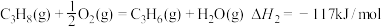
③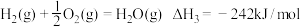
反应①的
___________ 。
(2)欲提高①反应中 的平衡转化率,可采取的措施有___________(填标号)。
的平衡转化率,可采取的措施有___________(填标号)。
(3)能表明该反应①达到平衡状态的是___________(填字母)。
(4)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为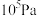 ,平衡时总压增加了20%。则达到平衡时,
,平衡时总压增加了20%。则达到平衡时, 的转化率为
的转化率为___________ 。该反应的平衡常数
___________ Pa.(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。写出该反应的化学平衡常数表达式:K=___________ ;保持恒温恒容,将反应的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡___________ (填“正向”逆向”或“不”)移动,平衡常数K___________ (填“变大”变小”或“不变”)。
(1)已知: ①C3H8(g)=C3H6(g)+H2(g)
 _______。
_______。②
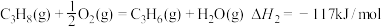
③
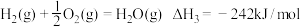
反应①的

(2)欲提高①反应中
 的平衡转化率,可采取的措施有___________(填标号)。
的平衡转化率,可采取的措施有___________(填标号)。A.增大 的浓度 的浓度 | B.提高温度 | C.恒容下通入惰性气体 | D.使用高效催化剂 |
| A.C3H8的转化率等于H2的产率 | B.混合气体的平均相对分子质量不变 |
C.v(C3H8)与 的比值不变 的比值不变 | D.混合气体的密度不变 |
 ,平衡时总压增加了20%。则达到平衡时,
,平衡时总压增加了20%。则达到平衡时, 的转化率为
的转化率为
(5)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。写出该反应的化学平衡常数表达式:K=
您最近一年使用:0次
名校
解题方法
5 . 下列指定反应的离子方程式正确的是
| A.碘化亚铁溶液通入少量的氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| B.用H2O2从酸化的海带灰浸出液中制取碘:2I-+H2O2+2H+=I2+2H2O |
C.Fe(OH)3胶体的制备:Fe3++3NH3•H2O=Fe(OH)3(胶体)+3NH |
D.等物质的量的NaHCO3溶液与Ca(OH)2溶液混合:2HCO +Ca2++2OH-=CaCO3↓+CO +Ca2++2OH-=CaCO3↓+CO |
您最近一年使用:0次
2023-09-17更新
|
709次组卷
|
3卷引用:广西防城港市实验高级中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
6 . 常温下,下列物质可用铁制容器盛装的是
| A.盐酸 | B.浓硫酸 | C.氯化铁溶液 | D.硫酸铜溶液 |
您最近一年使用:0次
2023-08-05更新
|
552次组卷
|
27卷引用:广西防城港市实验高级中学2022-2023学年高一下学期期中考试化学试题
广西防城港市实验高级中学2022-2023学年高一下学期期中考试化学试题北京市海淀区2022-2023学年高一上学期期末考试化学试题广西钦州市第四中学2022-2023学年高一下学期2月考试化学试题广东省佛山市顺德区罗定邦中学2022-2023学年高一下学期3月第一次月考化学试题北京市大兴区2022-2023学年高一下学期期中考试化学试题内蒙古通辽市重点学校2022-2023学年高一下学期3月质量检测化学试题北京市房山区2022-2023学年高一上学期期末考试化学试题(已下线)专题06 铁、铝及其化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)北京市丰台区2020-2021学年高一上学期期末考试化学试题北京市第四十三中学2020-2021学年高一下学期第一次月考化学试题北京市第十四中学2020-2021学年高一下学期期中测试化学试题北京市月坛中学2020-2021学年高一下学期期中考试化学试题北京市第五中学2020-2021学年高一下学期第一次阶段考试化学试题北京市中国农业大学附属中学2020-2021学年高一上学期期末学业水平调研化学试题北京市丰台区2021-2022学年高一上学期期末考试化学试题北京景山学校2021-2022学年高一下学期期中考试化学试题北京市第十一中学2021-2022学年高一下学期6月月考化学试题(已下线)3.1.1 铁的单质、氧化物及氢氧化物-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)北京市首师附密云中学2021-2022学年高一下学期等级考化学试题云南省昆明北大博雅实验中学2020-2021学年高一下学期第一次月考化学试题北京市十一实验中学2022-2023学年高一上学期期末化学试题(已下线)5.1.2硫酸-随堂练习(已下线)5.1.2 硫酸湖南省怀化市第一中学2023-2024学年高一下学期入学考试 化学试题山东省中央民族大学附中青岛学校2023-2024学年高一上学期第二次阶段性检测化学试题北京市第二十二中学2023-2024学年高一下学期阶段测试化学试题北京市第十五中学2023-2024学年高一下学期期中考试化学试题
名校
解题方法
7 . 常温下,下列各离子组在指定溶液中能大量存在的是
A.无色溶液: 、 、 、 、 | B. 的溶液: 的溶液: 、 、 、 、 |
C.使石蕊变红的溶液: 、 、 、 、 | D. 的溶液中: 的溶液中: 、 、 、 、 |
您最近一年使用:0次
2023-07-01更新
|
199次组卷
|
3卷引用:广西防城港市实验高级中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
8 . 材料与生活、生产息息相关,目前使用的材料主要有:金属材料、传统无机非金属材料、新型无机非金属材料、高分子材料、复合材料等。
(1)硅酸盐材料是重要的传统无机非金属材料,也是日常生活、交通工具、建筑行业等不可缺少的材料之一、下列不属于传统硅酸盐产品的是___________ (填写序号)。
①光导纤维 ②水泥 ③玻璃 ④陶瓷
(2)玻璃是重要的建筑和装饰材料,玻璃属于___________ (填“纯净物”或“混合物”)。雕花玻璃的花纹是利用氢氟酸对普通玻璃中的二氧化硅的腐蚀作用而制成的,写出该反应的化学方程式___________ 。
(3)氮化硅是一种高温陶瓷材料,它的硬度大、熔点高,化学性质稳定。工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅,该反应属于化学反应基本类型中的___________ 反应;已知氮化硅中硅元素的化合价为+4价,则氮化硅的化学式为___________ 。
(1)硅酸盐材料是重要的传统无机非金属材料,也是日常生活、交通工具、建筑行业等不可缺少的材料之一、下列不属于传统硅酸盐产品的是
①光导纤维 ②水泥 ③玻璃 ④陶瓷
(2)玻璃是重要的建筑和装饰材料,玻璃属于
(3)氮化硅是一种高温陶瓷材料,它的硬度大、熔点高,化学性质稳定。工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅,该反应属于化学反应基本类型中的
您最近一年使用:0次
名校
解题方法
9 . 根据原电池原理,人们研制出了性能各异的化学电池。
(1)锌铜原电池装置示意图如图1,Zn片作___________ (填“正极”或“负极”)。
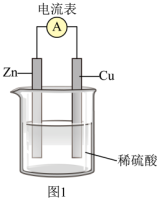
(2)Cu片上发生反应的电极反应式为___________ ,Zn片上的电极反应式为___________
(3)电流表指针偏转,说明该装置实现了化学能向___________ 的转化。
(4)某锂-空气电池的总反应为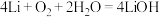 ,其工作原理示意图如图2。
,其工作原理示意图如图2。
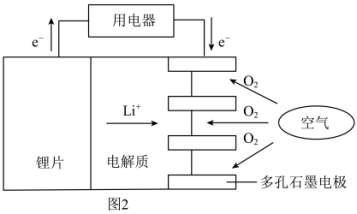
下列说法正确的是___________ (填字母)。
a.锂片作负极 b. 发生还原反应
发生还原反应
(1)锌铜原电池装置示意图如图1,Zn片作

(2)Cu片上发生反应的电极反应式为
(3)电流表指针偏转,说明该装置实现了化学能向
(4)某锂-空气电池的总反应为
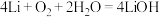 ,其工作原理示意图如图2。
,其工作原理示意图如图2。
下列说法正确的是
a.锂片作负极 b.
 发生还原反应
发生还原反应
您最近一年使用:0次
2023-04-29更新
|
145次组卷
|
2卷引用:广西防城港市实验高级中学2022-2023学年高一下学期期中考试化学试题
名校
解题方法
10 . 一种NO-空气燃料电池的工作原理如图所示,该电池工作时,下列说法正确的是


| A.电子的流动方向:负极→电解质溶液→正极 |
| B.H+通过质子交换膜向左侧多孔石墨棒移动 |
| C.若产生lmolHNO3,则通入O2的体积应大于16.8L |
D.放电过程中负极的电极反应式为NO-3e-+2H2O= +4H+ +4H+ |
您最近一年使用:0次
2023-03-12更新
|
1186次组卷
|
3卷引用:广西防城港市实验高级中学2023-2024学年高二上学期期中考试化学试题



