名校
解题方法
1 . 乙二胺四乙酸铁钠可用于感光材料冲洗药品及漂白剂,化学式为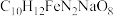 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下:
(1)基态氯原子的价层电子排布图为___________ 。
(2)下列氮原子能量最高的是___________(填标号)。
(3)EDTA的组成元素中C、N、O的第一电离能由大到小顺序为___________ (填元素符号)。碳原子的杂化轨道类型为___________ 。
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为___________ 。
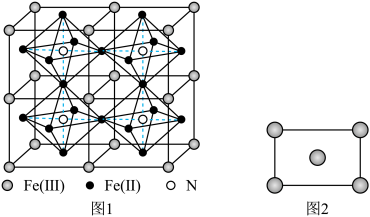
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为___________ 。___________ 区(填“s”“p”“d”或“ds”)。铁的某种晶胞沿面对角线的位置切下之后可以得到如图2所示的截面。假设铁的原子半径为a nm,则该铁晶体的密度为___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
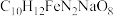 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下: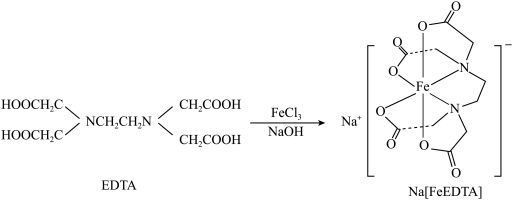
(1)基态氯原子的价层电子排布图为
(2)下列氮原子能量最高的是___________(填标号)。
A.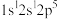 | B. | C. | D.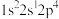 |
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为
 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2023-04-23更新
|
889次组卷
|
8卷引用:福建省百校联盟2023届高三第三次模拟考试化学试题
福建省百校联盟2023届高三第三次模拟考试化学试题福建省百校联盟2023届高三下学期第三次模拟考试化学试题(已下线)押题密卷 02-【热题狂飙】2023年高考化学样卷(全国卷专用)广西壮族自治区南宁市第二中学2023届高三下学期收网考理科综合化学试题(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)2023届广西钦州市灵山县那隆中学高三下学期5月考前冲刺保温卷理综试卷-高中化学北京市第二中学2022-2023学年高二下学期期末考试化学试题北京市首都师范大学附属中学2023-2024学年高三下学期3月月考化学试题
2 .  、
、 、
、 、
、 、
、 、
、 是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
(1)若 的焰色试验为黄色,且
的焰色试验为黄色,且 为化合物,回答下列问题:
为化合物,回答下列问题:
① 的电子式为
的电子式为___________ , 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
②若 为强还原性的非金属单质,通常为黑色粉末,则
为强还原性的非金属单质,通常为黑色粉末,则 的电子式为
的电子式为___________ 。
③若 为一种造成温室效应的气体,则鉴别等浓度的
为一种造成温室效应的气体,则鉴别等浓度的 、
、 溶液,可选择的试剂为
溶液,可选择的试剂为_____ (填代号)。
a.酚酞溶液b. 溶液c.
溶液c. 溶液d.
溶液d. 溶液
溶液
④若 为
为 ,则
,则 与
与 反应的化学方程式为
反应的化学方程式为________ ,写出 的一种用途
的一种用途______ 。
(2)若 为黄绿色气体单质,具有很强的氧化性,则:
为黄绿色气体单质,具有很强的氧化性,则:
①组成物质 的元素在元素周期表中的位置是
的元素在元素周期表中的位置是___________ 。
② 的水溶液放置一段时间后,溶液的酸性
的水溶液放置一段时间后,溶液的酸性___________ (填“增强”、“减弱”或“不变”)。
③若 为强电解质,则
为强电解质,则 可能为
可能为___________ (填代号)。
a. b.
b. c.
c. d.
d.
④请写出 与冷的石灰乳反应的化学方程式:
与冷的石灰乳反应的化学方程式:___________ 。
 、
、 、
、 、
、 、
、 、
、 是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
(1)若
 的焰色试验为黄色,且
的焰色试验为黄色,且 为化合物,回答下列问题:
为化合物,回答下列问题:①
 的电子式为
的电子式为 与
与 反应的离子方程式为
反应的离子方程式为②若
 为强还原性的非金属单质,通常为黑色粉末,则
为强还原性的非金属单质,通常为黑色粉末,则 的电子式为
的电子式为③若
 为一种造成温室效应的气体,则鉴别等浓度的
为一种造成温室效应的气体,则鉴别等浓度的 、
、 溶液,可选择的试剂为
溶液,可选择的试剂为a.酚酞溶液b.
 溶液c.
溶液c. 溶液d.
溶液d. 溶液
溶液④若
 为
为 ,则
,则 与
与 反应的化学方程式为
反应的化学方程式为 的一种用途
的一种用途(2)若
 为黄绿色气体单质,具有很强的氧化性,则:
为黄绿色气体单质,具有很强的氧化性,则:①组成物质
 的元素在元素周期表中的位置是
的元素在元素周期表中的位置是②
 的水溶液放置一段时间后,溶液的酸性
的水溶液放置一段时间后,溶液的酸性③若
 为强电解质,则
为强电解质,则 可能为
可能为a.
 b.
b. c.
c. d.
d.
④请写出
 与冷的石灰乳反应的化学方程式:
与冷的石灰乳反应的化学方程式:
您最近一年使用:0次
2023-12-26更新
|
182次组卷
|
2卷引用:上海市宜川中学2023-2024学年高三上学期12月考试化学试题
解题方法
3 . 铁及其化合物在生产、生活中有着重要作用。按要求回答下列问题。
(1)基态Fe原子的价层电子排布式为___________ ;铁元素在元素周期表中的位置是___________ ,属于___________ 区。
(2)铁及其化合物A~E的分类分布及其转化关系如下图所示:
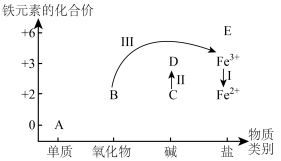
①从图中(A~E)选择反应物,实现Ⅰ的转化,写出反应Ⅰ的离子方程式:___________ 。
②预测物质E中铁元素具有___________ (填“氧化性”或“还原性”)。
③写出反应Ⅱ的化学方程式:___________ 。
④实现反应Ⅲ的转化,可选择含N元素的试剂为___________ 。
(3)探究铁盐X的组成与性质(忽略过程中氧气的参与)
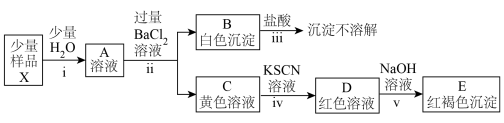
①由步骤ⅰ及其现象可推知铁盐X的物理性质:___________ 。
②由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为___________ 。
③C溶液呈黄色,不可能是因其体系中含有的___________ 、___________ 、___________ 、___________ (填离子符号)所致;
而可能是因其体系中含有的___________ 、___________ (填粒子的化学式)等所致。
④由步骤iv、v及其现象,体系中与 结合能力最强的离子是
结合能力最强的离子是___________ 。
(1)基态Fe原子的价层电子排布式为
(2)铁及其化合物A~E的分类分布及其转化关系如下图所示:

①从图中(A~E)选择反应物,实现Ⅰ的转化,写出反应Ⅰ的离子方程式:
②预测物质E中铁元素具有
③写出反应Ⅱ的化学方程式:
④实现反应Ⅲ的转化,可选择含N元素的试剂为
(3)探究铁盐X的组成与性质(忽略过程中氧气的参与)

①由步骤ⅰ及其现象可推知铁盐X的物理性质:
②由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为
③C溶液呈黄色,不可能是因其体系中含有的
而可能是因其体系中含有的
④由步骤iv、v及其现象,体系中与
 结合能力最强的离子是
结合能力最强的离子是
您最近一年使用:0次
解题方法
4 . A、B、C、D、E、F、G均为常见短周期元素,原子序数依次递增。已知A、B、C能分别与D组成二元化合物K、L、M,甲、乙分别是B、D的单质,常温下分别是常见的固体和气体,化合物M是产生光化学烟雾的主要气体之一,丙是C的最高价氧化物对应的水化物,它们之间有如图所示转化关系。E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
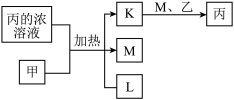
(1)C在元素周期表中的位置为_______ 。
(2)甲与丙的浓溶液反应的化学方程式为_______ 。
(3)化合物L的电子式为_______ ,M与水发生反应的化学方程式是_______ ,该反应的还原产物是_______ 。
(4)E、F、G形成的简单离子,半径由大到小顺序是_______ (用离子符号表示)。B、F、G元素的非金属性由强到弱的顺序_______ (用元素符号表示)。

(1)C在元素周期表中的位置为
(2)甲与丙的浓溶液反应的化学方程式为
(3)化合物L的电子式为
(4)E、F、G形成的简单离子,半径由大到小顺序是
您最近一年使用:0次
5 . 从某矿渣[成分为 (铁酸镍)、
(铁酸镍)、 、
、 、
、 、
、 等]中回收
等]中回收 的工艺流程如下:
的工艺流程如下:
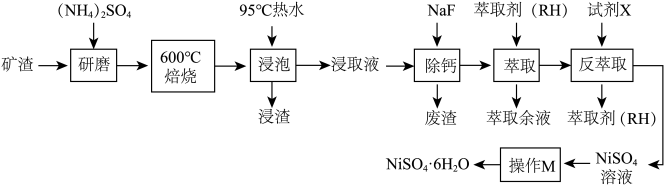
已知:① 在350℃以上会分解生成
在350℃以上会分解生成 和
和 ;
;
②萃取剂(RH)萃取 的原理为
的原理为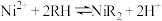 。
。
回答下列问题:
(1) 在元素周期表中的位置是
在元素周期表中的位置是___________ 。
(2)600℃焙烧时, 几乎不发生反应,
几乎不发生反应, 、
、 、
、 转化为相应的硫酸盐。
转化为相应的硫酸盐。 生成
生成 、
、 ,发生该反应的化学方程式为
,发生该反应的化学方程式为___________ 。
(3)“浸渣”的成分除了有 、
、 、
、 外,还含有
外,还含有___________ (填化学式)。为检验浸出液中是否含有 ,可选用的化学试剂是
,可选用的化学试剂是___________ 。
(4)将“浸取液”冷却到室温,测得溶液中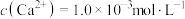 ,向其中加入一定量的
,向其中加入一定量的 晶体,搅拌,当溶液中
晶体,搅拌,当溶液中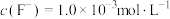 时,除钙率为
时,除钙率为___________ %[室温时,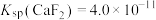 ,
,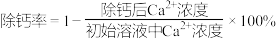 ]。
]。
(5)反萃取试剂X为___________ (填化学式)。
(6)资料显示,硫酸镍结晶水合物的形态与温度有如表所示关系:
从 溶液中获得稳定的
溶液中获得稳定的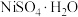 晶体的操作是
晶体的操作是___________ 、___________ 、过滤、洗涤、干燥等多步操作。
 (铁酸镍)、
(铁酸镍)、 、
、 、
、 、
、 等]中回收
等]中回收 的工艺流程如下:
的工艺流程如下:
已知:①
 在350℃以上会分解生成
在350℃以上会分解生成 和
和 ;
;②萃取剂(RH)萃取
 的原理为
的原理为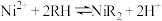 。
。回答下列问题:
(1)
 在元素周期表中的位置是
在元素周期表中的位置是(2)600℃焙烧时,
 几乎不发生反应,
几乎不发生反应, 、
、 、
、 转化为相应的硫酸盐。
转化为相应的硫酸盐。 生成
生成 、
、 ,发生该反应的化学方程式为
,发生该反应的化学方程式为(3)“浸渣”的成分除了有
 、
、 、
、 外,还含有
外,还含有 ,可选用的化学试剂是
,可选用的化学试剂是(4)将“浸取液”冷却到室温,测得溶液中
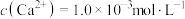 ,向其中加入一定量的
,向其中加入一定量的 晶体,搅拌,当溶液中
晶体,搅拌,当溶液中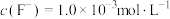 时,除钙率为
时,除钙率为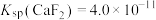 ,
,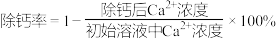 ]。
]。(5)反萃取试剂X为
(6)资料显示,硫酸镍结晶水合物的形态与温度有如表所示关系:
| 温度 | 低于30.8℃ | 30.8~53.8℃ | 53.8~280℃ | 高于280℃ |
| 晶体形态 |  | 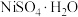 | 多种结晶水合物 |  |
 溶液中获得稳定的
溶液中获得稳定的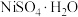 晶体的操作是
晶体的操作是
您最近一年使用:0次
2023-08-11更新
|
200次组卷
|
2卷引用:贵州省2024届高三8月入学考试化学试题
6 . 化合物M由两种短周期主族元素组成,在一定条件下可以发生下列转化:
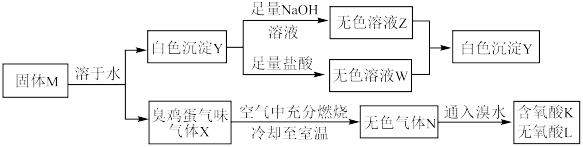
请回答下列问题:
(1)固体M的化学式为___________ 。
(2)无氧酸L中阴离子对应元素在元素周期表中的位置为___________ ,其基态原子中电子的空间运动状态有___________ 种。
(3)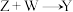 的化学方程式为
的化学方程式为___________ 。
(4)上述流程的反应中涉及的短周期非金属元素的电负性由大到小的顺序为___________ 。
(5)如图所示,在室温下向甲、乙两相同密闭容器中,分别充入等物质的量气体X和气体N。
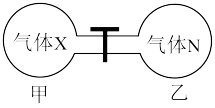
①反应前两容器中的气体密度: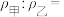
___________ 。
②打开活塞,使气体充分反应,则反应前后的压强: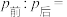
___________ 。
(6)将无色气体N通入到浓硝酸中,有红棕色气体冒出,在反应中n(氧化剂):n(还原剂)=___________ 。

请回答下列问题:
(1)固体M的化学式为
(2)无氧酸L中阴离子对应元素在元素周期表中的位置为
(3)
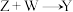 的化学方程式为
的化学方程式为(4)上述流程的反应中涉及的短周期非金属元素的电负性由大到小的顺序为
(5)如图所示,在室温下向甲、乙两相同密闭容器中,分别充入等物质的量气体X和气体N。

①反应前两容器中的气体密度:
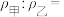
②打开活塞,使气体充分反应,则反应前后的压强:
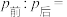
(6)将无色气体N通入到浓硝酸中,有红棕色气体冒出,在反应中n(氧化剂):n(还原剂)=
您最近一年使用:0次
2023-11-22更新
|
88次组卷
|
2卷引用:江西省2024届高三上学期11 月一轮总复习调研测试化学试题
名校
7 . 聚丙烯腈纤维俗名人造羊毛,由丙烯腈聚合而得。用丙烯合成丙烯腈的反应如下: 2C3H6(g)+2NH3(g)+3O2(g)  2C3H3N(g)+6H2O(g)+1030kJ
2C3H3N(g)+6H2O(g)+1030kJ
(1)碳在元素周期表中的位置是_______ ;C、N、O三种元素的原子半径由小到大的顺序为_______ ;
(2)某密闭容器中发生上述反应,生成丙烯腈的反应速率与反应时间的关系如下图所示。
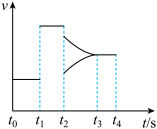
t1时刻表示体系改变的反应条件为_______ ; t2时刻表示体系改变了另一反应条件,此时平衡_______ 移动(填“正向”、“逆向”或“不”)。
丙烯的转化率与反应温度的关系如图示:

(3)有利于提高丙烯平衡转化率的反应条件有_______ ;
(4)最大转化率所对应的温度为460℃。当温度低于460℃时,丙烯的转化率_______ (填“是”或“不是”)所对应温度下的平衡转化率,理由是_______ 。
(5)一定条件下,在2L恒容密闭容器中,通入84g C3H6、34g NH3、96g O2,若该反应5 min到达a点,则0~5min内丙烯的平均反应速率为_______ mol∙L−1∙min−1。
 2C3H3N(g)+6H2O(g)+1030kJ
2C3H3N(g)+6H2O(g)+1030kJ(1)碳在元素周期表中的位置是
(2)某密闭容器中发生上述反应,生成丙烯腈的反应速率与反应时间的关系如下图所示。

t1时刻表示体系改变的反应条件为
丙烯的转化率与反应温度的关系如图示:

(3)有利于提高丙烯平衡转化率的反应条件有
(4)最大转化率所对应的温度为460℃。当温度低于460℃时,丙烯的转化率
(5)一定条件下,在2L恒容密闭容器中,通入84g C3H6、34g NH3、96g O2,若该反应5 min到达a点,则0~5min内丙烯的平均反应速率为
您最近一年使用:0次
2023-04-14更新
|
551次组卷
|
4卷引用:上海市静安区2022-2023学年高三下学期二模测试化学试题
上海市静安区2022-2023学年高三下学期二模测试化学试题(已下线)上海市静安区2022-2023学年高三下学期二模变式题(原理综合题)(已下线)【知识图鉴】单元讲练测选择性必修1第2单元02基础练河北省衡水市饶阳中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
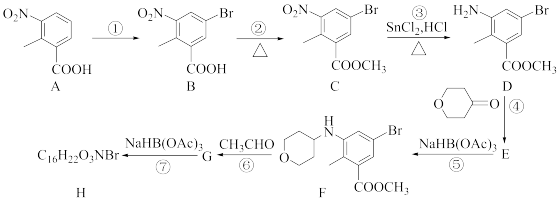
8 . 化合物H是抗肿瘤药泰泽司他的中间体,其合成路线如图:
已知:①
②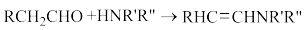 ;
;
③苯环土取代基定位原则(苯环上有该取代基后,下一个取代基在苯环上与该取代基的相对位置):—CH2OH为邻、对位定位基,—CHO为间位定位基。
回答下列问题:
(1)实现反应①的转化,所需试剂除A外还有___________ 。
(2)化合物B中不含氧官能团名称为___________ ;
(3)反应⑤的反应类型为___________ ;化合物G的结构简式为___________ 。
(4)满足下列条件的A的同分异构体的结构简式为___________ 、___________ 。
①含有苯环,且苯环上有5个取代基;②可发生银镜反应;③可与氯化铁溶液发生显色反应;④核磁共振氢谱有4组峰,峰面积之比为1:2:2:2。
(5)已知酯可以水解生成醇,也可以氨解生成醇,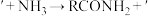 。化合物D通过聚合反应可形成一种高分于;该反应的化学方程式为
。化合物D通过聚合反应可形成一种高分于;该反应的化学方程式为___________ 。
(6)参照题干中的合成路线,设计以苯甲醇为主要原料,制备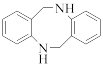 的合成路线
的合成路线___________ (无机试剂任选)。

已知:①

②
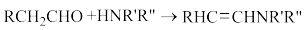 ;
;③苯环土取代基定位原则(苯环上有该取代基后,下一个取代基在苯环上与该取代基的相对位置):—CH2OH为邻、对位定位基,—CHO为间位定位基。
回答下列问题:
(1)实现反应①的转化,所需试剂除A外还有
(2)化合物B中不含氧官能团名称为
(3)反应⑤的反应类型为
(4)满足下列条件的A的同分异构体的结构简式为
①含有苯环,且苯环上有5个取代基;②可发生银镜反应;③可与氯化铁溶液发生显色反应;④核磁共振氢谱有4组峰,峰面积之比为1:2:2:2。
(5)已知酯可以水解生成醇,也可以氨解生成醇,
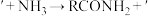 。化合物D通过聚合反应可形成一种高分于;该反应的化学方程式为
。化合物D通过聚合反应可形成一种高分于;该反应的化学方程式为(6)参照题干中的合成路线,设计以苯甲醇为主要原料,制备
 的合成路线
的合成路线
您最近一年使用:0次
2023-05-04更新
|
532次组卷
|
2卷引用:湖南师范大学附属中学2023届高三下学期模拟考试(二)化学试题
解题方法
9 . 化合物H是一种抗失眠药物,其合成路线如下:
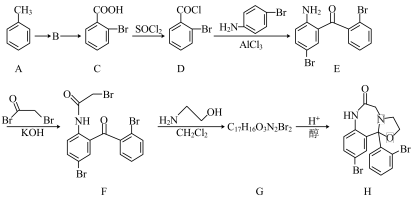
已知:一元取代苯进行二元取代反应时,已有基团会对其他基团进入苯环的位置产生影响。
如: 为邻、对位定位基,
为邻、对位定位基,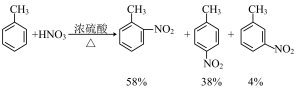 ,
, 为邻、对位定位基,
为邻、对位定位基,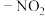 、
、 为间位定位基。
为间位定位基。
(1)B→C所需的试剂为___________ 。
(2)若用 代替
代替 ,D→E会生成一种与E互为同分异构体的有机物,该有机物的结构简式为
,D→E会生成一种与E互为同分异构体的有机物,该有机物的结构简式为___________ 。
(3)G→H转化过程中另一产物为____________ 。
(4)E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:____________ 。
①能发生银镜反应:②含有两个苯环,分子中有3种不同化学环境的氢原子。
(5)设计以乙二酸(HOOCCOOH)和苯为原料制备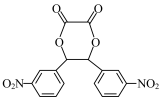 的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)
的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干) ____________ 。

已知:一元取代苯进行二元取代反应时,已有基团会对其他基团进入苯环的位置产生影响。
如:
 为邻、对位定位基,
为邻、对位定位基, ,
, 为邻、对位定位基,
为邻、对位定位基,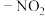 、
、 为间位定位基。
为间位定位基。(1)B→C所需的试剂为
(2)若用
 代替
代替 ,D→E会生成一种与E互为同分异构体的有机物,该有机物的结构简式为
,D→E会生成一种与E互为同分异构体的有机物,该有机物的结构简式为(3)G→H转化过程中另一产物为
(4)E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
①能发生银镜反应:②含有两个苯环,分子中有3种不同化学环境的氢原子。
(5)设计以乙二酸(HOOCCOOH)和苯为原料制备
 的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)
的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)
您最近一年使用:0次
名校
10 . 工业上用废料制备 的工艺流程如图所示:
的工艺流程如图所示:
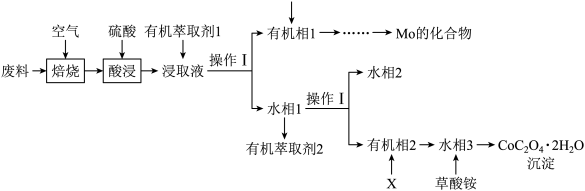
已知:①废料中主要含有 、
、 、
、 ,其他杂质不参与反应;
,其他杂质不参与反应;
②焙烧时,Mo元素转化为 ;
;
③浸取液中金属离子以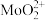 、
、 、
、 形式存在;
形式存在;
④25℃时, 的
的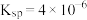 。
。
回答下列问题:
(1)Co元素在元素周期表中的位置是___________ 。已知Mo的核电荷数为42,Mo(IV)离子的价层电子排布式是___________ 。
(2)焙烧时,发生氧化反应的元素有___________ (填元素符号)。标准状况下33.6L 参与焙烧,完全反应时转移的电子的物质的量为
参与焙烧,完全反应时转移的电子的物质的量为___________ 。
(3)酸浸时,所用硫酸过量,则Mo元素发生转化的离子方程式为___________ 。
(4)在实验室进行操作I,所用到的玻璃仪器有___________ 。
(5)萃取 “的原理是“
“的原理是“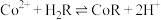 ”,水相2中存在的主要阳离子有
”,水相2中存在的主要阳离子有___________ ,加入试剂X是___________ (填名称),假定水相3中 的浓度为c mo/L,且沉钴过程中加入沉淀剂固体后不考虑溶液体积变化,并忽略盐类的水解,当
的浓度为c mo/L,且沉钴过程中加入沉淀剂固体后不考虑溶液体积变化,并忽略盐类的水解,当 沉淀完全时,溶液中
沉淀完全时,溶液中 最小值的计算式为
最小值的计算式为___________ mol/L(用含c的计算式表示)。
(6)在空气中加热10.98g ,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。经测定,加热到210~320℃过程中的生成物只有
,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。经测定,加热到210~320℃过程中的生成物只有 和钴的氧化物,此过程发生反应的化学方程式为
和钴的氧化物,此过程发生反应的化学方程式为___________ 。
 的工艺流程如图所示:
的工艺流程如图所示:
已知:①废料中主要含有
 、
、 、
、 ,其他杂质不参与反应;
,其他杂质不参与反应;②焙烧时,Mo元素转化为
 ;
;③浸取液中金属离子以
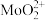 、
、 、
、 形式存在;
形式存在;④25℃时,
 的
的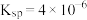 。
。回答下列问题:
(1)Co元素在元素周期表中的位置是
(2)焙烧时,发生氧化反应的元素有
 参与焙烧,完全反应时转移的电子的物质的量为
参与焙烧,完全反应时转移的电子的物质的量为(3)酸浸时,所用硫酸过量,则Mo元素发生转化的离子方程式为
(4)在实验室进行操作I,所用到的玻璃仪器有
(5)萃取
 “的原理是“
“的原理是“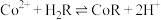 ”,水相2中存在的主要阳离子有
”,水相2中存在的主要阳离子有 的浓度为c mo/L,且沉钴过程中加入沉淀剂固体后不考虑溶液体积变化,并忽略盐类的水解,当
的浓度为c mo/L,且沉钴过程中加入沉淀剂固体后不考虑溶液体积变化,并忽略盐类的水解,当 沉淀完全时,溶液中
沉淀完全时,溶液中 最小值的计算式为
最小值的计算式为(6)在空气中加热10.98g
 ,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。经测定,加热到210~320℃过程中的生成物只有
,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。经测定,加热到210~320℃过程中的生成物只有 和钴的氧化物,此过程发生反应的化学方程式为
和钴的氧化物,此过程发生反应的化学方程式为| 温度范围/℃ | 固体质量/g |
| 150~210 | 8.82 |
| 210~320 | 4.82 |
| 890~920 | 4.50 |
您最近一年使用:0次
2022-09-25更新
|
403次组卷
|
2卷引用:重庆市巴蜀中学2022-2023学年高三上学期月考化学试题



