名校
解题方法
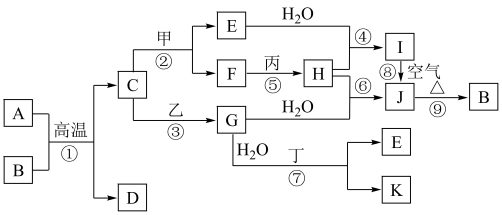
1 . 如图是中学化学常见物质的转化关系,部分物质和反应条件略去。其中A是地壳中含量最多的金属元素的单质,B是一种红棕色粉末;通常情况下,乙为黄绿色气体单质,H是有刺激性气味的气体,在工业上可通过反应⑥在高温高压、催化剂条件下合成;J为难溶于水的红褐色固体;反应⑦在工业上可用于制作印刷电路板。
请回答下列问题:
(1)组成物质C的元素在元素周期表中的位置为___________ 。
(2)在反应①~⑨中,不属于氧化还原反应的是___________ 。
(3)写出下列反应的化学方程式:
反应①:___________ 。
反应⑧:___________ 。
(4)写出乙与E在溶液中反应的离子方程式:___________ 。
(5)在E溶液中加入与E等物质的量的一种淡黄色固体,恰好使E转化为J,写出该反应的离子方程式:___________ 。
(6)检验G中阳离子的试剂的化学式为___________ ,反应现象为___________ 。

请回答下列问题:
(1)组成物质C的元素在元素周期表中的位置为
(2)在反应①~⑨中,不属于氧化还原反应的是
(3)写出下列反应的化学方程式:
反应①:
反应⑧:
(4)写出乙与E在溶液中反应的离子方程式:
(5)在E溶液中加入与E等物质的量的一种淡黄色固体,恰好使E转化为J,写出该反应的离子方程式:
(6)检验G中阳离子的试剂的化学式为
您最近一年使用:0次
解题方法
2 . 已知短周期元素 、
、 、
、 、
、 、
、 分布在三个周期,
分布在三个周期, 、
、 最外层电子数相同,物质
最外层电子数相同,物质 由原子序数依次增大的元素
由原子序数依次增大的元素 、
、 、
、 组成,其中
组成,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 、
、 、
、 简单离子的核外电子排布相同,物质
简单离子的核外电子排布相同,物质 的结构式如下图所示:
的结构式如下图所示:
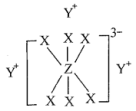
回答下列问题:
(1) 、
、 元素的中文名称为徐寿确定并使用至今,
元素的中文名称为徐寿确定并使用至今, 在周期表中的位置是
在周期表中的位置是___________ ,写出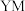 的电子式:
的电子式:___________ 。
(2) 、
、 、
、 、
、 简单离子的半径由大到小的顺序(用对应离子符号表示):
简单离子的半径由大到小的顺序(用对应离子符号表示):___________ 。
(3)在 ,与
,与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:___________ 。
(4)镓 与
与 为同主族元素,氮化镓
为同主族元素,氮化镓 和砷化镓
和砷化镓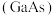 作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是___________ 。
a. 位于元素周期表第四周期ⅣA族
位于元素周期表第四周期ⅣA族
b. 为新型无机非金属材料
为新型无机非金属材料
c. 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含 的半导体材料可以用浓硝酸溶解,生成
的半导体材料可以用浓硝酸溶解,生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为___________ 。
(5) 是有机合成的重要还原剂,其合成路线如图所示
是有机合成的重要还原剂,其合成路线如图所示
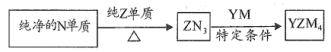
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为___________ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
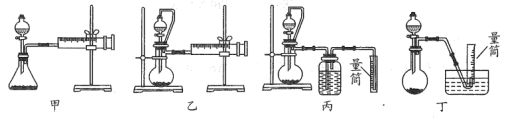
从简约性、准确性考虑,最适宜的方案是___________ (填编号)。
③取样品 ,若实验测得氢气的体积为
,若实验测得氢气的体积为 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为___________ (用代数式表示)。
 、
、 、
、 、
、 、
、 分布在三个周期,
分布在三个周期, 、
、 最外层电子数相同,物质
最外层电子数相同,物质 由原子序数依次增大的元素
由原子序数依次增大的元素 、
、 、
、 组成,其中
组成,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 、
、 、
、 简单离子的核外电子排布相同,物质
简单离子的核外电子排布相同,物质 的结构式如下图所示:
的结构式如下图所示: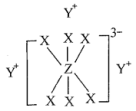
回答下列问题:
(1)
 、
、 元素的中文名称为徐寿确定并使用至今,
元素的中文名称为徐寿确定并使用至今, 在周期表中的位置是
在周期表中的位置是 的电子式:
的电子式:(2)
 、
、 、
、 、
、 简单离子的半径由大到小的顺序(用对应离子符号表示):
简单离子的半径由大到小的顺序(用对应离子符号表示):(3)在
 ,与
,与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓
 与
与 为同主族元素,氮化镓
为同主族元素,氮化镓 和砷化镓
和砷化镓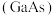 作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。①下列有关说法正确的是
a.
 位于元素周期表第四周期ⅣA族
位于元素周期表第四周期ⅣA族b.
 为新型无机非金属材料
为新型无机非金属材料c.
 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强d.酸性:

②废弃的含
 的半导体材料可以用浓硝酸溶解,生成
的半导体材料可以用浓硝酸溶解,生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示
是有机合成的重要还原剂,其合成路线如图所示
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品
 ,若实验测得氢气的体积为
,若实验测得氢气的体积为 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为
您最近一年使用:0次
解题方法
3 . 铜碘杂化团簇化合物具有优异的光学性能,可用于制备发光二极管、发光墨水、生物成像仪器等。一种铜碘杂化团簇的合成路线如图:
SbCl3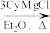 SbCy3(Cy代表-C6H11)
SbCy3(Cy代表-C6H11)

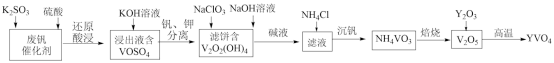
(1)已知Sb的原子序数为51,则它在元素周期表中的位置是_______ ,属于_____ (填s”、“p”、“d”或“ds”)区元素。
(2)CuI中Cu+的价电子排布图为_______ ;SbCy3只能与一个Cu+配位的原因是_____
(3)比较F和I的第一电离能大小,并说明理由:_______
(4)已知SbCl3(三氯化锑)是易挥发的物质,由此判断SbCl3是_______ 晶体,预测SbCl3的VSEPR模型名称为_______
(5)Et2O(即CH3CH2OCH2CH3,乙醚)中氧原子以及 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是_______ ,_______
(6)已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为anm、bnm、cnm,棱间夹角为α=β=γ=90°,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式_______ ,设阿伏加德罗常数的值为NA,已知SbCy3的相对分子质量是371,则该铜碘杂化团簇的密度_______ g/cm3(列计算式)
SbCl3
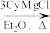 SbCy3(Cy代表-C6H11)
SbCy3(Cy代表-C6H11)
(1)已知Sb的原子序数为51,则它在元素周期表中的位置是
(2)CuI中Cu+的价电子排布图为
(3)比较F和I的第一电离能大小,并说明理由:
(4)已知SbCl3(三氯化锑)是易挥发的物质,由此判断SbCl3是
(5)Et2O(即CH3CH2OCH2CH3,乙醚)中氧原子以及
 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是(6)已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为anm、bnm、cnm,棱间夹角为α=β=γ=90°,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式
您最近一年使用:0次
解题方法
4 . 铜碘杂化团簇化合物具有优异的光学性能,可用于制备发光二极管、发光墨水、生物成像仪器等。一种铜碘杂化团簇的合成路线如下:
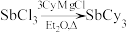 (
(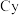 代表
代表 )
)

(1)已知 的原子序数为51,则它在元素周期表中的位置是
的原子序数为51,则它在元素周期表中的位置是______ ,属于______ (填“s”、“p”、“d”或“ ”)区元素。
”)区元素。
(2) 中
中 的价电子排布图为
的价电子排布图为______ ;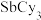 只能与一个
只能与一个 配位的原因是
配位的原因是_______ 。
(3)比较F和I的第一电离能大小,并说明理由:_______ 。
(4)已知 (三氯化锑)是易挥发的物质,由此判断
(三氯化锑)是易挥发的物质,由此判断 是
是_____ 晶体,预测 的
的 模型名称为
模型名称为______ 。
(5) (即
(即 ,乙醚)中氧原子以及
,乙醚)中氧原子以及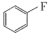 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是_____ 、_____ 。
(6)已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为 ,棱间夹角为
,棱间夹角为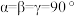 ,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式为
,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式为_______ ;设阿伏加德罗常数的值为 ,已知
,已知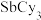 的相对分子质量是371,则该铜碘杂化团簇的密度是
的相对分子质量是371,则该铜碘杂化团簇的密度是_______  (列计算式)。
(列计算式)。
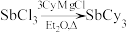 (
(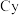 代表
代表 )
)
(1)已知
 的原子序数为51,则它在元素周期表中的位置是
的原子序数为51,则它在元素周期表中的位置是 ”)区元素。
”)区元素。(2)
 中
中 的价电子排布图为
的价电子排布图为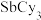 只能与一个
只能与一个 配位的原因是
配位的原因是(3)比较F和I的第一电离能大小,并说明理由:
(4)已知
 (三氯化锑)是易挥发的物质,由此判断
(三氯化锑)是易挥发的物质,由此判断 是
是 的
的 模型名称为
模型名称为(5)
 (即
(即 ,乙醚)中氧原子以及
,乙醚)中氧原子以及 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是(6)已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为
 ,棱间夹角为
,棱间夹角为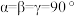 ,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式为
,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式为 ,已知
,已知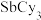 的相对分子质量是371,则该铜碘杂化团簇的密度是
的相对分子质量是371,则该铜碘杂化团簇的密度是 (列计算式)。
(列计算式)。
您最近一年使用:0次
2021-02-01更新
|
277次组卷
|
3卷引用:山西省太原市2021届高三上学期期末考试化学试题
解题方法
5 . 钒酸钇(YVO4)广泛应用于光纤通信领域,一种用废钒催化剂(含V2O5、K2O、SiO2、少量Fe2O3)制取YVO4的工艺流程如下:
已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。
回答下列问题:
(1)V元素在元素周期表中的位置为___________ 。
(2)“还原酸浸”时,钒以VO2+浸出,“浸出液”中还含有的金属离子是___________ 。V2O5被还原的离子方程式为___________ 。
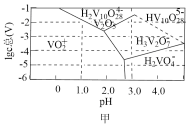
(3)常温下,各种形态五价钒粒子总浓度的对数[lgc总(V)]与pH关系如图甲。pH=4时增大钒粒子总浓度,粒子间转化反应的离子方程式为___________ 、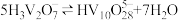 。
。
(4)写出“碱溶”时的化学方程式___________ ,结合“碱溶”和“沉钒”可知,ClO 、VO
、VO 氧化性更强的是
氧化性更强的是___________
(5)常温下,NH4VO3的溶解度S=0.468 g,则常温下NH4VO3的Ksp=___________ (设NH4VO3饱和溶液的密度为1 g/mL),某研究小组取234 g NH4VO3探究“焙烧”过程中的变化,焙烧过程中减少的质量(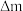 )随温度变化的曲线如图乙所示,则C点所得物质的化学式为
)随温度变化的曲线如图乙所示,则C点所得物质的化学式为___________ 。

已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。
回答下列问题:
(1)V元素在元素周期表中的位置为
(2)“还原酸浸”时,钒以VO2+浸出,“浸出液”中还含有的金属离子是
(3)常温下,各种形态五价钒粒子总浓度的对数[lgc总(V)]与pH关系如图甲。pH=4时增大钒粒子总浓度,粒子间转化反应的离子方程式为
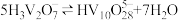 。
。
(4)写出“碱溶”时的化学方程式
 、VO
、VO 氧化性更强的是
氧化性更强的是(5)常温下,NH4VO3的溶解度S=0.468 g,则常温下NH4VO3的Ksp=
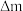 )随温度变化的曲线如图乙所示,则C点所得物质的化学式为
)随温度变化的曲线如图乙所示,则C点所得物质的化学式为
您最近一年使用:0次
解题方法
6 . X、Y、Z为短周期主族元素,且原子序数依次增大,Y、Z位于相邻主族,这三种元素形成的化合物甲为 ,化合物甲受热分解产生的物质及后续有关物质的转化关系如下图所示:
,化合物甲受热分解产生的物质及后续有关物质的转化关系如下图所示:
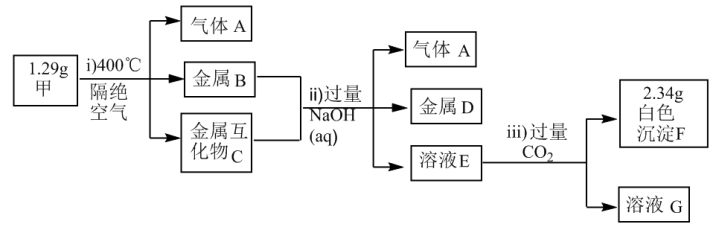
已知:金属互化物是由两种或两种以上的金属组成,其组成金属具有单质的性质。
回答下列问题:
(1)Y在元素周期表中的位置是___________ 。
(2)F受热分解生成两性氧化物,则F与烧碱溶液反应的离子方程式是___________ 。
(3)若溶液G中只有一种溶质,则该溶液中阴离子的浓度由大到小的顺序是___________ 。
(4)1.29g甲在隔绝空气的条件下,加热到400℃,完全分解产生的气体A的体积(标准状况)为___________ L。
 ,化合物甲受热分解产生的物质及后续有关物质的转化关系如下图所示:
,化合物甲受热分解产生的物质及后续有关物质的转化关系如下图所示:
已知:金属互化物是由两种或两种以上的金属组成,其组成金属具有单质的性质。
回答下列问题:
(1)Y在元素周期表中的位置是
(2)F受热分解生成两性氧化物,则F与烧碱溶液反应的离子方程式是
(3)若溶液G中只有一种溶质,则该溶液中阴离子的浓度由大到小的顺序是
(4)1.29g甲在隔绝空气的条件下,加热到400℃,完全分解产生的气体A的体积(标准状况)为
您最近一年使用:0次
名校
解题方法
7 . 中学化学中几种常见物质的转化关系如下:
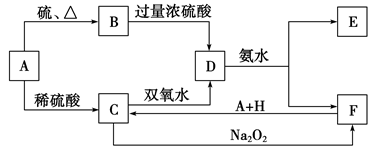
将饱和D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)A、B、H的化学式:A___________ ;B___________ ;H___________ 。
(2)A元素在元素周期表中的位置为:___________ ;红褐色胶体中F粒子直径大小的范围:___________ 。
(3)①Na2O2的电子式:___________ ;NH3极易溶于水的原因:___________ 。
②写出C的酸性溶液与双氧水反应的离子方程式:___________ 。
(4)写出鉴定E中阳离子的实验方法和现象:___________ 。

将饱和D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)A、B、H的化学式:A
(2)A元素在元素周期表中的位置为:
(3)①Na2O2的电子式:
②写出C的酸性溶液与双氧水反应的离子方程式:
(4)写出鉴定E中阳离子的实验方法和现象:
您最近一年使用:0次
名校
8 . 电镀污泥(主要含Cr、Cu、Zn、Ni、Fe、Si)中金属大多以氢氧化物的形式存在,硅以SiO2形式存在。某科研团队用萃取——沉淀法回收电镀污泥中金属的技术路线如图所示。
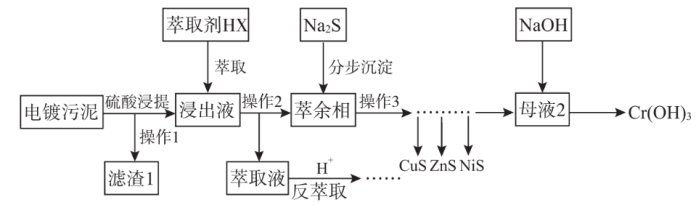
已知:①萃取反应可简单表示为nHX+Mn+ MXn+nH+
MXn+nH+
②相关资料显示,分步沉淀工序中投加硫化钠生成沉淀时,可以认为水溶液中的H2S饱和,饱和c(H2S)=1.0mol·L-1。
回答下列问题:
(1)铁元素在元素周期表中位置为___ ;滤渣1的主要成分是___ 。
(2)操作2的名称为___ 。
(3)萃取浸出液除去的元素为___ (填元素符号),由于该元素在分步沉淀工序中与硫化钠发生氧化还原反应生成多种沉淀难以分离,故该元素不可在分步沉淀工序中除去,写出此反应的化学方程式___ 。
(4)反萃取工序发生的离子方程式为____ 。
(5)萃余相中的Ni元素恰好完全转化为沉淀的pH为___ [通常认为溶液中离子浓度小于10-5mol·L-1为沉淀完全,Ksp(NiS)=1×10-19,考虑H2S的二级电离Ka1(H2S)=1×10-7,Ka2(H2S)=1×10-15]。

已知:①萃取反应可简单表示为nHX+Mn+
 MXn+nH+
MXn+nH+②相关资料显示,分步沉淀工序中投加硫化钠生成沉淀时,可以认为水溶液中的H2S饱和,饱和c(H2S)=1.0mol·L-1。
回答下列问题:
(1)铁元素在元素周期表中位置为
(2)操作2的名称为
(3)萃取浸出液除去的元素为
(4)反萃取工序发生的离子方程式为
(5)萃余相中的Ni元素恰好完全转化为沉淀的pH为
您最近一年使用:0次
2021-09-23更新
|
278次组卷
|
2卷引用:河北省省级联测2021-2022学年高三上学期第一次考试化学试题
真题
名校
9 . 下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
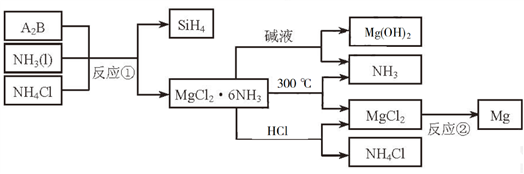
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________ ,Mg在元素周期表中的位置:_____________________ ,Mg(OH)2的电子式:____________________ 。
(2)A2B的化学式为_______________ 。反应②的必备条件是_______________ 。上图中可以循环使用的物质有_______________ 。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________ (写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________ 。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:

依据上述信息,写出制备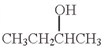 所需醛的可能结构简式:
所需醛的可能结构简式:_______________ 。

(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):
(2)A2B的化学式为
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:

依据上述信息,写出制备
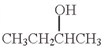 所需醛的可能结构简式:
所需醛的可能结构简式:
您最近一年使用:0次
2018-06-09更新
|
3025次组卷
|
13卷引用:专题08 常见无机物及其应用——备战2021年高考化学纠错笔记
(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记2018年全国普通高等学校招生统一考试化学(天津卷)(已下线)2018年高考题及模拟题汇编 专题13 元素及其化合物知识的综合应用(已下线)高考母题题源15 物质结构与推断(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第2讲 铝及其化合物云南省玉溪元江民中2020届高三开学考试化学试题云南省石屏县第二中学2020届高三上学期开学考试化学试题云南省玉溪市江川二中2019-2020学年高三上学期期中考试化学试题云南省西畴县第二中学2019-2020学年高三上学期期末考试化学试题贵州省镇远县二中2019-2020学年高三上学期期末考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高一下学期期末考试化学试题云南省弥勒市第四中学2019-2020学年高二上学期开学考试化学试题云南省绿春县二中2019-2020学年高一上学期期中考试化学试题
解题方法
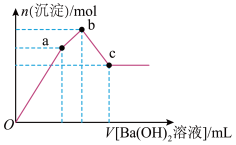
10 . 甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成。甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子。A元素原子核内质子数比E的少l,D、E同主族。某同学为探究甲的组成而进行如下实验:
①取mg甲的晶体溶于蒸馏水,配成500mL溶液;
②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀的物质的量与滴入Ba(OH)2溶液体积的关系如图所示;
③取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,然后折算成标准状况下的体积为224mL。
回答下列问题:
(1)D在元素周期表中的位置为_______ 。
(2)经测定晶体甲的摩尔质量为453g∙mol﹣1,其中阳离子和阴离子物质的量之比为1:1,且1mol甲晶体中含有12mol结晶水。则晶体甲的化学式为_______ 。
(3)图象中V(Oa):V(ab):V(bc)=_______
(4)写出ab段发生反应的离子方程式:_______ 。
(5)配成的甲溶液物质的量浓度是_______ 。
①取mg甲的晶体溶于蒸馏水,配成500mL溶液;
②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀的物质的量与滴入Ba(OH)2溶液体积的关系如图所示;
③取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,然后折算成标准状况下的体积为224mL。

回答下列问题:
(1)D在元素周期表中的位置为
(2)经测定晶体甲的摩尔质量为453g∙mol﹣1,其中阳离子和阴离子物质的量之比为1:1,且1mol甲晶体中含有12mol结晶水。则晶体甲的化学式为
(3)图象中V(Oa):V(ab):V(bc)=
(4)写出ab段发生反应的离子方程式:
(5)配成的甲溶液物质的量浓度是
您最近一年使用:0次



