名校
解题方法
1 . 乙二胺四乙酸铁钠可用于感光材料冲洗药品及漂白剂,化学式为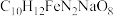 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下:
(1)基态氯原子的价层电子排布图为___________ 。
(2)下列氮原子能量最高的是___________(填标号)。
(3)EDTA的组成元素中C、N、O的第一电离能由大到小顺序为___________ (填元素符号)。碳原子的杂化轨道类型为___________ 。
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为___________ 。
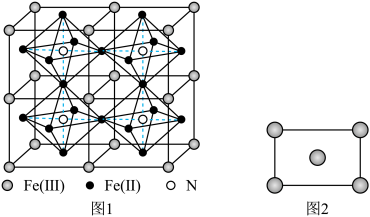
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为___________ 。___________ 区(填“s”“p”“d”或“ds”)。铁的某种晶胞沿面对角线的位置切下之后可以得到如图2所示的截面。假设铁的原子半径为a nm,则该铁晶体的密度为___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
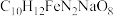 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下: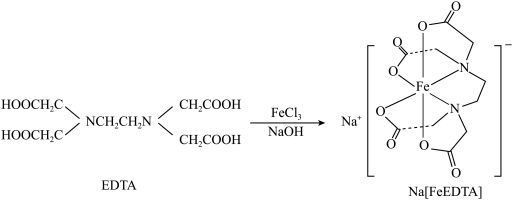
(1)基态氯原子的价层电子排布图为
(2)下列氮原子能量最高的是___________(填标号)。
A. | B. | C. | D.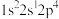 |
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为
 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2023-04-23更新
|
900次组卷
|
8卷引用:北京市首都师范大学附属中学2023-2024学年高三下学期3月月考化学试题
北京市首都师范大学附属中学2023-2024学年高三下学期3月月考化学试题福建省百校联盟2023届高三第三次模拟考试化学试题福建省百校联盟2023届高三下学期第三次模拟考试化学试题(已下线)押题密卷 02-【热题狂飙】2023年高考化学样卷(全国卷专用)广西壮族自治区南宁市第二中学2023届高三下学期收网考理科综合化学试题(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)2023届广西钦州市灵山县那隆中学高三下学期5月考前冲刺保温卷理综试卷-高中化学北京市第二中学2022-2023学年高二下学期期末考试化学试题
2 .  、
、 、
、 、
、 、
、 、
、 是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。 的焰色试验为黄色,且
的焰色试验为黄色,且 为化合物,回答下列问题:
为化合物,回答下列问题:
1. 与
与 反应的离子方程式为
反应的离子方程式为_______ 。
2.若 为强还原性的非金属单质,通常为黑色粉末,则
为强还原性的非金属单质,通常为黑色粉末,则 的电子式为
的电子式为_______ 。
3.若 为一种造成温室效应的气体,则鉴别等浓度的
为一种造成温室效应的气体,则鉴别等浓度的 、
、 溶液,可选择的试剂为_______。
溶液,可选择的试剂为_______。
4.若 为
为 ,则
,则 与
与 反应的化学方程式为
反应的化学方程式为_______ ,并写出 的一种用途
的一种用途_______ 。
若 为黄绿色气体单质,具有很强的氧化性。
为黄绿色气体单质,具有很强的氧化性。
5.组成物质 的元素在元素周期表中的位置是
的元素在元素周期表中的位置是_______ 。
6. 的水溶液放置一段时间后,溶液的酸性
的水溶液放置一段时间后,溶液的酸性_______ (填“增强”、“减弱”或“不变”)。
7.若 为强电解质,则
为强电解质,则 可能为_______。
可能为_______。
8.请写出 与冷的石灰乳反应的化学方程式:
与冷的石灰乳反应的化学方程式:_______ 。
 、
、 、
、 、
、 、
、 、
、 是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。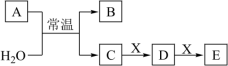
 的焰色试验为黄色,且
的焰色试验为黄色,且 为化合物,回答下列问题:
为化合物,回答下列问题:1.
 与
与 反应的离子方程式为
反应的离子方程式为2.若
 为强还原性的非金属单质,通常为黑色粉末,则
为强还原性的非金属单质,通常为黑色粉末,则 的电子式为
的电子式为3.若
 为一种造成温室效应的气体,则鉴别等浓度的
为一种造成温室效应的气体,则鉴别等浓度的 、
、 溶液,可选择的试剂为_______。
溶液,可选择的试剂为_______。| A.酚酞溶液 | B. 溶液 溶液 | C. 溶液 溶液 | D. 溶液 溶液 |
 为
为 ,则
,则 与
与 反应的化学方程式为
反应的化学方程式为 的一种用途
的一种用途若
 为黄绿色气体单质,具有很强的氧化性。
为黄绿色气体单质,具有很强的氧化性。5.组成物质
 的元素在元素周期表中的位置是
的元素在元素周期表中的位置是6.
 的水溶液放置一段时间后,溶液的酸性
的水溶液放置一段时间后,溶液的酸性7.若
 为强电解质,则
为强电解质,则 可能为_______。
可能为_______。A. | B. | C. | D. |
 与冷的石灰乳反应的化学方程式:
与冷的石灰乳反应的化学方程式:
您最近一年使用:0次
3 . A、B、C、D、E、X是中学化学中常见的无机物,且均由短周期元素组成,存在如图转化关系(部分生成物和反应条件略去)。
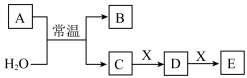
(1)若A为非金属单质,X为黑色粉末状非金属单质,回答下列问题:
①B的电子式为_______ ,D的结构式为_______ 。
②B的水溶液常用塑料瓶保存,不能用玻璃试剂瓶,理由是_______ (用化学方程式表示)。
(2)若A为一种淡黄色的固体化合物,回答下列问题:
①X可以是含铝的盐溶液,则向D溶液中通入足量的 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ ,写出E的一种用途_______ 。
②X可以是造成酸雨的成分之一,测得 溶液呈酸性,其原因是
溶液呈酸性,其原因是_______ 。
(3)若A为白色固体化合物,C的分子空间构型为三角锥型,则:
①组成物质A的非金属元素在元素周期表中的位置是_______ 。
②下列说法正确的是_______ (填字母)。
a.C物质是电解质 b.E可用NaOH溶液进行吸收处理
c.B化学性质稳定,高温下难以分解 d.C与 反应的氧化产物可能不止一种
反应的氧化产物可能不止一种

(1)若A为非金属单质,X为黑色粉末状非金属单质,回答下列问题:
①B的电子式为
②B的水溶液常用塑料瓶保存,不能用玻璃试剂瓶,理由是
(2)若A为一种淡黄色的固体化合物,回答下列问题:
①X可以是含铝的盐溶液,则向D溶液中通入足量的
 ,发生反应的离子方程式为
,发生反应的离子方程式为②X可以是造成酸雨的成分之一,测得
 溶液呈酸性,其原因是
溶液呈酸性,其原因是(3)若A为白色固体化合物,C的分子空间构型为三角锥型,则:
①组成物质A的非金属元素在元素周期表中的位置是
②下列说法正确的是
a.C物质是电解质 b.E可用NaOH溶液进行吸收处理
c.B化学性质稳定,高温下难以分解 d.C与
 反应的氧化产物可能不止一种
反应的氧化产物可能不止一种
您最近一年使用:0次
解题方法
4 . 将钛铁矿( )、磷灰石矿
)、磷灰石矿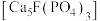 与锂灰石矿三矿耦合,按“原子经济”的绿色工艺技术路线生产磷酸铁锂,同时充分利用伴生元素。工艺流程如图。
与锂灰石矿三矿耦合,按“原子经济”的绿色工艺技术路线生产磷酸铁锂,同时充分利用伴生元素。工艺流程如图。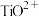 ;
;
②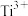 溶液为紫色;常温时,有关电对的电极电势
溶液为紫色;常温时,有关电对的电极电势
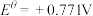 ;
;
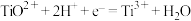
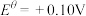 。一般标准电极电势越高,氧化剂的氧化性越强。
。一般标准电极电势越高,氧化剂的氧化性越强。
③25℃时,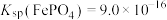 。
。
回答下列问题:
(1)Ti在元素周期表中的位置为______ 。“试剂X”为______ (填化学式)。
(2)“酸解”反应的化学方程式为______ 。
(3)“水解”过程中通过观察溶液保持紫色,判断无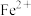 被氧化,该方法的依据是
被氧化,该方法的依据是______ 。
(4)循环利用“滤液2”的操作单元名称为______ 。“气体1”为______ (填化学式)。
(5)“沉淀”反应的化学方程式为______ 。若将铁离子恰好沉淀完全(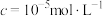 )时,
)时,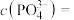
______  。
。
 )、磷灰石矿
)、磷灰石矿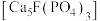 与锂灰石矿三矿耦合,按“原子经济”的绿色工艺技术路线生产磷酸铁锂,同时充分利用伴生元素。工艺流程如图。
与锂灰石矿三矿耦合,按“原子经济”的绿色工艺技术路线生产磷酸铁锂,同时充分利用伴生元素。工艺流程如图。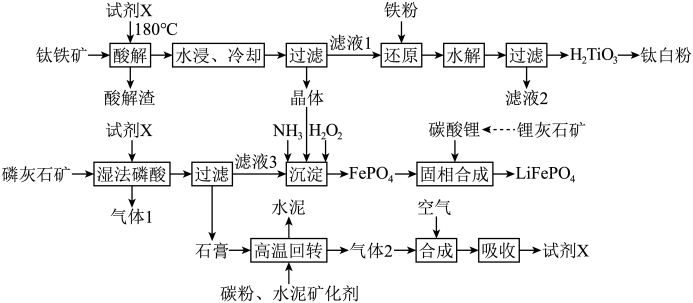
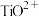 ;
;②
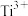 溶液为紫色;常温时,有关电对的电极电势
溶液为紫色;常温时,有关电对的电极电势
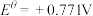 ;
;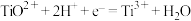
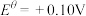 。一般标准电极电势越高,氧化剂的氧化性越强。
。一般标准电极电势越高,氧化剂的氧化性越强。③25℃时,
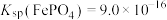 。
。回答下列问题:
(1)Ti在元素周期表中的位置为
(2)“酸解”反应的化学方程式为
(3)“水解”过程中通过观察溶液保持紫色,判断无
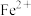 被氧化,该方法的依据是
被氧化,该方法的依据是(4)循环利用“滤液2”的操作单元名称为
(5)“沉淀”反应的化学方程式为
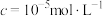 )时,
)时,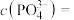
 。
。
您最近一年使用:0次
解题方法
5 . 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。
Ⅰ.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:________ (填字母)。
a.ⅰ中,C做还原剂 b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸 d.元素的电负性C>Si
(2)ⅱ中,1molSi与3molHCl反应转移4mole-。
①SiHCl3中,H的化合价为________ ,电负性Si________ H(填“>”或“<”)。
②该反应的化学方程式为________ 。
(3)ⅲ中,利用物质沸点差异,可直接实现高纯硅与SiHCl3的分离,从晶体类型角度解释其原因:________ 。
Ⅱ.第二代电池的光电转换材料是一种无机物薄膜,其光电转化率高于单晶硅。
科学家在元素周期表中Si的附近寻找到元素Ga和As(它们在周期表中的位置如图),并制成它们的化合物薄膜,其晶体结构类似单晶硅。
(4)写出基态Ga原子价层电子排布式________ 。
(5)As的第一电离能比Se大的主要原因是:________________ 。
(6)下图为砷化镓晶胞示意图,写出其化学式________ 。
Ⅰ.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:
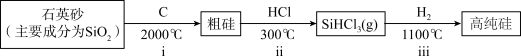
a.ⅰ中,C做还原剂 b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸 d.元素的电负性C>Si
(2)ⅱ中,1molSi与3molHCl反应转移4mole-。
①SiHCl3中,H的化合价为
②该反应的化学方程式为
(3)ⅲ中,利用物质沸点差异,可直接实现高纯硅与SiHCl3的分离,从晶体类型角度解释其原因:
Ⅱ.第二代电池的光电转换材料是一种无机物薄膜,其光电转化率高于单晶硅。
科学家在元素周期表中Si的附近寻找到元素Ga和As(它们在周期表中的位置如图),并制成它们的化合物薄膜,其晶体结构类似单晶硅。
| Si | |||
| Ga | As | Se |
(4)写出基态Ga原子价层电子排布式
(5)As的第一电离能比Se大的主要原因是:
(6)下图为砷化镓晶胞示意图,写出其化学式
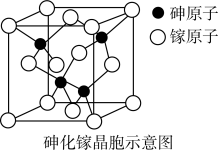
您最近一年使用:0次
名校
6 . 钒属于稀有金属,在天然矿物中含量很低。从硫酸厂废弃的钒触媒(主要成分为 、
、 、
、 、
、 )中回收
)中回收 的流程如图所示。
的流程如图所示。
(1)V元素在元素周期表中的位置为___________ 。
(2)“活化焙烧”的目的是使 转化为
转化为 。已知反应过程中
。已知反应过程中 能被
能被 氧化生成
氧化生成 ,
, 自身分解也可以生成
自身分解也可以生成 ,则该步骤所得尾气中硫元素的主要存在形式有
,则该步骤所得尾气中硫元素的主要存在形式有___________ (填化学式)。
(3)常温下稀 溶液的pH
溶液的pH___________ 7(填“>”“<”或“=”,已知 的
的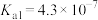 ,
, ,
, 的
的 )。“浸出”步骤中有
)。“浸出”步骤中有 生成,写出该步骤中
生成,写出该步骤中 转化为
转化为 的离子方程式
的离子方程式___________ 。“活化焙烧”时可能有少量的 未完全转化,推测“浸出”步骤中加入少量
未完全转化,推测“浸出”步骤中加入少量 的主要作用是
的主要作用是___________ 。
(4)“浓缩”后,溶液中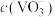 的浓度为0.2mo/L,“沉钒”步骤中钒元素的沉降率为98%,则沉钒后溶液中
的浓度为0.2mo/L,“沉钒”步骤中钒元素的沉降率为98%,则沉钒后溶液中
___________ mol/L[ ,假设沉钒过程中溶液体积不变]。
,假设沉钒过程中溶液体积不变]。
(5)含钒离子在储能领域应用广泛。如图所示的全钒液储能电池装置可实现化学能和电能相互转化,该装置储能时电势高的电极的电极反应式为___________ ,若储能时转移2mol电子,则正极液储罐中 的净变化为
的净变化为___________ mol。
 、
、 、
、 、
、 )中回收
)中回收 的流程如图所示。
的流程如图所示。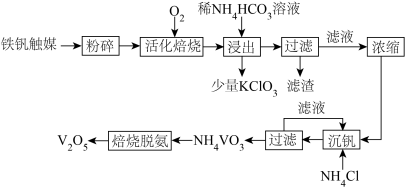
(1)V元素在元素周期表中的位置为
(2)“活化焙烧”的目的是使
 转化为
转化为 。已知反应过程中
。已知反应过程中 能被
能被 氧化生成
氧化生成 ,
, 自身分解也可以生成
自身分解也可以生成 ,则该步骤所得尾气中硫元素的主要存在形式有
,则该步骤所得尾气中硫元素的主要存在形式有(3)常温下稀
 溶液的pH
溶液的pH 的
的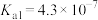 ,
, ,
, 的
的 )。“浸出”步骤中有
)。“浸出”步骤中有 生成,写出该步骤中
生成,写出该步骤中 转化为
转化为 的离子方程式
的离子方程式 未完全转化,推测“浸出”步骤中加入少量
未完全转化,推测“浸出”步骤中加入少量 的主要作用是
的主要作用是(4)“浓缩”后,溶液中
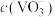 的浓度为0.2mo/L,“沉钒”步骤中钒元素的沉降率为98%,则沉钒后溶液中
的浓度为0.2mo/L,“沉钒”步骤中钒元素的沉降率为98%,则沉钒后溶液中
 ,假设沉钒过程中溶液体积不变]。
,假设沉钒过程中溶液体积不变]。(5)含钒离子在储能领域应用广泛。如图所示的全钒液储能电池装置可实现化学能和电能相互转化,该装置储能时电势高的电极的电极反应式为
 的净变化为
的净变化为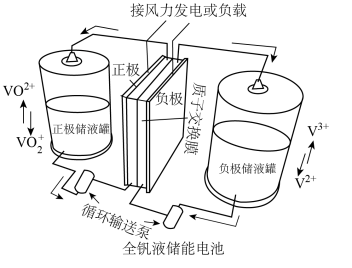
您最近一年使用:0次
2024-05-27更新
|
43次组卷
|
2卷引用:2024届甘肃省民乐县第一中学高三下学期5月模拟考试化学试卷
7 . 硒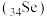 是一种应用广泛的元素。
是一种应用广泛的元素。
Ⅰ.检测细胞体内的
风湿性关节炎与细胞体内产生的 有关。一种含
有关。一种含 的荧光探针分子
的荧光探针分子 检测
检测 及再生的转化如图。
及再生的转化如图。 位于元素周期表中
位于元素周期表中_____________ 区(填“ ”“
”“ ”“
”“ ”或“
”或“ ”)。
”)。
② 的结构式是
的结构式是_____________ 。
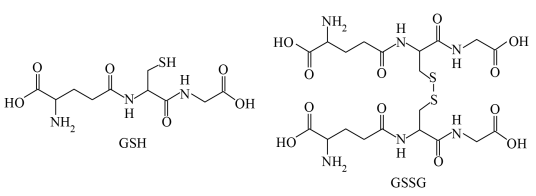
(2)在 中,
中, 转化为
转化为 。
。 ”在
”在 中标出所有的手性碳原子
中标出所有的手性碳原子__________ 。
② 中,
中, 与
与 的物质的量之比为
的物质的量之比为_________________ 。
Ⅱ.应用于光电领域
 可作为新型镁电池的正极材料,其晶胞结构如图所示。
可作为新型镁电池的正极材料,其晶胞结构如图所示。_________________ 。
②晶胞中“ ”表示
”表示_________________ (填离子符号)。
(4)新型镁电池放电时,图1晶胞中 位置不变,
位置不变, 嵌入的同时
嵌入的同时 被挤出。生成的
被挤出。生成的 晶体结构与
晶体结构与 晶体相似,其中
晶体相似,其中 位于图1晶胞的
位于图1晶胞的_____________________ (填序号)。
 .棱心
.棱心  .面心
.面心  .体心
.体心  .顶点
.顶点
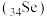 是一种应用广泛的元素。
是一种应用广泛的元素。Ⅰ.检测细胞体内的

风湿性关节炎与细胞体内产生的
 有关。一种含
有关。一种含 的荧光探针分子
的荧光探针分子 检测
检测 及再生的转化如图。
及再生的转化如图。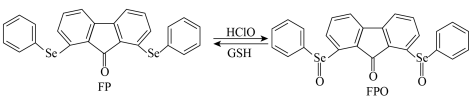
 位于元素周期表中
位于元素周期表中 ”“
”“ ”“
”“ ”或“
”或“ ”)。
”)。②
 的结构式是
的结构式是(2)在
 中,
中, 转化为
转化为 。
。
 ”在
”在 中标出所有的手性碳原子
中标出所有的手性碳原子②
 中,
中,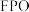 与
与 的物质的量之比为
的物质的量之比为Ⅱ.应用于光电领域
 可作为新型镁电池的正极材料,其晶胞结构如图所示。
可作为新型镁电池的正极材料,其晶胞结构如图所示。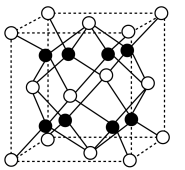
②晶胞中“
 ”表示
”表示(4)新型镁电池放电时,图1晶胞中
 位置不变,
位置不变, 嵌入的同时
嵌入的同时 被挤出。生成的
被挤出。生成的 晶体结构与
晶体结构与 晶体相似,其中
晶体相似,其中 位于图1晶胞的
位于图1晶胞的 .棱心
.棱心  .面心
.面心  .体心
.体心  .顶点
.顶点
您最近一年使用:0次
8 . 铟(In)是制造半导体、电光源等的重要原料,广泛用于航空航天、光电信息、太阳能电池等领域,从铜冶炼过程中产生的铟砷烟灰(主要成分为难溶于水的 、
、 ,还含有ZnO、PbO、
,还含有ZnO、PbO、 、
、 等杂质)中提取锢的流程如下图所示
等杂质)中提取锢的流程如下图所示 价离子形式存在;
价离子形式存在;
②萃取剂可以用 表示,可在酸性溶液中萃取
表示,可在酸性溶液中萃取 价的金属离子
价的金属离子
回答下列问题:
(1)铟在元素周期表中的位置为___________ 。
(2)氧化酸浸过程中,硫元素被氧化为最高化合价,写出发生此转化反应的离子方程式:___________ 。
(3)还原铁步骤的目的是___________ 。
(4)实验室进行萃取操作时首先需要___________ ,萃取时若温度过高会使萃取剂挥发过快,造成的不利影响是___________ 。
(5)萃取过程中发生的主要反应为 ,则反萃取时需要加入的试剂为
,则反萃取时需要加入的试剂为___________ (填名称)。
(6)已知置换步骤会产生易燃易爆性气体单质,写出该步骤的化学方程式___________ ,置换后所得的粗铟需要洗涤,检验其已洗净的操作和现象为___________ 。
 、
、 ,还含有ZnO、PbO、
,还含有ZnO、PbO、 、
、 等杂质)中提取锢的流程如下图所示
等杂质)中提取锢的流程如下图所示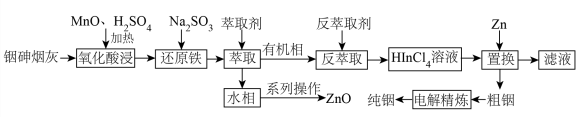
 价离子形式存在;
价离子形式存在;②萃取剂可以用
 表示,可在酸性溶液中萃取
表示,可在酸性溶液中萃取 价的金属离子
价的金属离子回答下列问题:
(1)铟在元素周期表中的位置为
(2)氧化酸浸过程中,硫元素被氧化为最高化合价,写出发生此转化反应的离子方程式:
(3)还原铁步骤的目的是
(4)实验室进行萃取操作时首先需要
(5)萃取过程中发生的主要反应为
 ,则反萃取时需要加入的试剂为
,则反萃取时需要加入的试剂为(6)已知置换步骤会产生易燃易爆性气体单质,写出该步骤的化学方程式
您最近一年使用:0次
9 . 上海有机化学研究所施世良课题组以Ni(cod)2为催化剂实现了叔醇的手性合成。
(1)Ni在元素周期表中的位置是___________ ,写出其基态原子的最外层电子排布图:___________ 。
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。___________ 种。
②Ni(cod)2分子内存在的作用力有___________ (填序号)。
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
(3)葡萄糖(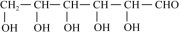 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 ___________ 。
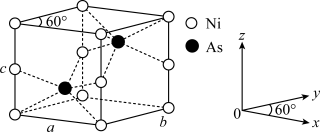
(4)红银矿NiAs晶体结构如图所示:___________ 。
②两个As原子的原子分数坐标依次为( ,
, ,
, )和
)和___________ 。
③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为___________ mol-1(用含m、n和p的代数式表示)。
(1)Ni在元素周期表中的位置是
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。
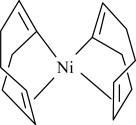
②Ni(cod)2分子内存在的作用力有
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
(3)葡萄糖(
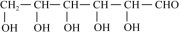 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 (4)红银矿NiAs晶体结构如图所示:
②两个As原子的原子分数坐标依次为(
 ,
, ,
, )和
)和③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为
您最近一年使用:0次
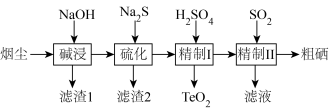
10 . 工业上利用冶炼烟尘(主要成分TeO2、SeO2、PbO、Au、Ag等)回收Se、TeO2的工艺流程如下:
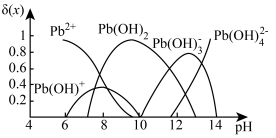
已知:①水溶液中各形态铅的分布系数 (x)与溶液pH的关系如图所示。
(x)与溶液pH的关系如图所示。
②SeO2是酸性氧化物,TeO2、PbO是两性氧化物。回答下列问题:
(1)Se在元素周期表中的位置为__ 。
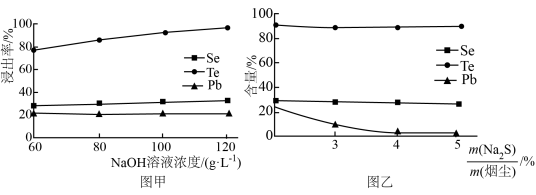
(2)碱浸时,NaOH溶液对元素浸出率的影响如图甲所示,实际生产中所用NaOH溶液的浓度为__ 100g/L,浓度不能过大的原因是__ ;硫化时,Na2S加入量对元素含量的影响如图乙所示,反应的离子方程式为__ 。
(3)精制1时控制pH范围为5.5~6.5,pH过低导致TeO2中会混有Se和黄色固体杂质,原因是__ (用离子方程式表示),pH过低还会导致沉磅率降低的原因是__ 。
(4)精制Ⅱ后的滤液可循环使用,应当导入到__ 操作中(填操作单元的名称)。
(5)测定粗硒样品中硒的含量:称量0.2500g粗硒样品,用浓H2SO4将样品中的Se氧化得到SeO2,生成的SeO2加入硫酸酸化的KI溶液中充分反应,加入淀粉溶液,用0.4000mol/L的Na2S2O3标准溶液滴定至终点时消耗20.00mL(杂质不参与反应)。则粗硒样品中硒的质量分数为__ 。测定原理为:SeO2+4I-+4H+=Se+2I2+2H2O;I2+2S2O =2I-+S4O
=2I-+S4O

已知:①水溶液中各形态铅的分布系数
 (x)与溶液pH的关系如图所示。
(x)与溶液pH的关系如图所示。
②SeO2是酸性氧化物,TeO2、PbO是两性氧化物。回答下列问题:
(1)Se在元素周期表中的位置为
(2)碱浸时,NaOH溶液对元素浸出率的影响如图甲所示,实际生产中所用NaOH溶液的浓度为

(3)精制1时控制pH范围为5.5~6.5,pH过低导致TeO2中会混有Se和黄色固体杂质,原因是
(4)精制Ⅱ后的滤液可循环使用,应当导入到
(5)测定粗硒样品中硒的含量:称量0.2500g粗硒样品,用浓H2SO4将样品中的Se氧化得到SeO2,生成的SeO2加入硫酸酸化的KI溶液中充分反应,加入淀粉溶液,用0.4000mol/L的Na2S2O3标准溶液滴定至终点时消耗20.00mL(杂质不参与反应)。则粗硒样品中硒的质量分数为
 =2I-+S4O
=2I-+S4O
您最近一年使用:0次



