名校
解题方法
1 . 双水杨醛缩乙二胺合钴(Ⅱ)具有可逆载能力,能模拟金属蛋白的载原理,用于有机催化氧化反应,其结构简式为: 。先将双水杨醛缩乙二胺合钴(Ⅱ)置丁氧气中至吸氧饱和制得载氧样品,再将
。先将双水杨醛缩乙二胺合钴(Ⅱ)置丁氧气中至吸氧饱和制得载氧样品,再将 载氧样品置于惰性气体环境中加热,使其吸收的氧气完全释放,用
载氧样品置于惰性气体环境中加热,使其吸收的氧气完全释放,用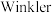 法测定该样品的载氧量(吸收氧气的量)。
法测定该样品的载氧量(吸收氧气的量)。
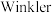 法实验的原理如下:
法实验的原理如下:
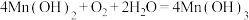

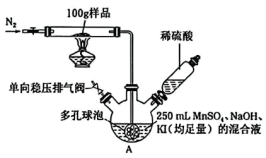
所用装置如图所示(夹持装置略去)。回答下列问题:
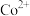 核外电子排布式为
核外电子排布式为(2)乙酸钴是制备双水杨醛缩乙二胺合钴(Ⅱ)的原料之一,可用金属钴、醋酸和
 溶液混合,在
溶液混合,在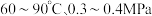 下合成,其反应原理用化学方程式表示为
下合成,其反应原理用化学方程式表示为(3)在加入
 载氧样品前,先通入一段时间的
载氧样品前,先通入一段时间的 ,加热样品后,还要继续通入氮气的目的是
,加热样品后,还要继续通入氮气的目的是 中多孔球泡的作用是
中多孔球泡的作用是(4)反应一段时间后,加入
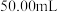 稀硫酸,使
稀硫酸,使 恰好转化为
恰好转化为 ,取出三颈烧瓶中的混合溶液
,取出三颈烧瓶中的混合溶液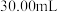 ,用
,用 的
的 标准溶液滴定,发生反应的离子方程式为:2
标准溶液滴定,发生反应的离子方程式为:2 +I2=
+I2= +2I-,当溶液呈浅黄色时,加入指示剂,再继续滴定至终点,消耗
+2I-,当溶液呈浅黄色时,加入指示剂,再继续滴定至终点,消耗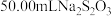 标准液(忽略溶液体积变化)。该滴定实验中指示剂的名称为
标准液(忽略溶液体积变化)。该滴定实验中指示剂的名称为 (标准状况)。
(标准状况)。
您最近一年使用:0次
2024-05-29更新
|
108次组卷
|
2卷引用:新疆乌鲁木齐地区2024年高三下学期第三次质量监测化学试题
2 . 某立方卤化物可用于制作光电材料,其晶胞结构如图所示。该晶胞在体对角线方向的投影为

A. | B. | C. | D.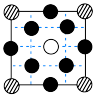 |
您最近一年使用:0次
2024-05-12更新
|
357次组卷
|
2卷引用:2024届新疆名校联盟高三下学期第二次质量联合监测理科综合试题-高中化学
3 . N-甲基咪唑的结构简式为: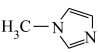 ,且4个碳原子和2个氮原子共平面,下列说法不正确的是
,且4个碳原子和2个氮原子共平面,下列说法不正确的是
| A.电负性:H<C<N<O |
B.咪唑分子中存在大π键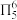 |
C.N-甲基咪唑分子中氮原子的杂化方式为 、 、 |
| D.N-甲基咪唑可以做配位体形成配位键 |
您最近一年使用:0次
2024-05-12更新
|
163次组卷
|
3卷引用:2024届新疆维吾尔自治区高三下学期三模考试理综试题-高中化学
解题方法
4 . 将CO、CO2转化为甲烷、甲醇、甲酸等有机物是实现“碳中和”重要途径。
Ⅰ.工业上利用H2与CO反应制甲烷,存在如下反应:
反应i:CO(g)+3H2(g)=CH4(g)+H2O(g) ∆H1=-206.2kJ/mol
反应ii:CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2=-41.2kJ/mol
反应iii:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ∆H3
回答下列问题:
(1)∆H3=___________ kJ/mol。
(2)一定温度下,在固定容积的容器中通入H2、CO发生上述反应,平衡时CO和H2的转化率及CH4和CO2的产率随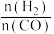 变化的情况如图所示,其中曲线b表示CO的转化率。
变化的情况如图所示,其中曲线b表示CO的转化率。___________ (填“升温”或“降温”)。
②图中表示H2转化率曲线是___________ (填标号)。
Ⅱ.用光电化学法将CO2还原为有机物实现碳资源的再生利用。电解装置和其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率随电解电压的变化如下图所示。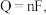 n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
(3)电解时,阴极生成HCOOH的电极反应式为___________ 。通过电解制备HCHO应选择电压为___________ V(填U1或U2)。
(4)当电解电压为U2V时,电解生成的HCOOH和HCHO的物质的量之比为3:2.则生成HCOOH的法拉第效率m为___________ 。
Ⅲ.工业上用CO2和H2催化合成甲醇存在如下反应:
主反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H<0
CH3OH(g)+H2O(g) ∆H<0
副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ∆H>0
(5)某温度下,在装有催化剂的密闭容器中投入1mol CO2和3mol H2,发生上述反应。达平衡时容器中CH3OH的物质的量为0.6mol,CO的物质的量为0.1mol。则此条件下副反应的平衡常数K=___________ 。(保留两位小数)
(6)已知CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ∆H<0,v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2)(k正、k逆分别为正、逆向反应速率常数)。该反应的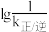 随温度变化的曲线如图所示,则
随温度变化的曲线如图所示,则___________ 表示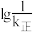 随温度变化的曲线,理由是
随温度变化的曲线,理由是___________ 。
Ⅰ.工业上利用H2与CO反应制甲烷,存在如下反应:
反应i:CO(g)+3H2(g)=CH4(g)+H2O(g) ∆H1=-206.2kJ/mol
反应ii:CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2=-41.2kJ/mol
反应iii:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ∆H3
回答下列问题:
(1)∆H3=
(2)一定温度下,在固定容积的容器中通入H2、CO发生上述反应,平衡时CO和H2的转化率及CH4和CO2的产率随
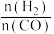 变化的情况如图所示,其中曲线b表示CO的转化率。
变化的情况如图所示,其中曲线b表示CO的转化率。
②图中表示H2转化率曲线是
Ⅱ.用光电化学法将CO2还原为有机物实现碳资源的再生利用。电解装置和其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率随电解电压的变化如下图所示。

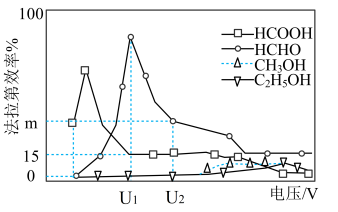
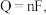 n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。(3)电解时,阴极生成HCOOH的电极反应式为
(4)当电解电压为U2V时,电解生成的HCOOH和HCHO的物质的量之比为3:2.则生成HCOOH的法拉第效率m为
Ⅲ.工业上用CO2和H2催化合成甲醇存在如下反应:
主反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H<0
CH3OH(g)+H2O(g) ∆H<0副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ∆H>0
(5)某温度下,在装有催化剂的密闭容器中投入1mol CO2和3mol H2,发生上述反应。达平衡时容器中CH3OH的物质的量为0.6mol,CO的物质的量为0.1mol。则此条件下副反应的平衡常数K=
(6)已知CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ∆H<0,v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2)(k正、k逆分别为正、逆向反应速率常数)。该反应的
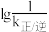 随温度变化的曲线如图所示,则
随温度变化的曲线如图所示,则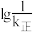 随温度变化的曲线,理由是
随温度变化的曲线,理由是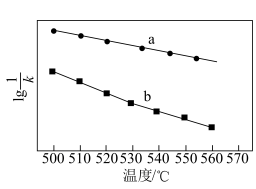
您最近一年使用:0次
5 . 按要求回答下列问题:
(1)消毒液的组成元素中,基态O原子的电子排布式是______ ,基态Cl原子未成对电子数为_____ 个。
(2)与氧元素相邻的氮元素的第一电离能的大小顺序为_______ (填元素符号),氧元素和氮元素的非金属性的大小顺序为________ (填元素符号)
(3)某元素原子的最外层电子构型为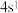 ,元素周期表的位置第
,元素周期表的位置第____ 周期,第_____ 族,它属于____ 区元素。
(1)消毒液的组成元素中,基态O原子的电子排布式是
(2)与氧元素相邻的氮元素的第一电离能的大小顺序为
(3)某元素原子的最外层电子构型为
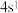 ,元素周期表的位置第
,元素周期表的位置第
您最近一年使用:0次
6 . 下表标出的是元素周期表的一部分元素,回答下列问题。
(1)写出A、B、C分别是什么物质填写化学符号___________ 。
(2)请比较J、I、H元素的非金属性比较从小到大比较___________ 。
(3)写出K元素的电子式___________ 。
(4)金属性最强的一元素是___________ 。
(5)请画出E原子结构示意图___________ 。
(6)请写出F的氧化物与烧碱的反应___________ 。
| 1 | ||||||||||||||||||
| 2 | A | B | C | |||||||||||||||
| 3 | D | E | F | G | H | I | J | K | ||||||||||
| 4 | M | |||||||||||||||||
(2)请比较J、I、H元素的非金属性比较从小到大比较
(3)写出K元素的电子式
(4)金属性最强的一元素是
(5)请画出E原子结构示意图
(6)请写出F的氧化物与烧碱的反应
您最近一年使用:0次
解题方法
7 . 回答下列问题。
(1)氢氧化亚铁与氧气、水的反应方程式为:___________ 。
(2)钠通常保存在___________ 中,加热时,钠可以在空气中燃烧发出___________ 火焰,生成___________ 色固体。
(3)写出氯气和水反应的化学方程式:___________ 。
(4)电离:电解质溶于水或受热熔化时,形成___________ 的过程。
(5) 、
、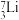 、
、 、
、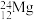 、
、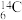 、
、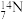 中,
中,___________ 和___________ 互为同位素,___________ 和___________ 的中子数相等,但质子数不等,所以不是同一种元素。
(6)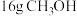 的物质的量是
的物质的量是___________ ,含H原子的数目为___________ 。
(1)氢氧化亚铁与氧气、水的反应方程式为:
(2)钠通常保存在
(3)写出氯气和水反应的化学方程式:
(4)电离:电解质溶于水或受热熔化时,形成
(5)
 、
、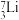 、
、 、
、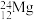 、
、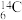 、
、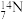 中,
中,(6)
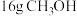 的物质的量是
的物质的量是
您最近一年使用:0次
8 . 绿色发展是新质生产力的内在要求,化学在绿色发展方面发挥着重要作用。下列有关叙述不正确的是
| A.推广使用煤炭、石油脱硫技术,可以减少酸雨 |
| B.推广碳捕集和储存技术,助力碳达峰、碳中和 |
| C.推广使用有机高分子材料石墨烯,让电池更轻薄、充电更快速 |
D.推广光触媒技术,将汽车尾气中的 和 和 转化为无毒气体 转化为无毒气体 |
您最近一年使用:0次
9 . 黄铁矿(FeS2)在工业上有着重要的用途,黄铁矿在空气中煅烧的反应为:4FeS2+11O2 2Fe2O3+8SO2,生成的SO2可用于生产Na2SO3和H2SO4。FeS2立方晶胞如图,其晶胞边长为a nm。下列有关说法不正确的是
2Fe2O3+8SO2,生成的SO2可用于生产Na2SO3和H2SO4。FeS2立方晶胞如图,其晶胞边长为a nm。下列有关说法不正确的是
 2Fe2O3+8SO2,生成的SO2可用于生产Na2SO3和H2SO4。FeS2立方晶胞如图,其晶胞边长为a nm。下列有关说法不正确的是
2Fe2O3+8SO2,生成的SO2可用于生产Na2SO3和H2SO4。FeS2立方晶胞如图,其晶胞边长为a nm。下列有关说法不正确的是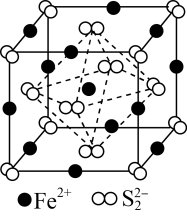
| A.FeS2中存在非极性共价键 |
B. 的空间构型为三角锥形 的空间构型为三角锥形 |
| C.SO2能使酸性高锰酸钾溶液褪色,说明SO2具有漂白性 |
D.晶胞中Fe2+位于S2-所形成的正八面体的体心,该正八面体的边长为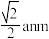 |
您最近一年使用:0次
10 . a.有下列物质:①氢氧化钡 ②KHSO4 ③液态HCl ④稀硫酸 ⑤二氧化碳 ⑥铜 ⑦碳酸钠 ⑧蔗糖
请回答下列问题:
(1)属于电解质的有___________ (填序号)
(2)属于非电解质的有___________ (填序号)
b.某同学用如下实验探究 、
、 的性质。请回答下列问题:
的性质。请回答下列问题:
(3)在FeCl3溶液中需加入少量铁屑,发生反应的化学方程式为___________ 。FeCl3溶液,加入1滴___________ 溶液,溶液变___________ 。
(4)FeCl2溶液与氯水反应的化学方程式为___________ 。
(5)某同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程___________ 。
c.请回答下列问题:
(6)0.5 mol H2O含有H的物质的量___________ mol。含有O数目___________ 。
(7)100 mL 0.2 mol/L Na2SO4溶液中 的物质的量浓度为
的物质的量浓度为___________ 。
(8)标准状况下11.2 L的CO2的物质的量是___________ mol。
请回答下列问题:
(1)属于电解质的有
(2)属于非电解质的有
b.某同学用如下实验探究
 、
、 的性质。请回答下列问题:
的性质。请回答下列问题:(3)在FeCl3溶液中需加入少量铁屑,发生反应的化学方程式为
(4)FeCl2溶液与氯水反应的化学方程式为
(5)某同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程
c.请回答下列问题:
(6)0.5 mol H2O含有H的物质的量
(7)100 mL 0.2 mol/L Na2SO4溶液中
 的物质的量浓度为
的物质的量浓度为(8)标准状况下11.2 L的CO2的物质的量是
您最近一年使用:0次



