2024高三下·全国·专题练习
解题方法
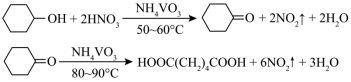
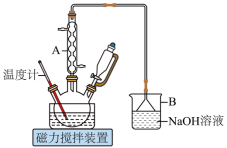
1 . 1,6己二酸是常用的化工原料,在高分子材料、医药、润滑剂的制造等方面都有重要作用。实验室利用图中的装置(夹持装置已省略),以环己醇和硝酸为反应物制备1,6己二酸。反应原理为:
实验步骤如下:
Ⅰ.向三颈烧瓶中加入0.03gNH4VO3固体和18mL浓HNO3(略过量),向恒压滴液漏斗中加入6mL环己醇
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60℃之间,直至环己醇全部滴加完毕
Ⅲ.将三颈烧瓶放入80~90℃水浴中加热10min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,___________,干燥,得到粗产品
Ⅳ.1,6-己二酸粗产品的提纯
(1)将步骤Ⅲ补充完整:_______ 。步骤Ⅳ提纯方法的名称为_______ 。如图为1,6己二酸在水中的溶解度曲线,80℃时1,6-己二酸水溶液的密度为ρg·mL-1;该溶液的物质的量浓度为_______ 。
| 试剂 | 相对分子质量 | 密度/(g·mL-1) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 环己醇 | 100 | 0.962 | 25.9 | 161.8 | 可溶于水、乙醇、乙醚 |
| 1,6-己二酸 | 146 | 1.360 | 152 | 330.5 | 微溶于冷水,易溶于乙醇 |
| NH4VO3 | 117 | 2.326 | 210(分解) | — | 微溶于冷水,易溶于热水 |
Ⅰ.向三颈烧瓶中加入0.03gNH4VO3固体和18mL浓HNO3(略过量),向恒压滴液漏斗中加入6mL环己醇
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60℃之间,直至环己醇全部滴加完毕
Ⅲ.将三颈烧瓶放入80~90℃水浴中加热10min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,___________,干燥,得到粗产品
Ⅳ.1,6-己二酸粗产品的提纯
(1)将步骤Ⅲ补充完整:

| A.46.07% | B.57.08% | C.63.03% | D.74.61% |
您最近半年使用:0次
2024·北京西城·一模
解题方法
2 . 下列反应的离子方程式书写正确的是
A. 溶液与醋酸溶液反应: 溶液与醋酸溶液反应: |
B. 溶液与 溶液与 溶液反应: 溶液反应: |
C.电解饱和食盐水: |
D.向 溶液中通入过量的 溶液中通入过量的 : : |
您最近半年使用:0次
2024·贵州贵阳·一模
名校
解题方法
3 . 六方硫化锌的结构是S原子作六方最密堆积,其晶胞如图所示,图中A点分数坐标为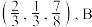 点分数坐标为
点分数坐标为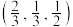 ;底
;底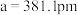 ,高
,高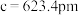 。设
。设 为阿伏加德罗常数的值。下列说法
为阿伏加德罗常数的值。下列说法错误 的是
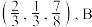 点分数坐标为
点分数坐标为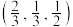 ;底
;底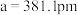 ,高
,高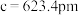 。设
。设 为阿伏加德罗常数的值。下列说法
为阿伏加德罗常数的值。下列说法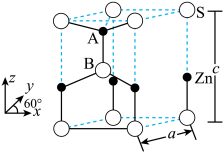
A.晶胞中, 填充空隙类型为正四面体空隙 填充空隙类型为正四面体空隙 | B.图中S原子的配位数为6 |
C.图中 的核间距约为 的核间距约为 | D.该晶体的化学式为 |
您最近半年使用:0次
2024-05-06更新
|
534次组卷
|
4卷引用:题型5 物质结构与性质 有机物的结构与性质(25题)-2024年高考化学常考点必杀300题(新高考通用)
(已下线)题型5 物质结构与性质 有机物的结构与性质(25题)-2024年高考化学常考点必杀300题(新高考通用)贵州省贵阳市第六中学2024届高三下学期一模考试化学试题浙江省舟山中学2023-2024学年高二下学期4月月考化学试题河南省焦作市博爱县第一中2023-2024学年高二下学期4月期中考试化学试题
2024高三·全国·专题练习
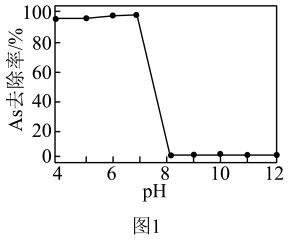
4 . 以Fe(NO3)3作为铁源制备高铁酸钾(K2FeO4),可用于去除水体中的As( )。已知:K2FeO4微溶于水,在酸性或中性溶液中迅速氧化H2O产生O2,在碱性溶液中较稳定,在Fe3+和Fe(OH)3催化作用下发生分解。
)。已知:K2FeO4微溶于水,在酸性或中性溶液中迅速氧化H2O产生O2,在碱性溶液中较稳定,在Fe3+和Fe(OH)3催化作用下发生分解。
(1)制备高铁酸钾。
向KOH和KClO混合溶液中加入Fe(NO3)3,过滤得到K2FeO4固体。
① 制备K2FeO4的化学方程式为___________ 。
② 过滤所得的滤液中加入稀硫酸产生Cl2,原因可能是酸性条件下K2FeO4氧化了Cl-,还可能是___________ 。
(2)测定 K2FeO4的纯度。
准确称取0.528 0 g K2FeO4样品置于锥形瓶中,用KOH溶液溶解,加入过量KCr(OH)4溶液,再加入硫酸酸化配成待测液,用0.3000 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准液20.00 mL,计算样品中K2FeO4的纯度___________ (写出计算过程)。
测定过程中涉及的离子反应有(未配平):Cr(OH) +FeO
+FeO →Fe(OH)3+CrO
→Fe(OH)3+CrO +OH-;CrO
+OH-;CrO +H+→Cr2O
+H+→Cr2O +H2O;Cr2O
+H2O;Cr2O +Fe2++H+→Cr3++Fe3++H2O。
+Fe2++H+→Cr3++Fe3++H2O。
(3)K2FeO4的应用。
某水样中As元素主要以As( )存在,As(
)存在,As( )可被K2FeO4氧化为As(
)可被K2FeO4氧化为As( ),再通过Fe(
),再通过Fe( )吸附去除。
)吸附去除。
①K2FeO4对水中As元素的去除率随pH变化如图1所示,当pH大于7时,As去除率迅速下降的原因是___________ 。___________ 。 ,纳米铁还原废水中NO
,纳米铁还原废水中NO 的可能反应机理如图3所示。
的可能反应机理如图3所示。 的过程可描述为
的过程可描述为___________ 。
②经检验,污水经处理后,水体中NO 、NO
、NO 浓度很小,但水中总氮浓度下降不明显,原因是
浓度很小,但水中总氮浓度下降不明显,原因是___________ 。
 )。已知:K2FeO4微溶于水,在酸性或中性溶液中迅速氧化H2O产生O2,在碱性溶液中较稳定,在Fe3+和Fe(OH)3催化作用下发生分解。
)。已知:K2FeO4微溶于水,在酸性或中性溶液中迅速氧化H2O产生O2,在碱性溶液中较稳定,在Fe3+和Fe(OH)3催化作用下发生分解。(1)制备高铁酸钾。
向KOH和KClO混合溶液中加入Fe(NO3)3,过滤得到K2FeO4固体。
① 制备K2FeO4的化学方程式为
② 过滤所得的滤液中加入稀硫酸产生Cl2,原因可能是酸性条件下K2FeO4氧化了Cl-,还可能是
(2)测定 K2FeO4的纯度。
准确称取0.528 0 g K2FeO4样品置于锥形瓶中,用KOH溶液溶解,加入过量KCr(OH)4溶液,再加入硫酸酸化配成待测液,用0.3000 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准液20.00 mL,计算样品中K2FeO4的纯度
测定过程中涉及的离子反应有(未配平):Cr(OH)
 +FeO
+FeO →Fe(OH)3+CrO
→Fe(OH)3+CrO +OH-;CrO
+OH-;CrO +H+→Cr2O
+H+→Cr2O +H2O;Cr2O
+H2O;Cr2O +Fe2++H+→Cr3++Fe3++H2O。
+Fe2++H+→Cr3++Fe3++H2O。(3)K2FeO4的应用。
某水样中As元素主要以As(
 )存在,As(
)存在,As( )可被K2FeO4氧化为As(
)可被K2FeO4氧化为As(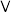 ),再通过Fe(
),再通过Fe( )吸附去除。
)吸附去除。①K2FeO4对水中As元素的去除率随pH变化如图1所示,当pH大于7时,As去除率迅速下降的原因是
 ,纳米铁还原废水中NO
,纳米铁还原废水中NO 的可能反应机理如图3所示。
的可能反应机理如图3所示。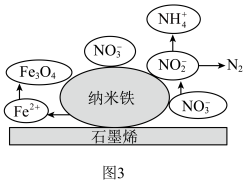
 的过程可描述为
的过程可描述为②经检验,污水经处理后,水体中NO
 、NO
、NO 浓度很小,但水中总氮浓度下降不明显,原因是
浓度很小,但水中总氮浓度下降不明显,原因是
您最近半年使用:0次
2024高三·全国·专题练习
解题方法
5 . 碳酸锰(MnCO3)是制造高性能磁性材料的主要原料。实验室以KMnO4为原料制备少量MnCO3并研究其性质,制备MnCO3的装置如图1所示。已知: MnCO3难溶于水、乙醇,100 ℃开始分解,在潮湿环境下易被氧化。
(1)选用仪器B、C的目的是___________ 。
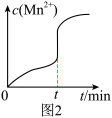
(2)在烧瓶中加入一定量的KMnO4固体,滴加硫酸酸化的H2C2O4溶液,其反应的离子方程式为___________ 。 反应过程中c(Mn2+)随时间的变化曲线如图2所示,则t min时,c(Mn2+)迅速增大的原因是___________ 。___________ 。
(4)实验结束后,将装置A中的混合物过滤,用乙醇洗涤滤渣,再___________ ,即得到干燥的MnCO3固体。用乙醇洗涤的优点是___________ 。
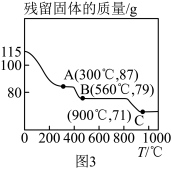
(5)在空气中加热MnCO3固体,随着温度的升高,残留固体的质量变化如图3所示。则A点的成分为___________ (填化学式);B→C反应的化学方程式为___________ 。
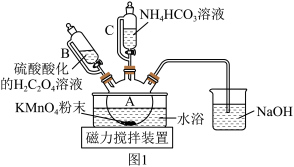
(1)选用仪器B、C的目的是
(2)在烧瓶中加入一定量的KMnO4固体,滴加硫酸酸化的H2C2O4溶液,其反应的离子方程式为
(4)实验结束后,将装置A中的混合物过滤,用乙醇洗涤滤渣,再
(5)在空气中加热MnCO3固体,随着温度的升高,残留固体的质量变化如图3所示。则A点的成分为
您最近半年使用:0次
2024高三·全国·专题练习
6 . 稀有金属元素铼(Re)和锰同族,铼和钛是航天工程不可缺少的材料。某烟道灰的主要成分为Re2O7、TiO2、SiO2、CuO、 Fe2O3,从中提取铼粉和钛的流程如图所示: 被Zn还原为+4价的铼。ZnO为两性氧化物,溶于碱生成ZnO
被Zn还原为+4价的铼。ZnO为两性氧化物,溶于碱生成ZnO 。
。
回答下列问题:
(1)“碱浸”过程Re2O7、SiO2分别发生反应的离子方程式为___________ 、___________ 。
(2)“氧化溶解”过程中Re(OH)4转化为ReO ,该反应中还原剂与氧化剂的物质的量之比为
,该反应中还原剂与氧化剂的物质的量之比为___________ 。
(3)“酸溶”过程得到的钛在溶液中以TiO2+形式存在,其“水解”反应的离子方程式为___________ 。
(4)“转化”过程中加入Fe的作用是___________ ;所得晶体主要成分的化学式中含有7个结晶水,其化学式是___________ 。
(5)“冶钛”过程中将TiO2先转化为TiCl4,再用Mg进行还原,写出高温条件下用Mg还原TiCl4的化学方程式:___________ 。
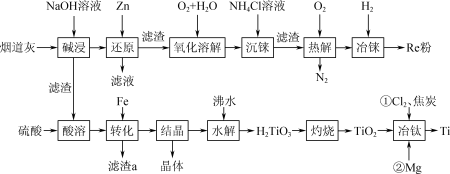
 被Zn还原为+4价的铼。ZnO为两性氧化物,溶于碱生成ZnO
被Zn还原为+4价的铼。ZnO为两性氧化物,溶于碱生成ZnO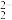 。
。回答下列问题:
(1)“碱浸”过程Re2O7、SiO2分别发生反应的离子方程式为
(2)“氧化溶解”过程中Re(OH)4转化为ReO
 ,该反应中还原剂与氧化剂的物质的量之比为
,该反应中还原剂与氧化剂的物质的量之比为(3)“酸溶”过程得到的钛在溶液中以TiO2+形式存在,其“水解”反应的离子方程式为
(4)“转化”过程中加入Fe的作用是
(5)“冶钛”过程中将TiO2先转化为TiCl4,再用Mg进行还原,写出高温条件下用Mg还原TiCl4的化学方程式:
您最近半年使用:0次
2024高三·全国·专题练习
解题方法
7 . 根据实验方案和现象,判断下列结论正确的是
| 选项 | 实验方案 | 现象 | 结论 |
| A | 将过量Cl2通入淀粉—碘化钾溶液中 | 溶液颜色最终未变蓝 | 说明Cl2不能氧化I- |
| B | 向0.1 mol·L-1 Na2S溶液中加入H2O2 | 产生淡黄色沉淀 | H2O2将S2-氧化为S |
| C | 在Ca(ClO)2溶液中通入SO2 | 产生白色沉淀 | 酸性:H2SO3>HClO |
| D | 用pH试纸分别测定1 mol·L-1的Na2S和1 mol·L-1的NaCl溶液的pH | 前者的试纸颜色比后者深 | 非金属性:S<Cl |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2024高三·全国·专题练习
8 . 电催化还原CO2转化为CH4的途径有两种,其原理如图所示。设NA为阿伏加德罗常数的值,下列说法正确的是

| A.22 g CO2中所含共用电子对的数目为4NA |
| B.1 mol CH4中所含质子数、电子数和中子数均为10NA |
| C.途径2生成标准状况下22.4 L CH4,反应转移的电子数为8NA |
| D.途径1所得产物的物质的量之比为1∶1,形成共价键的数目为6NA |
您最近半年使用:0次
2024高三·全国·专题练习
9 . 氢气是世界上已知密度最小的气体,也是自然界中最轻的气体,其具有可燃性、还原性、氧化性等化学性质。氢气不仅可以用于填充气球、治疗疾病,在工业上作氢化剂和还原剂,而且也是21世纪主要研究的一种新型的清洁能源,可以作为航空燃料或以燃料电池的方式为汽车提供动力。氢气可以通过电解水、水煤气、烃类转化法等方法制备。用氢气制备双氧水的一种工艺简单、能耗低的方法,其反应机理如图所示,已知钯(Pd)常以正二价形式存在。下列有关说法正确的是
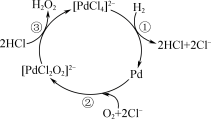
| A.反应过程中只存在极性键的断裂与形成 |
| B.反应①②③均为氧化还原反应 |
| C.反应②中有1 mol O2参与反应时转移电子的物质的量为4 mol |
D.制备的总反应式为H2+O2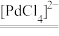 H2O2 H2O2 |
您最近半年使用:0次
2024高三·全国·专题练习
10 . 氢气是世界上已知密度最小的气体,也是自然界中最轻的气体,其具有可燃性、还原性、氧化性等化学性质。氢气不仅可以用于填充气球、治疗疾病,在工业上作氢化剂和还原剂,而且也是21世纪主要研究的一种新型的清洁能源,可以作为航空燃料或以燃料电池的方式为汽车提供动力。氢气可以通过电解水、水煤气、烃类转化法等方法制备。实验室常用锌粒与稀硫酸反应制取H2,其反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑,下列说法正确的是
A.中子数为2的H原子: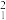 H H |
B.18O2-的结构示意图: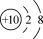 |
| C.ZnSO4含有离子键和共价键 |
D.该反应的离子方程式为Zn+H2SO4=Zn2++SO +H2↑ +H2↑ |
您最近半年使用:0次



