解题方法
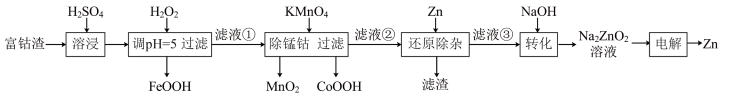
1 . 电解锌的生产过程中产生大量富钴渣,主要含金属Zn、Cd及CoO、MnO和FeO。采用以下工艺可利用富钴渣生产高纯锌_______ 。
(2)加入H2O2后生成FeOOH的化学方程式为_______ 。
(3)“滤液①”中含有的金属离子有Cd2+、Co2+、_______ 。
(4)“除锰钴”中,生成MnO2的离子方程式为_______ 。
(5)还原除杂的“滤渣”主要成分是_______ 。
(2)加入H2O2后生成FeOOH的化学方程式为
(3)“滤液①”中含有的金属离子有Cd2+、Co2+、
(4)“除锰钴”中,生成MnO2的离子方程式为
(5)还原除杂的“滤渣”主要成分是
您最近半年使用:0次
2 . 二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)某小组通过查阅资料发现可以使用SO2和NaClO3反应的方法制备ClO2。写出该过程的离子方程式:______________ 。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。______ ,装置B中的试剂X为______ 。
②D装置通入氮气的主要作用有2个,一是可以起到搅拌作用,二是__________ 。
③装置D用于生成ClO2气体,该反应的化学方程式为___________ 。
(3)ClO2气体具有强氧化性,其还原产物 、Cl-的转化率与pH关系如图所示。ClO2对污水中S2-、CN-等也有明显的去除效果,请写出pH≥7时,ClO2与S2-反应的离子方程式
、Cl-的转化率与pH关系如图所示。ClO2对污水中S2-、CN-等也有明显的去除效果,请写出pH≥7时,ClO2与S2-反应的离子方程式_______ 。 =2I-+
=2I-+ ),当看到
),当看到____________ 现象时,测得标准液消耗的体积为20.00mL,通过计算可知D中ClO2溶液的浓度为_____ 。
(1)某小组通过查阅资料发现可以使用SO2和NaClO3反应的方法制备ClO2。写出该过程的离子方程式:
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。
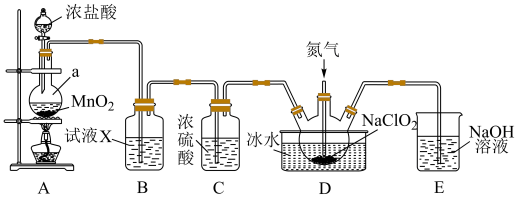
②D装置通入氮气的主要作用有2个,一是可以起到搅拌作用,二是
③装置D用于生成ClO2气体,该反应的化学方程式为
(3)ClO2气体具有强氧化性,其还原产物
 、Cl-的转化率与pH关系如图所示。ClO2对污水中S2-、CN-等也有明显的去除效果,请写出pH≥7时,ClO2与S2-反应的离子方程式
、Cl-的转化率与pH关系如图所示。ClO2对污水中S2-、CN-等也有明显的去除效果,请写出pH≥7时,ClO2与S2-反应的离子方程式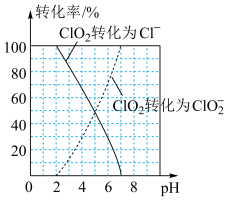
 =2I-+
=2I-+ ),当看到
),当看到
您最近半年使用:0次
解题方法
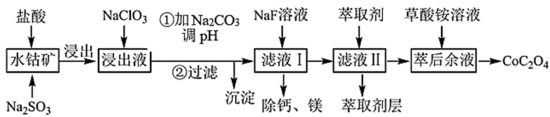
3 . 利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如下:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)为增大水钴矿的浸取效率,可采取的措施为______ 。(任写一条)
(2)向浸出液中加入NaClO3对应的离子反应方程式为______ ,制取NaClO3可以将氯气通入到热的浓氢氧化钠溶液,该反应的离子方程式为______ ;实验需要制取21.3克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为______ (标准状况)。
(3)向浸出液中加入碳酸钠后析出的沉淀是______ ,至少调节pH为______ 。
(4)滤液Ⅱ中加入萃取剂的目的是______ 。
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液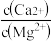 =
=______ 。
(6)取15gCoC2O4样品灼烧(CoC2O4=CoO+CO+CO2,假设杂质不参与变化),将分解产生的气体收集起来得到标况下体积为4.48L的气体,则CoC2O4的纯度为_______ 。
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)为增大水钴矿的浸取效率,可采取的措施为
(2)向浸出液中加入NaClO3对应的离子反应方程式为
(3)向浸出液中加入碳酸钠后析出的沉淀是
(4)滤液Ⅱ中加入萃取剂的目的是
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液
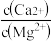 =
=(6)取15gCoC2O4样品灼烧(CoC2O4=CoO+CO+CO2,假设杂质不参与变化),将分解产生的气体收集起来得到标况下体积为4.48L的气体,则CoC2O4的纯度为
您最近半年使用:0次
解题方法
4 . 下列指定反应的离子方程式正确的是
A.常温条件下,将Fe放置于浓硝酸中:Fe+6H++3 =Fe3++3NO2↑+3H2O =Fe3++3NO2↑+3H2O |
B.NH4Al(SO4)2溶液与过量NaOH溶液反应:Al3++4OH-= + 2H2O + 2H2O |
| C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
D.泡沫灭火器(主要成分为硫酸铝和碳酸氢钠)原理:3 +Al3+=Al(OH)3↓+3CO2↑ +Al3+=Al(OH)3↓+3CO2↑ |
您最近半年使用:0次
5 . NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,11.2 L H2O中含有的原子数目为1.5NA |
| B.电解精炼铜单质过程中,阳极减少64g,电路中转移电子数目为2NA |
| C.总质量为28g的N2和CO混合气体中原子总数为2NA |
D.0.1 L 3 mol/L NH4NO3溶液中含有的 数目为0.3NA 数目为0.3NA |
您最近半年使用:0次
解题方法
6 . 下列表示反应中相关微粒的化学用语正确的是
A.中子数为18的氯原子: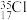 |
| B.HCl的电子式为:H:Cl |
C. 的原子结构示意图: 的原子结构示意图: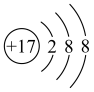 |
D.NaHCO3的电离方程式:NaHCO3 = Na+ + H+ + |
您最近半年使用:0次
解题方法
7 . 草酸(H2C2O4)、草酸铵[(NH4)2C2O4]是重要的化合物。回答下列问题:
(1)实验表明,加热条件下,H2C2O4可分解生成CO2、CO和H2O。为了验证产物中的CO,设计如下实验装置:_______________ (装置可重复利用)。装置F中发生的化学反应方程式为_______________ 。
②能证明草酸晶体分解产物中有CO的现象是_______________ 。
(2)H2C2O4能与酸性高锰酸钾溶液反应,离子方程式为 。该反应中,还原剂为
。该反应中,还原剂为______________ (填化学式),若称取mg草酸晶体(H2C2O4·2H2O)粗产品,配成100mL溶液于锥形瓶中,加入V mL a mol·L-1KMnO4溶液,恰好完全反应,则该草酸晶体的纯度为______________ %[M(H2C2O4·2H2O)=126g·mol-1]。
(3)(NH4)2C2O4是良好的Co2+的沉淀剂,如下为(NH4)2C2O4加入CoSO4溶液中制备CoO的流程图:______________ (填化学式)。
②称量mg CoC2O4·2H2O[M(CoC2O4·2H2O)=183g·mol-1]“高温分解”,测得固体的失重率( )与温度的关系曲线如图所示:
)与温度的关系曲线如图所示:_______________ ;“高温分解”需控制的最低温度为_______________ (经测定290~890℃过程中产生的气体只有CO2)。
(1)实验表明,加热条件下,H2C2O4可分解生成CO2、CO和H2O。为了验证产物中的CO,设计如下实验装置:
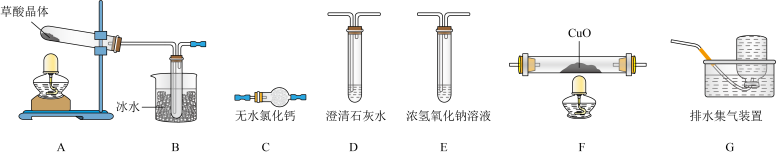
②能证明草酸晶体分解产物中有CO的现象是
(2)H2C2O4能与酸性高锰酸钾溶液反应,离子方程式为
 。该反应中,还原剂为
。该反应中,还原剂为(3)(NH4)2C2O4是良好的Co2+的沉淀剂,如下为(NH4)2C2O4加入CoSO4溶液中制备CoO的流程图:
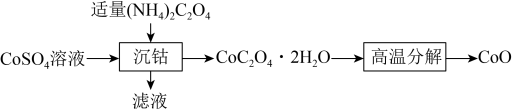
②称量mg CoC2O4·2H2O[M(CoC2O4·2H2O)=183g·mol-1]“高温分解”,测得固体的失重率(
 )与温度的关系曲线如图所示:
)与温度的关系曲线如图所示: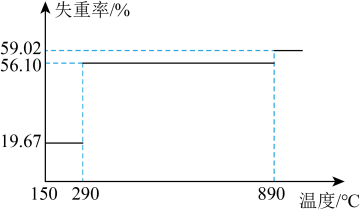
您最近半年使用:0次
解题方法
8 . 有Mg、Fe、Cu的混合粉末,分离得到MgSO4·7H2O过程如下:___________ 。
(2)操作②的名称是___________ ,需要用到的主要玻璃仪器有 ___________ 、玻璃棒,其中玻璃棒的作用是___________ 。
(3)操作②发生的离子反应方程式为___________ ,属于___________ 反应。(填基本反应类型)
(4)实验中可选用适量的下列试剂中的代替稀H2SO4___________ (填标号)。
A. CuSO4溶液 B.FeSO4溶液 C.稀盐酸
(5)操作③主要包含蒸发浓缩、___________ 、过滤、洗涤烘干等。
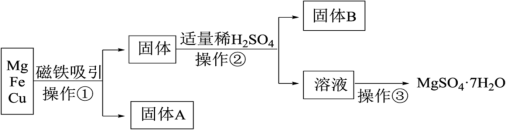
(2)操作②的名称是
(3)操作②发生的离子反应方程式为
(4)实验中可选用适量的下列试剂中的代替稀H2SO4
A. CuSO4溶液 B.FeSO4溶液 C.稀盐酸
(5)操作③主要包含蒸发浓缩、
您最近半年使用:0次
解题方法
9 . 高铁酸钠(Na2FeO4)是一种优良的多功能水处理剂,具有很强的氧化性,工业上可采取干法和湿法制备Na2FeO4。回答下列问题:
(1)干法制备Na2FeO4,反应原理为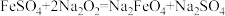 。
。
①Na2FeO4属于______________ (填“盐”“碱”或“氧化物”)。
②写出Na2O2的电子式:_______________ 。
③氧化性:Na2O2______________ (填“<”或“>”)Na2FeO4,每消耗1 mol FeSO4转移______________ mole-。
(2)湿法制备Na2FeO4,将Fe(OH)3固体加入含有一定浓度的NaClO和NaOH的混合溶液中,搅拌一段时间后,可得到Na2FeO4和NaCl。
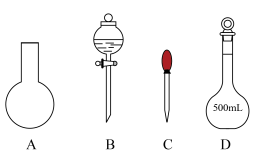
①实验需要480mL0.2mol·L-1NaOH溶液,如图所示的仪器中配制溶液肯定不需要的是_______________ (填字母,下同)。_______________ 。
A.使用容量瓶之前应检查它是否漏水
B.容量瓶用蒸馏水洗净后,无需用待配溶液润洗
C.定容时,将蒸馏水小心倒入容量瓶中直至与刻度线齐平
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
③在配制NaOH溶液时,若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度_______________ (填“>”“<”或“=”)0.2mol·L-1。
④写出湿法制备Na2FeO4的化学方程式:_______________ 。
(3)如果以单位质量的氧化剂所得到的电子数来表示消毒的效率,Na2FeO4的消毒效率为______________ (用分数表示, →Fe3+)。
→Fe3+)。
(1)干法制备Na2FeO4,反应原理为
 。
。①Na2FeO4属于
②写出Na2O2的电子式:
③氧化性:Na2O2
(2)湿法制备Na2FeO4,将Fe(OH)3固体加入含有一定浓度的NaClO和NaOH的混合溶液中,搅拌一段时间后,可得到Na2FeO4和NaCl。
①实验需要480mL0.2mol·L-1NaOH溶液,如图所示的仪器中配制溶液肯定不需要的是
A.使用容量瓶之前应检查它是否漏水
B.容量瓶用蒸馏水洗净后,无需用待配溶液润洗
C.定容时,将蒸馏水小心倒入容量瓶中直至与刻度线齐平
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
③在配制NaOH溶液时,若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度
④写出湿法制备Na2FeO4的化学方程式:
(3)如果以单位质量的氧化剂所得到的电子数来表示消毒的效率,Na2FeO4的消毒效率为
 →Fe3+)。
→Fe3+)。
您最近半年使用:0次
解题方法
10 . 某无色透明溶液中可能存在大量Cl-、Mg2+、Fe3+、K+、Cu2+中的一种或几种,某同学做如下实验:
①取少量原溶液,加入过量硝酸银溶液,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失;
②取少量原溶液,向其中加入过量的NaOH溶液,出现白色沉淀。
下列说法错误的是
①取少量原溶液,加入过量硝酸银溶液,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失;
②取少量原溶液,向其中加入过量的NaOH溶液,出现白色沉淀。
下列说法错误的是
| A.溶液中一定不存在Cu2+、Fe3+ |
| B.溶液中一定存在Cl-、Mg2+ |
| C.溶液中一定不存在K+ |
| D.向溶液中加入NaNO3无现象 |
您最近半年使用:0次



