1 . “刀片电池”通过结构创新,大大提升了磷酸铁锂电池的能量密度。以下是以磷矿石(主要成分 ,还有
,还有 、
、 等杂质)为原料生产白磷(
等杂质)为原料生产白磷( )同时制得刀片电池正极材料
)同时制得刀片电池正极材料 的工艺流程:
的工艺流程:
① 难溶于水,可溶于pH<2的酸性溶液。
难溶于水,可溶于pH<2的酸性溶液。
② 在pH大于2.0时开始产生氢氧化物沉淀,pH为4.0时沉淀完全。
在pH大于2.0时开始产生氢氧化物沉淀,pH为4.0时沉淀完全。
回答下列问题:
(1)白磷( )分子呈正四面体形,难溶于水。白磷是
)分子呈正四面体形,难溶于水。白磷是___________ (填“极性分子”或“非极性分子”)。
(2)“炉渣Ⅰ”主要含有铁单质及铁的磷化物,写出一种分离出铁单质的简单方法___________ 。FeP溶于稀硝酸的离子方程式为___________ 。
(3)“炉渣Ⅱ”的主要成分是一种难溶硅酸盐,其化学式为___________ 。
(4)向“溶液Ⅱ”中通入 控制pH在2.0的原因是
控制pH在2.0的原因是___________ 。
(5)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。 的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有
的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有 的单元数有
的单元数有___________ 个。 脱出部分
脱出部分 ,形成
,形成 ,结构示意图如(b)所示,则x=
,结构示意图如(b)所示,则x=___________ 。 中铁元素有+2和+3价。
中铁元素有+2和+3价。 价层电子排布式为
价层电子排布式为___________ 。
 ,还有
,还有 、
、 等杂质)为原料生产白磷(
等杂质)为原料生产白磷( )同时制得刀片电池正极材料
)同时制得刀片电池正极材料 的工艺流程:
的工艺流程: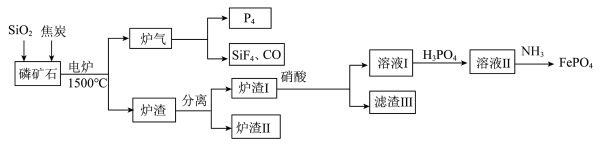
①
 难溶于水,可溶于pH<2的酸性溶液。
难溶于水,可溶于pH<2的酸性溶液。②
 在pH大于2.0时开始产生氢氧化物沉淀,pH为4.0时沉淀完全。
在pH大于2.0时开始产生氢氧化物沉淀,pH为4.0时沉淀完全。回答下列问题:
(1)白磷(
 )分子呈正四面体形,难溶于水。白磷是
)分子呈正四面体形,难溶于水。白磷是(2)“炉渣Ⅰ”主要含有铁单质及铁的磷化物,写出一种分离出铁单质的简单方法
(3)“炉渣Ⅱ”的主要成分是一种难溶硅酸盐,其化学式为
(4)向“溶液Ⅱ”中通入
 控制pH在2.0的原因是
控制pH在2.0的原因是(5)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。
 的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有
的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有 的单元数有
的单元数有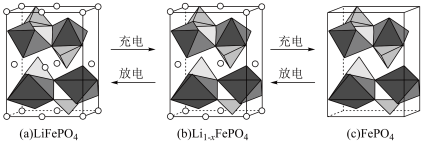
 脱出部分
脱出部分 ,形成
,形成 ,结构示意图如(b)所示,则x=
,结构示意图如(b)所示,则x= 中铁元素有+2和+3价。
中铁元素有+2和+3价。 价层电子排布式为
价层电子排布式为
您最近一年使用:0次
解题方法
2 .  是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收
进行氯化处理以回收 、
、 等金属,工艺路线如下:
等金属,工艺路线如下:
(1) 位于元素周期表第
位于元素周期表第___________ 周期第___________ 族。
(2)烧渣是 、
、 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因___________ 。
(3)鉴别洗净的“滤饼3”和固体 常用方法的名称是
常用方法的名称是___________ 。
(4)已知 ,若“沉钴过滤”的
,若“沉钴过滤”的 控制为10.0,则溶液中
控制为10.0,则溶液中 浓度为
浓度为___________  。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为___________ 。
(5) 的空间构型为
的空间构型为___________ ,导致 比
比 易水解的因素有
易水解的因素有___________ (填标号)。
a. 键极性更大 b.
键极性更大 b. 原子半径更大
原子半径更大
c. 键键能更大 d.
键键能更大 d. 有更多的价层轨道
有更多的价层轨道
(6) 固体与“滤饼3”在空气氛围内加热可重新制得
固体与“滤饼3”在空气氛围内加热可重新制得 ,其化学方程式为
,其化学方程式为___________ 。
(7)回收 还可以用稀硫酸与
还可以用稀硫酸与 将其转变为
将其转变为 ,从结构角度解释
,从结构角度解释 能起到该作用的原因
能起到该作用的原因___________ 。
 是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收
进行氯化处理以回收 、
、 等金属,工艺路线如下:
等金属,工艺路线如下: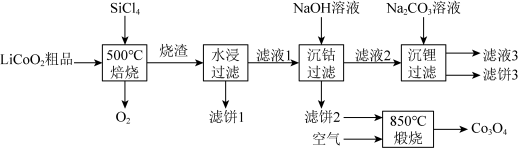
(1)
 位于元素周期表第
位于元素周期表第(2)烧渣是
 、
、 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因(3)鉴别洗净的“滤饼3”和固体
 常用方法的名称是
常用方法的名称是(4)已知
 ,若“沉钴过滤”的
,若“沉钴过滤”的 控制为10.0,则溶液中
控制为10.0,则溶液中 浓度为
浓度为 。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为(5)
 的空间构型为
的空间构型为 比
比 易水解的因素有
易水解的因素有a.
 键极性更大 b.
键极性更大 b. 原子半径更大
原子半径更大c.
 键键能更大 d.
键键能更大 d. 有更多的价层轨道
有更多的价层轨道(6)
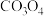 固体与“滤饼3”在空气氛围内加热可重新制得
固体与“滤饼3”在空气氛围内加热可重新制得 ,其化学方程式为
,其化学方程式为(7)回收
 还可以用稀硫酸与
还可以用稀硫酸与 将其转变为
将其转变为 ,从结构角度解释
,从结构角度解释 能起到该作用的原因
能起到该作用的原因
您最近一年使用:0次
解题方法
3 . 钛酸钡(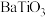 )具有高介电常数和低介电损耗,是压电陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。一种超细微
)具有高介电常数和低介电损耗,是压电陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。一种超细微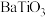 粉末的制备方法如下。
粉末的制备方法如下。 的电离方程式为
的电离方程式为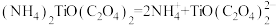 请回答:
请回答:
(1)下列说法正确的是___________。
(2)用溶液2提取的一种副产物可作肥料,该物质是___________ (写电子式);得到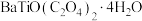 沉淀后需要洗涤,请写出实验操作以检验洗涤是否完全
沉淀后需要洗涤,请写出实验操作以检验洗涤是否完全___________ 。
(3)请写出煅烧过程发生反应的化学方程式___________ 。
(4)如何设计实验方案检验气体A经干燥处理后的剩余气体成分________ 。
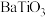 )具有高介电常数和低介电损耗,是压电陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。一种超细微
)具有高介电常数和低介电损耗,是压电陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。一种超细微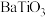 粉末的制备方法如下。
粉末的制备方法如下。
 的电离方程式为
的电离方程式为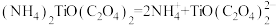 请回答:
请回答:(1)下列说法正确的是___________。
| A.压电陶瓷属于新型无机非金属材料,能实现机械能与电能的相互转化 |
B.溶液1中加入 溶液的离子方程式为 溶液的离子方程式为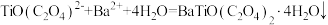 |
| C.实验室中煅烧用到的主要仪器有酒精喷灯、三脚架、泥三角和蒸发皿 |
| D.流程中的三步反应均为非氧化还原反应 |
(2)用溶液2提取的一种副产物可作肥料,该物质是
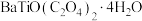 沉淀后需要洗涤,请写出实验操作以检验洗涤是否完全
沉淀后需要洗涤,请写出实验操作以检验洗涤是否完全(3)请写出煅烧过程发生反应的化学方程式
(4)如何设计实验方案检验气体A经干燥处理后的剩余气体成分
您最近一年使用:0次
4 . 铵明矾晶体的化学式为 ,以铵明矾为原料可实现如图转化。
,以铵明矾为原料可实现如图转化。 与题中阳离子不形成配合物,固体A为纯净物。
与题中阳离子不形成配合物,固体A为纯净物。
(1)铵明矾晶体“隔绝空气加热”分解产物中含硫化合物有___________ 。
(2)步骤III中生成白色沉淀C反应的化学方程式为___________ 。
(3)合成铵明矾过程中常使用过量的硫酸铵,一个作用是抑制硫酸铝水解,另一个重要作用是___________ 。
(4)设计实验验证固体A含有的金属元素:___________ 。
(5)步骤I中,铵明矾晶体在各温度段内受热“失重计算值”如表所示。(失重计算值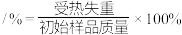 )
)
通过上述数据可判断,在温度区间___________ ℃,铵明矾基本上失去了结晶水。
 ,以铵明矾为原料可实现如图转化。
,以铵明矾为原料可实现如图转化。
 与题中阳离子不形成配合物,固体A为纯净物。
与题中阳离子不形成配合物,固体A为纯净物。(1)铵明矾晶体“隔绝空气加热”分解产物中含硫化合物有
(2)步骤III中生成白色沉淀C反应的化学方程式为
(3)合成铵明矾过程中常使用过量的硫酸铵,一个作用是抑制硫酸铝水解,另一个重要作用是
(4)设计实验验证固体A含有的金属元素:
(5)步骤I中,铵明矾晶体在各温度段内受热“失重计算值”如表所示。(失重计算值
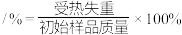 )
)| 温度区间/℃ | 18→190 | 190→430 | 430→505 | 505→900 |
| 失重计算值/% | 39.20 | 7.80 | 13.00 | 26.00 |
您最近一年使用:0次
名校
5 . 锶( )与钙同主族,某固态化合物Y的组成为
)与钙同主族,某固态化合物Y的组成为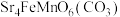 ,以Y为原料可实现如下转化:
,以Y为原料可实现如下转化: 均不能形成配合物。请回答:
均不能形成配合物。请回答:
(1)写出溶液C中的所有阳离子___________ 。
(2)步骤Ⅴ中的反应为 ,说明
,说明 能够较完全转化为
能够较完全转化为 ,的两个原因分别是:①生成
,的两个原因分别是:①生成 降低了体系的能量,促使反应正向进行②
降低了体系的能量,促使反应正向进行②___________ 。
(3)下列说法不正确 的是___________。
(4)固体Y可与 溶液反应,写出该反应的离子方程式
溶液反应,写出该反应的离子方程式___________ 。
(5)设计实验方案检验气体中除 以外的两种主要成分
以外的两种主要成分___________ 。
 )与钙同主族,某固态化合物Y的组成为
)与钙同主族,某固态化合物Y的组成为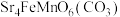 ,以Y为原料可实现如下转化:
,以Y为原料可实现如下转化:
 均不能形成配合物。请回答:
均不能形成配合物。请回答:(1)写出溶液C中的所有阳离子
(2)步骤Ⅴ中的反应为
 ,说明
,说明 能够较完全转化为
能够较完全转化为 ,的两个原因分别是:①生成
,的两个原因分别是:①生成 降低了体系的能量,促使反应正向进行②
降低了体系的能量,促使反应正向进行②(3)下列说法
A.固体B中含有 | B.步骤Ⅱ反应促进了 的水解 的水解 |
C.步骤Ⅲ可推断碱性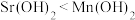 | D.直接加热 无法获得 无法获得 |
(4)固体Y可与
 溶液反应,写出该反应的离子方程式
溶液反应,写出该反应的离子方程式(5)设计实验方案检验气体中除
 以外的两种主要成分
以外的两种主要成分
您最近一年使用:0次
6 . 研究弱电解质的电离及盐的水解,有重要的实际意义。
(1)醋酸的电离方程式为_______ 。
(2)下列事实不能说明CH3COOH是弱电解质的是_______(填标号)。
(3)某些弱酸在25℃时的电离常数(Ka)如表:
①同浓度的 CH3COOH、H2CO3、HClO 溶液的 pH 最大的是_______ 。
②常温下 0.1mol/L的 CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______ (填字母序号,下同)。
A.c(H⁺) B.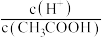 C.
C.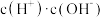 D.
D. E.
E. 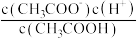
③若该溶液升高温度,上述5种表达式的数据减小的是_______ 。
④下列反应可以发生的是_______ (填标号)。
A. CH3COOH+ Na2CO3=NaHCO3 +CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
(4)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似,写出第一步电离的离子方程式_______ 。
(5)已知 。
。 属于
属于_______ (填“一”“二”或“三”)元酸, 属于
属于_______ (填“正盐”或“酸式盐”)。
(6)体积为 10mL pH=2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至1000mL, 稀释过程pH变化如图:则HX的电离平衡常数_______ (填“大于”、“等于”或“小于”)醋酸的平衡常数。 稀释后,HX 溶液中有水电离出来的c(H⁺)_______ (填“大于”、“等于”或“小于”)醋酸的溶液中有水电离出来的c(H⁺),理由是_______ 。
(1)醋酸的电离方程式为
(2)下列事实不能说明CH3COOH是弱电解质的是_______(填标号)。
| A.相同温度下,浓度均为1mol/L的盐酸和醋酸的导电性对比:盐酸明显大于醋酸 |
| B.1mol/LCH3COONa溶液能使紫色石蕊试液变蓝 |
| C.25℃时,1 mol/LCH3COOH溶液的pH约为2 |
| D.10 mL1mol/L的CH3COOH溶液恰好与10 mL 1 mol/LNaOH溶液完全反应 |
(3)某些弱酸在25℃时的电离常数(Ka)如表:
| 化学式 | CH3COOH | HCN | HClO | H2CO3 |
| 电离常数(Ka) | 1.8×10-5 | 4.9×10 -10 | 3.0×10-8 | Ka1=4.4×10-7,Ka2=4.7×10-11 |
②常温下 0.1mol/L的 CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.c(H⁺) B.
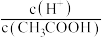 C.
C.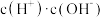 D.
D. E.
E. 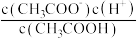
③若该溶液升高温度,上述5种表达式的数据减小的是
④下列反应可以发生的是
A. CH3COOH+ Na2CO3=NaHCO3 +CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
(4)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似,写出第一步电离的离子方程式
(5)已知
 。
。 属于
属于 属于
属于(6)体积为 10mL pH=2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至1000mL, 稀释过程pH变化如图:则HX的电离平衡常数
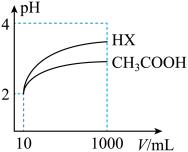
您最近一年使用:0次
名校
解题方法
7 . 为探究某矿物X(含三种常见元素)的组成和性质,某兴趣小组设计了如下实验:已知实验中所用试剂均足量,固体B是一种单质和化合物的混合物,请回答如下问题:______ 。
(2)气体A与溴水反应的离子方程式:______ 。
(3)X在高温下与氧气充分反应的化学方程式:______ 。
(4)红棕色固体Ⅰ溶于HI溶液的离子方程式______ 。
(5)检验溶液G中的金属阳离子的实验方案:______ 。
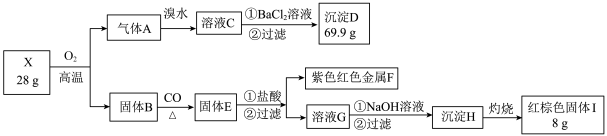
(2)气体A与溴水反应的离子方程式:
(3)X在高温下与氧气充分反应的化学方程式:
(4)红棕色固体Ⅰ溶于HI溶液的离子方程式
(5)检验溶液G中的金属阳离子的实验方案:
您最近一年使用:0次
名校
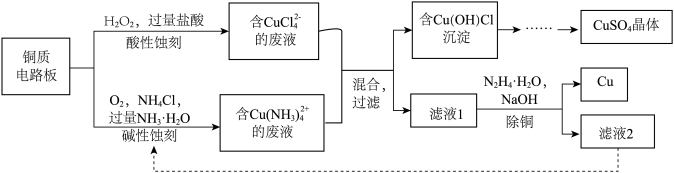
8 . 铜质电路板可采用酸性蚀刻与减性蚀刻两种方法,将二者的废液混合可实现回收再利用,其主要流程如下: 具有强还原性,易被氧化为
具有强还原性,易被氧化为 。
。
ii. 形成配合物后,氧化性降低。
形成配合物后,氧化性降低。
(1)蚀刻
①酸性蚀刻过程中盐酸的作用是______________ 。
②将碱性蚀刻铜的离子方程式补充完整:__________ 。
☐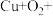 ☐_______+☐_______=☐
☐_______+☐_______=☐ +☐_______
+☐_______
③关于蚀刻的下列说法正确的是_________ (填字母)。
A.用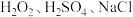 也可以使
也可以使 溶解
溶解
B.碱性蚀刻和酸性蚀刻分别利用了 的氧化性和
的氧化性和 的还原性
的还原性
C.在碱性蚀刻和酸性蚀刻中,溶解相同质量的 转移的电子数之比为
转移的电子数之比为
(2)滤液1的 约为5,其中除少量
约为5,其中除少量 外,还大量存在的离子是
外,还大量存在的离子是_______________ 。
(3)除铜
①利用水合肼 还原
还原 的离子方程式是
的离子方程式是_________________ 。
②已知滤渣中除金属铜外不含其他形式的含 沉淀。测得铜去除率、水合肼还原能力随溶液
沉淀。测得铜去除率、水合肼还原能力随溶液 的变化情况如图所示。
的变化情况如图所示。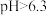 时,铜去除率随
时,铜去除率随 增大而减小,结合图给信,息和已知信息分析其原因:
增大而减小,结合图给信,息和已知信息分析其原因:________________ 。
 具有强还原性,易被氧化为
具有强还原性,易被氧化为 。
。ii.
 形成配合物后,氧化性降低。
形成配合物后,氧化性降低。(1)蚀刻
①酸性蚀刻过程中盐酸的作用是
②将碱性蚀刻铜的离子方程式补充完整:
☐
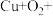 ☐_______+☐_______=☐
☐_______+☐_______=☐ +☐_______
+☐_______③关于蚀刻的下列说法正确的是
A.用
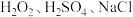 也可以使
也可以使 溶解
溶解B.碱性蚀刻和酸性蚀刻分别利用了
 的氧化性和
的氧化性和 的还原性
的还原性C.在碱性蚀刻和酸性蚀刻中,溶解相同质量的
 转移的电子数之比为
转移的电子数之比为
(2)滤液1的
 约为5,其中除少量
约为5,其中除少量 外,还大量存在的离子是
外,还大量存在的离子是(3)除铜
①利用水合肼
 还原
还原 的离子方程式是
的离子方程式是②已知滤渣中除金属铜外不含其他形式的含
 沉淀。测得铜去除率、水合肼还原能力随溶液
沉淀。测得铜去除率、水合肼还原能力随溶液 的变化情况如图所示。
的变化情况如图所示。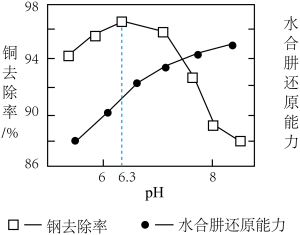
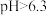 时,铜去除率随
时,铜去除率随 增大而减小,结合图给信,息和已知信息分析其原因:
增大而减小,结合图给信,息和已知信息分析其原因:
您最近一年使用:0次
名校
9 . 铊(Tl)广泛用于电子、军工、航天、化工、治金、通讯等方面,一种以红铊矿(主要成分是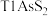 ,含少量
,含少量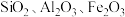 ,等杂质)为原料制备金属铊的流程如图所示。
,等杂质)为原料制备金属铊的流程如图所示。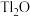 )膜,而失去金属光泽变得灰暗。
)膜,而失去金属光泽变得灰暗。
②TlCl难溶于水,而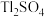 溶于水。
溶于水。
③溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
如下表所示:
回答下列问题:
(1) 中三元素的基态原子含有未成对电子数最多的元素是
中三元素的基态原子含有未成对电子数最多的元素是_______ 。(填元素符号)
(2)“焙烧1”中, 最终转化为
最终转化为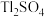 ﹔
﹔ 和
和 也转化为相应的硫酸盐。其中,
也转化为相应的硫酸盐。其中, 转化为
转化为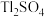 分如下两步完成。请写出第二步反应的化学方程式。
分如下两步完成。请写出第二步反应的化学方程式。
第一步( 与
与 反应):
反应):
第二步:_______ 。
(3)滤渣的成分 属于共价晶体,晶体中每个最小环含有
属于共价晶体,晶体中每个最小环含有_______ 个原子。
(4)“沉铊”步骤中,需要加入过量 ,其原因是
,其原因是_______ 。(用化学用语和简要的文字解释)
(5)向“沉铊”后的滤液中加入生石灰至 时才能外排,此时滤液中的
时才能外排,此时滤液中的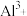 浓度为
浓度为_______  。(指数允许是小数)
。(指数允许是小数)
(6)“焙烧2”中发生的反应为 。则“置换”步骤中发生反应的离子方程式为
。则“置换”步骤中发生反应的离子方程式为_______ 。
(7)所得产品高纯铊应保存在_______ 中。
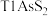 ,含少量
,含少量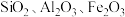 ,等杂质)为原料制备金属铊的流程如图所示。
,等杂质)为原料制备金属铊的流程如图所示。
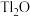 )膜,而失去金属光泽变得灰暗。
)膜,而失去金属光泽变得灰暗。②TlCl难溶于水,而
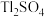 溶于水。
溶于水。③溶液中金属离子开始沉淀和完全沉淀的
 如下表所示:
如下表所示:| 金属离子 |  |  |
开始沉淀的 | 2.2 | 3.5 |
沉淀完全( )的 )的 | 3.2 | 4.7 |
(1)
 中三元素的基态原子含有未成对电子数最多的元素是
中三元素的基态原子含有未成对电子数最多的元素是(2)“焙烧1”中,
 最终转化为
最终转化为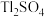 ﹔
﹔ 和
和 也转化为相应的硫酸盐。其中,
也转化为相应的硫酸盐。其中, 转化为
转化为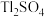 分如下两步完成。请写出第二步反应的化学方程式。
分如下两步完成。请写出第二步反应的化学方程式。第一步(
 与
与 反应):
反应):
第二步:
(3)滤渣的成分
 属于共价晶体,晶体中每个最小环含有
属于共价晶体,晶体中每个最小环含有(4)“沉铊”步骤中,需要加入过量
 ,其原因是
,其原因是(5)向“沉铊”后的滤液中加入生石灰至
 时才能外排,此时滤液中的
时才能外排,此时滤液中的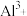 浓度为
浓度为 。(指数允许是小数)
。(指数允许是小数)(6)“焙烧2”中发生的反应为
 。则“置换”步骤中发生反应的离子方程式为
。则“置换”步骤中发生反应的离子方程式为(7)所得产品高纯铊应保存在
您最近一年使用:0次
名校
10 . 研究 、
、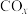 的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。
的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。
(1)采用 作还原剂催化还原
作还原剂催化还原 可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为:
可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为: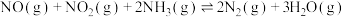 。以下说法正确的是______。
。以下说法正确的是______。
(2)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应用Rh做催化剂时该反应的过程示意图如图所示:__________ 。(填“极性键”、“非极性键”或“极性键和非极性键”)。过程Ⅱ为__________ 过程(填“吸热”或“放热”)。
②已知过程Ⅰ的焓变为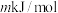 ,过程Ⅱ的焓变为
,过程Ⅱ的焓变为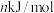 ,则该反应的热化学方程式为:
,则该反应的热化学方程式为:__________ 。
(3) 催化还原NO的物质转化如图所示。若参与反应的
催化还原NO的物质转化如图所示。若参与反应的 和
和 的物质的量之比为4∶1,则转化时
的物质的量之比为4∶1,则转化时 和NO物质的量之比为:
和NO物质的量之比为:__________ 。其中__________ 是催化剂(填化学符号)。______ (填选项)。(A.化学能转化为电能 B.电能转化为化学能),石墨Ⅰ是该电化学装置的______ (填选项)(A.正极 B.负极)石墨Ⅰ电极上发生的电极反应为__________ (提醒:介质为熔融 )。相同条件下,放电过程中消耗的
)。相同条件下,放电过程中消耗的 和
和 的体积比为
的体积比为__________ 。
 、
、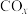 的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。
的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。(1)采用
 作还原剂催化还原
作还原剂催化还原 可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为:
可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为: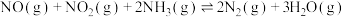 。以下说法正确的是______。
。以下说法正确的是______。A.使用催化剂更有利于提高 的平衡转化率 的平衡转化率 |
| B.及时吹脱水蒸气,可以提高脱氮率 |
| C.其他条件不变的条件下,改变压强对脱氮率没有影响 |
| D.烟气通过催化剂的流速越快,脱氮效果会越好 |
(2)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应用Rh做催化剂时该反应的过程示意图如图所示:

②已知过程Ⅰ的焓变为
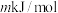 ,过程Ⅱ的焓变为
,过程Ⅱ的焓变为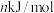 ,则该反应的热化学方程式为:
,则该反应的热化学方程式为:(3)
 催化还原NO的物质转化如图所示。若参与反应的
催化还原NO的物质转化如图所示。若参与反应的 和
和 的物质的量之比为4∶1,则转化时
的物质的量之比为4∶1,则转化时 和NO物质的量之比为:
和NO物质的量之比为: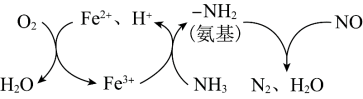
 )。相同条件下,放电过程中消耗的
)。相同条件下,放电过程中消耗的 和
和 的体积比为
的体积比为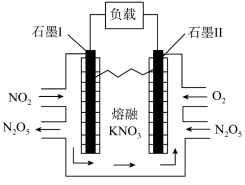
您最近一年使用:0次



