1 . 根据溶液中发生的两个反应:①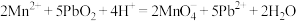 ;②
;② 。下列说法不正确的是
。下列说法不正确的是
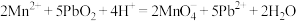 ;②
;② 。下列说法不正确的是
。下列说法不正确的是A.反应①中氧化剂和还原剂的物质的量之比为 |
B.酸性条件下,氧化性: |
| C.实验室将高锰酸钾酸化时,常用硫酸酸化而不用盐酸酸化 |
D.反应②中每生成 的气体,则反应中转移的电子的物质的量为 的气体,则反应中转移的电子的物质的量为 |
您最近一年使用:0次
2021-05-27更新
|
746次组卷
|
6卷引用:第05讲 氧化还原反应(练) — 2022年高考化学一轮复习讲练测(新教材新高考)
(已下线)第05讲 氧化还原反应(练) — 2022年高考化学一轮复习讲练测(新教材新高考)辽宁省沈阳郊联体2021届高三5月四模化学试题河北省沧州市2021届高考第三次模拟考试化学试题安徽省黄山市屯溪第一中学2021-2022学年高一上学期期中考试化学试题重庆市缙云教育联盟2021-2022学年高一12月月考化学试题山东省淄博市桓台第二中学2021-2022学年高三9月月考化学试题
名校
解题方法
2 . 设 为阿伏加 德罗常数的值。由一种金属阳离子(或
为阿伏加 德罗常数的值。由一种金属阳离子(或 )与两种酸根阴离子组成的盐称为混盐。向混盐
)与两种酸根阴离子组成的盐称为混盐。向混盐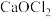 中加入浓硫酸,发生反应:
中加入浓硫酸,发生反应: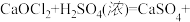
 。下列说法正确的是( )
。下列说法正确的是( )
 为阿伏加 德罗常数的值。由一种金属阳离子(或
为阿伏加 德罗常数的值。由一种金属阳离子(或 )与两种酸根阴离子组成的盐称为混盐。向混盐
)与两种酸根阴离子组成的盐称为混盐。向混盐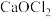 中加入浓硫酸,发生反应:
中加入浓硫酸,发生反应: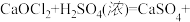
 。下列说法正确的是( )
。下列说法正确的是( )| A.明矾、小苏打都是混盐 |
| B.在题述反应中,浓硫酸体现氧化性和酸性 |
C.每产生1mol ,转移的电子数为 ,转移的电子数为 |
D.1mol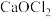 中所含离子数为4 中所含离子数为4 |
您最近一年使用:0次
2020-10-07更新
|
259次组卷
|
14卷引用:2020届高三《新题速递·化学》12月第01期(考点01-06)
2020届高三《新题速递·化学》12月第01期(考点01-06)2020届高三化学化学二轮复习——高考常考题:氧化还原反应的相关计算【精编24题】【市级联考】四川省攀枝花市2019—2020学年高三上学期第一次统考化学试题湖南省长沙市长郡中学2020届高三月考(六)理综化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(一)江苏省徐州市第一中学2019-2020学年高二下学期第四次线上周考化学试题安徽省六安市舒城中学2019-2020学年高二下学期期末考试化学试题人教版(2019)高一必修第一册第二章 海水中的重要元素 高考挑战区辽宁省六校协作体2020-2021学年高二上学期期初考试化学试题高一必修第一册(苏教2019版)专题3 C 高考挑战区 过模拟 2年模拟精编精练甘肃省天水市甘谷县第四中学2021届高三上学期第二次检测化学试题江西省宜春市奉新县冶城职业学校(奉新县第三中学)2020-2021学年高三上学期第五次月考化学试题吉林省长春市东北师范大学附属中学2022-2023学年高一下学期期中考试化学试题新疆喀什地区伽师县2022-2023学年高三上学期11月期中考试化学试题
名校
解题方法
3 . 甘氨酸亚铁[(H2NCH2COO)2Fe]是新一代畜禽饲料补铁添加剂。某实验小组以碳酸亚铁和甘氨酸反应制备甘氨酸亚铁的装置如下(夹持和加热仪器略去):
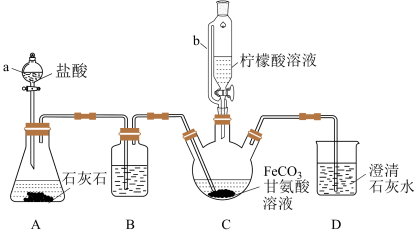
已知:①反应原理为2H2NCH2COOH+FeCO3 (H2NCH2COO)2Fe+CO2↑+H2O。
(H2NCH2COO)2Fe+CO2↑+H2O。
②甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
③柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:I.装置C中盛有过量的FeCO3和200mL 1.0 mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置C中的空气排净后,加热并不断搅拌;然后向三颈烧瓶中滴加柠檬酸溶液。
II.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)装置B中的试剂为_______ 。
(2)装置A制备CO2的用途是_______ 。
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,该反应的离子方程式为_______ 。
(4)过程I加入柠檬酸溶液促进FeCO3溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。

①pH过低或过高均导致产率下降,pH过高导致产率下降的原因是_______ 。
②柠檬酸溶液除了起酸性作用外,还有的作用是_______ 。
(5)过程II中加入无水乙醇的目的是_______ 。
(6)本实验制得15.3 g甘氨酸亚铁(Mr=204g/mol),则其产率是_______ %。

已知:①反应原理为2H2NCH2COOH+FeCO3
 (H2NCH2COO)2Fe+CO2↑+H2O。
(H2NCH2COO)2Fe+CO2↑+H2O。②甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
③柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:I.装置C中盛有过量的FeCO3和200mL 1.0 mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置C中的空气排净后,加热并不断搅拌;然后向三颈烧瓶中滴加柠檬酸溶液。
II.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)装置B中的试剂为
(2)装置A制备CO2的用途是
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,该反应的离子方程式为
(4)过程I加入柠檬酸溶液促进FeCO3溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。

①pH过低或过高均导致产率下降,pH过高导致产率下降的原因是
②柠檬酸溶液除了起酸性作用外,还有的作用是
(5)过程II中加入无水乙醇的目的是
(6)本实验制得15.3 g甘氨酸亚铁(Mr=204g/mol),则其产率是
您最近一年使用:0次
2025高三上·全国·专题练习
4 . 臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2 2O3。
2O3。
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为___________ g·mol-1(保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为___________ L。
 2O3。
2O3。(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为
您最近一年使用:0次
2024高三下·浙江·专题练习
5 . KNO3具有强氧化性,可发生反应:2KNO3+2NH4Cl 2KCl+2N2↑+O2↑+4H2O。下列说法
2KCl+2N2↑+O2↑+4H2O。下列说法不正确 的是(NA为阿伏加德罗常数的值)
 2KCl+2N2↑+O2↑+4H2O。下列说法
2KCl+2N2↑+O2↑+4H2O。下列说法| A.N2既是氧化产物,又是还原产物 |
| B.KNO3仅作氧化剂 |
| C.生成1molN2转移电子的数目为5NA |
| D.实验室不可用加热NH4NO3固体的方法制备NH3 |
您最近一年使用:0次
名校
解题方法
6 .  具有强氧化性,可发生反应:
具有强氧化性,可发生反应: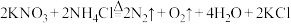 。下列说法
。下列说法不正确 的是( 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
 具有强氧化性,可发生反应:
具有强氧化性,可发生反应: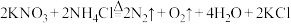 。下列说法
。下列说法 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)A. 既是氧化产物,又是还原产物 既是氧化产物,又是还原产物 | B. 仅作氧化剂 仅作氧化剂 |
C.生成1mol 转移电子的数目为 转移电子的数目为 | D.实验室不可用加热 固体的方法制备 固体的方法制备 |
您最近一年使用:0次
名校
7 . 已知:① ,②
,②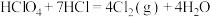 。
。 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是
 ,②
,②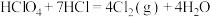 。
。 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是A.反应①中物质的氧化性: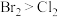 |
B.标准状况下,11.2L 参与反应时转移的电子数为5NA 参与反应时转移的电子数为5NA |
C.1L0.5  溶液含有的 溶液含有的 分子数为0.5 分子数为0.5 |
D.反应②生成28.4g 时,还原产物分子数为0.05 时,还原产物分子数为0.05 |
您最近一年使用:0次
2024-04-16更新
|
709次组卷
|
5卷引用:通关练01 化学基本概念再回归-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
(已下线)通关练01 化学基本概念再回归-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)选择题1-5辽宁省锦州市渤海大学附属高级中学2023-2024学年高三下学期3月摸底考试化学试题河北省邢台市五岳联盟2024届高三下学期模拟预测化学试题贵州省安顺市部分学校2024届高三下学期二模考试化学试题
2023高三·全国·专题练习
名校
8 . SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下化学反应:①SO2+2Fe3++2H2O=  +2Fe2++4H+;②
+2Fe2++4H+;② +6Fe2++14H+=2Cr3++6Fe3++7H2O。则下列有关说法不正确的是
+6Fe2++14H+=2Cr3++6Fe3++7H2O。则下列有关说法不正确的是
 +2Fe2++4H+;②
+2Fe2++4H+;② +6Fe2++14H+=2Cr3++6Fe3++7H2O。则下列有关说法不正确的是
+6Fe2++14H+=2Cr3++6Fe3++7H2O。则下列有关说法不正确的是A.氧化性: >Fe3+ >Fe3+ |
| B.标准状况下,若有6.72LSO2参加反应,则最终消耗0.2molK2Cr2O7 |
| C.反应②中,每有1molK2Cr2O7参加反应,转移电子6mol |
| D.由上述反应原理推断,K2Cr2O7可以将Na2SO3氧化成Na2SO4 |
您最近一年使用:0次
2023-07-19更新
|
914次组卷
|
3卷引用:考点05 氧化还原反应方程式的配平与计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
(已下线)考点05 氧化还原反应方程式的配平与计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)新疆伊犁哈萨克自治州奎屯市第一高级中学2023-2024学年高三上学期9月月考化学试题云南省大理州实验中学2021-2022学年高二上学期化学期末考试题
2023高三·全国·专题练习
名校
9 . 测定某溶液中甲醇含量的部分过程如下:①KMnO4溶液处理:CH3OH+  +X→
+X→ +
+  +H2O(未配平,下同)②酸化处理:
+H2O(未配平,下同)②酸化处理: +H+→MnO2↓+
+H+→MnO2↓+ +H2O,下列说法错误的是
+H2O,下列说法错误的是
 +X→
+X→ +
+  +H2O(未配平,下同)②酸化处理:
+H2O(未配平,下同)②酸化处理: +H+→MnO2↓+
+H+→MnO2↓+ +H2O,下列说法错误的是
+H2O,下列说法错误的是| A.“反应①”中X为OH-,配平后计量系数为8 |
B.“反应①”中氧化性: > > |
| C.“反应②”中,可用盐酸进行酸化 |
D.“反应②”消耗71.4g  时,反应中转移0.4mole- 时,反应中转移0.4mole- |
您最近一年使用:0次
10 . 某实验小组的同学为探究一氧化氮的性质,欲选用下列实验装置来制取一氧化氮。
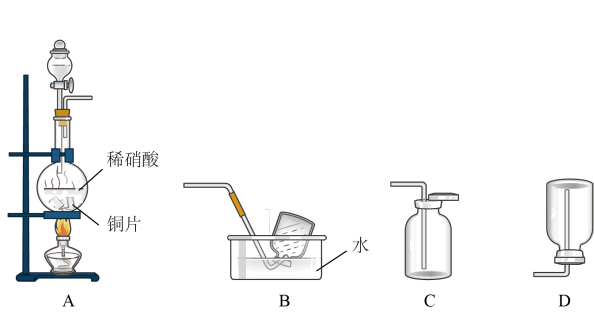
请回答下列问题:
(1)用上图中所示的装置制取一氧化氮,选用仪器连接的顺序应是 接
接___________ 。
(2)现欲用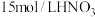 溶液配制
溶液配制 、
、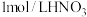 溶液时,要用到的仪器除烧杯、胶头滴管、玻璃棒、量筒外,还必须使用的一种玻璃仪器是
溶液时,要用到的仪器除烧杯、胶头滴管、玻璃棒、量筒外,还必须使用的一种玻璃仪器是___________ 。
(3)稀硝酸具有强氧化性,在常温下就可以和铜发生反应生成一氧化氮气体,写出该反应的化学方程式:___________ 。在实验过程中,该小组同学采用了微热的方法,目的是___________ 。
(4)实验开始时,该小组同学发现在烧瓶中有红棕色气体产生,请你用化学方程式来表示产生这种现象的原因:___________ 。
(5)一氧化氮和一氧化碳是汽车尾气中的主要污染物。目前,汽车尾气已成为许多大城市空气的主要污染源。治理汽车尾气中的 和
和 的一种方法是:在汽车的排气管上装一个催化转化装置,使
的一种方法是:在汽车的排气管上装一个催化转化装置,使 与
与 反应,生成
反应,生成 和
和 。反应的化学方程式是
。反应的化学方程式是___________ 。
(6)取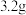 铜与一定体积、一定浓度的硝酸恰好完全反应,生成的混合气体(假设其组成仅为
铜与一定体积、一定浓度的硝酸恰好完全反应,生成的混合气体(假设其组成仅为 和
和 )在标准状况下的体积为
)在标准状况下的体积为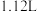 。则该硝酸中
。则该硝酸中 的物质的量为
的物质的量为___________  。
。

请回答下列问题:
(1)用上图中所示的装置制取一氧化氮,选用仪器连接的顺序应是
 接
接(2)现欲用
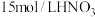 溶液配制
溶液配制 、
、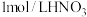 溶液时,要用到的仪器除烧杯、胶头滴管、玻璃棒、量筒外,还必须使用的一种玻璃仪器是
溶液时,要用到的仪器除烧杯、胶头滴管、玻璃棒、量筒外,还必须使用的一种玻璃仪器是(3)稀硝酸具有强氧化性,在常温下就可以和铜发生反应生成一氧化氮气体,写出该反应的化学方程式:
(4)实验开始时,该小组同学发现在烧瓶中有红棕色气体产生,请你用化学方程式来表示产生这种现象的原因:
(5)一氧化氮和一氧化碳是汽车尾气中的主要污染物。目前,汽车尾气已成为许多大城市空气的主要污染源。治理汽车尾气中的
 和
和 的一种方法是:在汽车的排气管上装一个催化转化装置,使
的一种方法是:在汽车的排气管上装一个催化转化装置,使 与
与 反应,生成
反应,生成 和
和 。反应的化学方程式是
。反应的化学方程式是(6)取
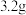 铜与一定体积、一定浓度的硝酸恰好完全反应,生成的混合气体(假设其组成仅为
铜与一定体积、一定浓度的硝酸恰好完全反应,生成的混合气体(假设其组成仅为 和
和 )在标准状况下的体积为
)在标准状况下的体积为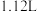 。则该硝酸中
。则该硝酸中 的物质的量为
的物质的量为 。
。
您最近一年使用:0次



