2018高三·全国·专题练习
1 . 某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下。
[提出猜想]
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜也有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
[实验探究]
Ⅰ.解决问题1。
(1)需用到的药品除铜、铝、1 mol·L-1 CuSO4溶液、稀H2SO4外还需________ (填试剂的化学式)溶液。
(2)配制1 mol·L-1 CuSO4溶液250 mL,选用的仪器除烧杯、托盘天平、玻璃棒、量筒、胶头滴管外,还有________________ (填仪器名称)。
(3)为达到实验目的,你认为应进行哪些相关实验?
实验内容和步骤:
①Cu与稀H2SO4反应;
②____________________ ;
③____________________ 。
Ⅱ.解决问题2。
取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100 ℃得到黑色固体粉末;继续加热至1 000 ℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答问题。
(4)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:________________ 。
(5)从实验Ⅱ可得出的结论是____________________________ 。
Ⅲ.解决问题3。
设计如下装置(夹持装置未画出):
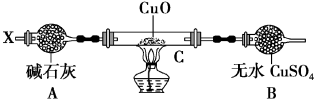
当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01 mol X,测得B装置增重0.27 g,并收集到0.14 g单质气体Y。
(6)研究小组同学验证燃烧管生成的红色物质是铜,你认为他们验证的方法是____________________ 。
(7)X气体的摩尔质量是____________ 。
(8)C中发生反应的化学方程式为______________________ 。
[提出猜想]
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜也有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
[实验探究]
Ⅰ.解决问题1。
(1)需用到的药品除铜、铝、1 mol·L-1 CuSO4溶液、稀H2SO4外还需
(2)配制1 mol·L-1 CuSO4溶液250 mL,选用的仪器除烧杯、托盘天平、玻璃棒、量筒、胶头滴管外,还有
(3)为达到实验目的,你认为应进行哪些相关实验?
实验内容和步骤:
①Cu与稀H2SO4反应;
②
③
Ⅱ.解决问题2。
取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100 ℃得到黑色固体粉末;继续加热至1 000 ℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答问题。
(4)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:
(5)从实验Ⅱ可得出的结论是
Ⅲ.解决问题3。
设计如下装置(夹持装置未画出):

当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01 mol X,测得B装置增重0.27 g,并收集到0.14 g单质气体Y。
(6)研究小组同学验证燃烧管生成的红色物质是铜,你认为他们验证的方法是
(7)X气体的摩尔质量是
(8)C中发生反应的化学方程式为
您最近一年使用:0次
2 . 常温下ClO2为气体,具有强氧化性,易溶于水且不与水反应,可作为自来水的消毒剂与食品漂白剂。ClO2可通过如下反应制备:第一步反应2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,第二步,将生成的混合气体通过装有亚氯酸钠(NaClO2)的干燥管,可吸收Cl2并生成ClO2.现往足量NaClO3中通入56LHCl(标况)气体制ClO2,请计算:
(1)通入的HCl气体物质的量为_______ mol。
(2)至少需要NaClO3的物质的量为_______ mol。
(3)通过两步制备共产生ClO2质量为_______ 克。
(1)通入的HCl气体物质的量为
(2)至少需要NaClO3的物质的量为
(3)通过两步制备共产生ClO2质量为
您最近一年使用:0次
名校
解题方法
3 . 向 溶液中逐滴加入
溶液中逐滴加入 溶液至过量,观察到产生白色沉淀
溶液至过量,观察到产生白色沉淀 ,溶液变为棕色。再向反应后的混合物中不断通入
,溶液变为棕色。再向反应后的混合物中不断通入 气体,溶液逐渐变成无色。下列分析正确的是
气体,溶液逐渐变成无色。下列分析正确的是
 溶液中逐滴加入
溶液中逐滴加入 溶液至过量,观察到产生白色沉淀
溶液至过量,观察到产生白色沉淀 ,溶液变为棕色。再向反应后的混合物中不断通入
,溶液变为棕色。再向反应后的混合物中不断通入 气体,溶液逐渐变成无色。下列分析正确的是
气体,溶液逐渐变成无色。下列分析正确的是A.滴加 溶液时,转移 溶液时,转移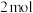 电子时生成 电子时生成 白色沉淀 白色沉淀 |
B.通入 后溶液逐渐变成无色,体现了 后溶液逐渐变成无色,体现了 的漂白性 的漂白性 |
C.通入 时, 时, 与 与 反应, 反应, 作还原剂 作还原剂 |
D.上述实验条件下,物质的氧化性: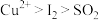 |
您最近一年使用:0次
2022-12-02更新
|
230次组卷
|
5卷引用:T12-化学反应及限度
4 . 王水具有强氧化性,可以溶解金、铂等不活泼金属。王水中的硝酸会与盐酸发生反应:HNO3+3HCl=NOCl+Cl2↑+2H2O。设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.100 mL8 mol·L-1 HNO3溶液中含有的氧原子数目为2. 4NA |
| B.20 g 3H 37Cl中含有的中子数目为11 NA |
| C.11.2 L Cl2中含有的共价键数目为0. 5 NA |
| D.每生成65. 5 g NOCl,转移的电子数为NA |
您最近一年使用:0次
2023-05-04更新
|
882次组卷
|
6卷引用:T5-阿伏伽德罗常数
(已下线)T5-阿伏伽德罗常数(已下线)专题03 阿伏加德罗常数与化学计算 -2023年高考化学真题题源解密(新高考专用)江西省赣州市2023届高三下学期4月联考理科综合化学试题广东省四校2024届高三第一次联考化学试题广东省揭阳市惠来县第一中学2023-2024学年高三上学期第二次月考化学试题吉林省通化市梅河口市第五中学2023-2024学年高一下学期4月月考化学试题
2022高一·全国·专题练习
5 . 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol·L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体上滴加一滴浓盐酸,再立即用表面皿盖好。
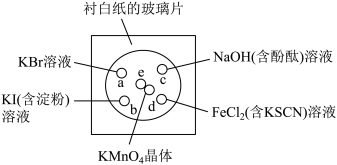
(1)e处反应的离子方程式为_______ 。该反应中发生反应的氧化剂和还原剂的物质的量之比为_______ 。
(2)b处的实验现象为_______ 。d处的实验现象为_______ 。
(3)c处反应的化学方程式为_______ 。标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为_______ mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?_______ (填“能”或“不能”),若能,其氧化性由强到弱的顺序是_______ 。

(1)e处反应的离子方程式为
(2)b处的实验现象为
(3)c处反应的化学方程式为
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?
您最近一年使用:0次
6 . 已知实验室常用二氧化锰粉末和浓盐酸制取氯气,其反应的化学方程式为: ,某实验小组用下图所示装置制取纯净干燥的氯气。
,某实验小组用下图所示装置制取纯净干燥的氯气。
(1)B是除杂装置,盛放的试剂是_______ (填“饱和食盐水”或“饱和NaHCO3溶液”);
(2)C装置利用了浓硫酸的_______ (填“吸水性”“脱水性”或“强氧化性”);
(3)该制取过程中,收集氯气的方法是_______ (填“A”或“B”);
A.向下排空气法 B.向上排空气法
(4)为防止Cl2污染环境,E烧杯中盛装冷的NaOH溶液,请写出该反应的化学方程式_______
(5)欲制取2.24L标准状况下的Cl2,至少需要MnO2的质量为_______ g。
 ,某实验小组用下图所示装置制取纯净干燥的氯气。
,某实验小组用下图所示装置制取纯净干燥的氯气。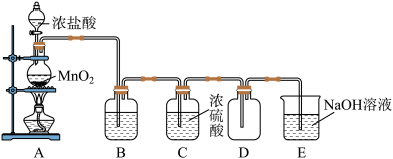
(1)B是除杂装置,盛放的试剂是
(2)C装置利用了浓硫酸的
(3)该制取过程中,收集氯气的方法是
A.向下排空气法 B.向上排空气法
(4)为防止Cl2污染环境,E烧杯中盛装冷的NaOH溶液,请写出该反应的化学方程式
(5)欲制取2.24L标准状况下的Cl2,至少需要MnO2的质量为
您最近一年使用:0次
2022-12-16更新
|
842次组卷
|
4卷引用:专题三 物质的制备
2022高三·全国·专题练习
7 . 现有m g某气体(双原子分子),其摩尔质量为M g·mol-1,若阿伏加德罗常数的值用NA表示,则:
(1)该气体的物质的量为___________ mol。
(2)该气体所含原子总数为___________ 。
(3)该气体在标准状况下的体积为___________ L。
(4)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2 2O3,将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为
2O3,将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为___________ L。
(1)该气体的物质的量为
(2)该气体所含原子总数为
(3)该气体在标准状况下的体积为
(4)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2
 2O3,将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为
2O3,将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为
您最近一年使用:0次
8 . 将mgFe、Cu合金投入足量稀硝酸中,固体完全溶解,共收集到2.24L(标准状况)NO气体,向反应后的溶液中加入过量的NaOH溶液,下列判断正确的是
| A.Fe、Cu和稀硝酸反应,稀硝酸只表现了氧化性 |
| B.最终所得溶液中溶质只有一种 |
| C.整个过程中有0.1mol电子发生转移 |
| D.理论上沉淀的质量为(m+5.1)g |
您最近一年使用:0次
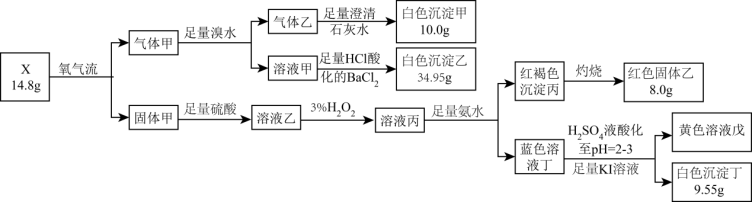
9 . 固体化合物X由4种元素组成,其中2种为短周期元素,某学习小组开展如下探究实验:
请回答:
(1)组成X的元素有_______ ,X的化学式为_______ 。
(2)溶液丙中含有的溶质除 外还有
外还有_______ ,相同条件下对应阳离子的氧化性由强到弱的排序为_______ 。
(3)溶液丁到沉淀丁的离子方程式是_______ 。
(4)已知白色沉淀丁几乎不溶于水和乙醇,溶于盐酸且该过程中铜元素化合价没有变化,请设计实验验证白色沉淀丁的组成元素_______ 。

请回答:
(1)组成X的元素有
(2)溶液丙中含有的溶质除
 外还有
外还有(3)溶液丁到沉淀丁的离子方程式是
(4)已知白色沉淀丁几乎不溶于水和乙醇,溶于盐酸且该过程中铜元素化合价没有变化,请设计实验验证白色沉淀丁的组成元素
您最近一年使用:0次
名校
10 . 设NA为阿伏加德罗常数的值,根据氯元素的“价-类”二维图,下列分析正确的是


| A.标准状况下,1.12 L CCl4所含共价键数为2NA |
| B.由“价-类”二维图推测ClONO2可能具有强氧化性,1 mol ClONO2水解生成两种酸时,转移电子数为1NA |
| C.工业上用NaClO3和SO2制备1 mol ClO2时,消耗SO2分子数为0.5NA |
| D.1 L 1 mol/LNaClO溶液中含有ClO-数为1NA |
您最近一年使用:0次
2022-01-22更新
|
383次组卷
|
3卷引用:进阶训练5



