解题方法
1 . 过氧化钙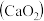 是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备
是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备 过程如下。
过程如下。
Ⅰ.制备
利用反应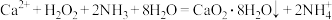 ,在碱性环境下制取
,在碱性环境下制取 的装置如图:
的装置如图:
(1) 的电子式为
的电子式为_______ 。
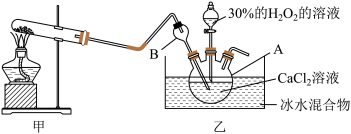
(2)写出甲装置中反应的化学方程式_______ 。
(3)仪器A的名称为_______ ;仪器B的作用是_______ 。
(4)乙中反应温度需控制在0℃左右的原因是该反应是放热反应,温度低有利于提高 的产率和
的产率和_______ 。
(5)反应结束后,分离提纯 的过程中,洗涤的操作为
的过程中,洗涤的操作为_______ 。
Ⅱ.制得产品并定量检测
(6) 脱水干燥即得
脱水干燥即得 产品。经检测知某
产品。经检测知某 产品中含有
产品中含有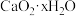 和
和 ,已知
,已知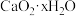 受热分解有
受热分解有 、
、 和
和 生成。①称取
生成。①称取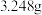 产品,加热,在标准状况下生成
产品,加热,在标准状况下生成 气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的
气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的 溶液得到沉淀
溶液得到沉淀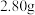 ,则该产品中
,则该产品中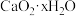 的x值为
的x值为_______ 。
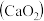 是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备
是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备 过程如下。
过程如下。Ⅰ.制备

利用反应
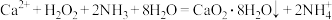 ,在碱性环境下制取
,在碱性环境下制取 的装置如图:
的装置如图:
(1)
 的电子式为
的电子式为(2)写出甲装置中反应的化学方程式
(3)仪器A的名称为
(4)乙中反应温度需控制在0℃左右的原因是该反应是放热反应,温度低有利于提高
 的产率和
的产率和(5)反应结束后,分离提纯
 的过程中,洗涤的操作为
的过程中,洗涤的操作为Ⅱ.制得产品并定量检测
(6)
 脱水干燥即得
脱水干燥即得 产品。经检测知某
产品。经检测知某 产品中含有
产品中含有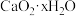 和
和 ,已知
,已知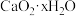 受热分解有
受热分解有 、
、 和
和 生成。①称取
生成。①称取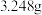 产品,加热,在标准状况下生成
产品,加热,在标准状况下生成 气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的
气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的 溶液得到沉淀
溶液得到沉淀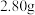 ,则该产品中
,则该产品中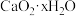 的x值为
的x值为
您最近一年使用:0次
名校
解题方法
2 . 钌(Ru)粉主要用于生产钌靶材,而钌靶材是生产计算机硬盘不可替代的材料。以钌废料制备高纯钌粉的流程如下:
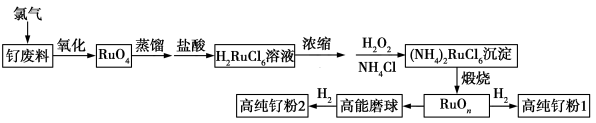
已知:含钌废料中钌主要以单质的形式存在,钌在碱性条件下被氯气“氧化”为RuO4,RuO4是有毒的挥发性物质,蒸馏,用盐酸吸收得到红色H2RuCl6溶液,其中还含有少量RuCl 。回答下列问题:
。回答下列问题:
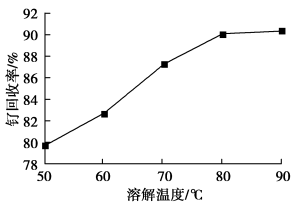
(1)钌废料在碱性条件下被氯气“氧化”的离子方程式为_______ ;钌废料氧化时,随着温度的升高,钌的回收率变化如图所示。综合考虑,确定氧化时的温度以_______ ℃为宜。
(2)用盐酸吸收蒸馏产物时发生氧化还原反应,生成一种可循环到“氧化”环节的气体,若标准状况下产生0.896L该气体,则消耗盐酸中HCl的物质的量为_______ 。(不考虑生成RuCl )
)
(3)“浓缩”步骤时用到的玻璃仪器有酒精灯、烧杯,还有_______ 。
(4)加入H2O2的主要作用是_______ ,同时又调节了溶液的pH,有利于沉淀反应的发生。
(5)煅烧的过程可以分为两步,第1步是氯钌酸铵分解生成钌单质和一种无毒的气体单质,同时有两种化合物生成;第2步是钌单质与氧气反应生成钌的氧化物RuOn(n=1~3)。第1步的化学反应方程式为_______ 。

已知:含钌废料中钌主要以单质的形式存在,钌在碱性条件下被氯气“氧化”为RuO4,RuO4是有毒的挥发性物质,蒸馏,用盐酸吸收得到红色H2RuCl6溶液,其中还含有少量RuCl
 。回答下列问题:
。回答下列问题:(1)钌废料在碱性条件下被氯气“氧化”的离子方程式为

(2)用盐酸吸收蒸馏产物时发生氧化还原反应,生成一种可循环到“氧化”环节的气体,若标准状况下产生0.896L该气体,则消耗盐酸中HCl的物质的量为
 )
)(3)“浓缩”步骤时用到的玻璃仪器有酒精灯、烧杯,还有
(4)加入H2O2的主要作用是
(5)煅烧的过程可以分为两步,第1步是氯钌酸铵分解生成钌单质和一种无毒的气体单质,同时有两种化合物生成;第2步是钌单质与氧气反应生成钌的氧化物RuOn(n=1~3)。第1步的化学反应方程式为
您最近一年使用:0次
2021-06-09更新
|
478次组卷
|
3卷引用:专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习
(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习湖南省长沙市明德中学2021届高三下学期第三次模拟考试化学试题湖南省邵阳邵东市第一中学2022届高三上学期第一次月考化学试题
3 . 二氟化氧在标准状况下为无色气体,具有极强的氧化性,可用氟气与NaOH溶液反应制得: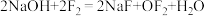 。设
。设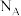 为阿伏加德罗常数的值,下列描述的粒子数的数值为
为阿伏加德罗常数的值,下列描述的粒子数的数值为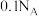 的是
的是
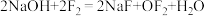 。设
。设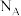 为阿伏加德罗常数的值,下列描述的粒子数的数值为
为阿伏加德罗常数的值,下列描述的粒子数的数值为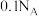 的是
的是A. 溶液中所含的阴离子数 溶液中所含的阴离子数 |
B.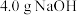 晶体中阴离子所含的质子数 晶体中阴离子所含的质子数 |
C.标准状况下,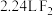 所含的分子数 所含的分子数 |
D. 气体所含的原子数 气体所含的原子数 |
您最近一年使用:0次
解题方法
4 . 常温下ClO2为气体,具有强氧化性,易溶于水且不与水反应,可作为自来水的消毒剂与食品漂白剂。ClO2可通过如下反应制备:2NaClO3+4HCl=2ClO2↑+C12↑+2NaCl+2H2O。现往足量NaClO3中通入56LHCl(标况)气体制ClO2,请计算:
(1)通入的HCl气体物质的量为___ 。
(2)若将生成的混合气体通过装有亚氯酸钠(NaClO2)的干燥管,可吸收Cl2并生成ClO2。通过两步制备共产生ClO2质量为多少克___ (写出计算步骤)?
(1)通入的HCl气体物质的量为
(2)若将生成的混合气体通过装有亚氯酸钠(NaClO2)的干燥管,可吸收Cl2并生成ClO2。通过两步制备共产生ClO2质量为多少克
您最近一年使用:0次
2020高三·全国·专题练习
5 . (1) 铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由下表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.2 mol·L-1 NaOH溶液和1 mol O2,则两种气体的分子式及物质的量分别为_______ ,生成硫酸铜的物质的量为________ 。
(2)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:O2 MnO(OH)2
MnO(OH)2 I2
I2 S4O
S4O
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:__________ 。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水样的溶解氧,消耗0.010 00 mol·L-1Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L-1表示),写出计算过程________ 。
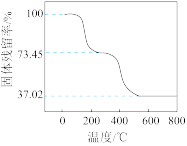
(3)为确定碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]的组成,进行如下实验:①准确称取3.390 g样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率( )随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(CO
)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(CO )=
)=________ 。(写出计算过程)
| 硫 | 氢 | Y | |
| X | 硫 | Z |
(2)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:O2
 MnO(OH)2
MnO(OH)2 I2
I2 S4O
S4O
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水样的溶解氧,消耗0.010 00 mol·L-1Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L-1表示),写出计算过程
(3)为确定碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]的组成,进行如下实验:①准确称取3.390 g样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率(
 )随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(CO
)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(CO )=
)=
您最近一年使用:0次
6 . 在一定条件之下,mgNH4HCO3,完全分解生成三种气体NH3、H2O、CO2,
(1)写出反应的化学方程式___________
(2)如果所得的混合气体对氢气的相对密度为d,则混合气体的物质的量为___________ mol(用含有m、d的表达式表示)
(3)如果所得的混合气体在标况下的密度为ρ,则混合气体的平均相对分子质量为___________ (用含有ρ的表达式表示)
(4)NH4HCO3在农业上可以用作氮肥,它___________ (填能或不能)与草木灰(碱性肥料)混用,长期施用这种肥料会造成土壤酸化板结,可施用___________ 来改良酸性土壤。
(1)写出反应的化学方程式
(2)如果所得的混合气体对氢气的相对密度为d,则混合气体的物质的量为
(3)如果所得的混合气体在标况下的密度为ρ,则混合气体的平均相对分子质量为
(4)NH4HCO3在农业上可以用作氮肥,它
您最近一年使用:0次
2020高三·全国·专题练习
7 . 如图所示两圆圈相交的部分表示圆圈内的物质相互发生的反应。已知钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g。下列说法正确的是( )
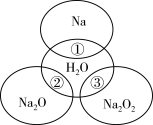

| A.反应③最多能产生0.05 mol O2 |
| B.反应①的离子方程式为Na+2H2O=Na++2OH-+H2↑ |
| C.钠在化学反应中常常失去电子被氧化,作氧化剂,故Na+具有强氧化性 |
| D.①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③ |
您最近一年使用:0次
解题方法
8 . 《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示(SO ·、·OH表示自由基)。设阿伏加 德罗常数的值为NA。下列叙述错误的是()
·、·OH表示自由基)。设阿伏加 德罗常数的值为NA。下列叙述错误的是()
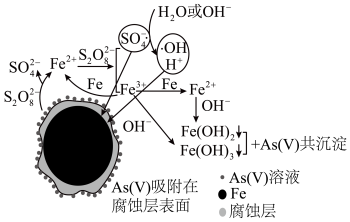
 ·、·OH表示自由基)。设阿伏加 德罗常数的值为NA。下列叙述错误的是()
·、·OH表示自由基)。设阿伏加 德罗常数的值为NA。下列叙述错误的是()
| A.过硫酸钠中-2价氧与-1价氧的个数比为3:1 |
| B.若56gFe参加反应,共有1.5NA个S2O82−被还原 |
| C.碱性条件下硫酸根自由基发生反应的方程式为SO4-·+OH-=SO42-+·OH |
| D.pH越小,越有利于去除废水中的正五价砷 |
您最近一年使用:0次
名校
9 . (1)标准状况下,与5.6L的CH4气体含相同H原子数的硫化氢的质量为___ g。
(2)将2mol·L-1Al2(SO4)3和0.2mol·L-1H2SO4溶液等体积混合(设混合溶液体积等于两溶液体积之和),计算混合液中c(SO42-)=__ mol·L-1。若用容量瓶以质量分数为98%、密度为1.84g/cm3的浓硫酸,配制480mL浓度成0.2mol·L-1 稀硫酸,计算需要量取____ mL的浓硫酸。
(3)配平以下方程式___
___K2Cr2O7+___HCl=___KCl+___CrCl3+___Cl2↑+___H2O
上述反应中物质氧化性:___ >__ ,每生成lmolCl2时有__ 个电子发生转移,氧化剂与还原剂的物质的量之比为__ 。
(2)将2mol·L-1Al2(SO4)3和0.2mol·L-1H2SO4溶液等体积混合(设混合溶液体积等于两溶液体积之和),计算混合液中c(SO42-)=
(3)配平以下方程式
___K2Cr2O7+___HCl=___KCl+___CrCl3+___Cl2↑+___H2O
上述反应中物质氧化性:
您最近一年使用:0次
10 . 下列有关说法正确的是

A. g铁与足量 g铁与足量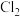 充分反应,转移电子数为 充分反应,转移电子数为 |
B.由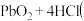 浓 浓 可确定氧化性: 可确定氧化性: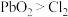 |
C. 在常温下能自发进行,则该反应的 在常温下能自发进行,则该反应的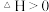 |
D.常温下,用蒸馏水不断稀释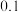 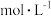 醋酸,溶液中 醋酸,溶液中 的值减小 的值减小 |
您最近一年使用:0次



