名校
解题方法
1 . 将3.2g铜与60.0mL稀硝酸发生反应,铜完全溶解,假设还原产物只有一种,则用排水法可收集到________ L气体(STP)。
您最近一年使用:0次
名校
2 . 天然气中的 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为 ,一定条件下向
,一定条件下向 溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:
溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:________________ .当消耗标准状况下22.4L富氧空气时,有________ mol电子转移。
 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为 ,一定条件下向
,一定条件下向 溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:
溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:
您最近一年使用:0次
名校
3 . 研究氮及其化合物的性质对改善人类的生存环境具有重要意义。回答下列问题:
(1)氨气是氮的最简单氢化物,电子式为_______ ,其水溶液呈_______ (填“酸性”、“中性”或“碱性”)。
(2)①以氨气为原料可制得铵态氮肥。下列属于铵态氮肥的是_______ (填选项字母)。
A.硝酸钾 B. C.尿素
C.尿素 D.碳铵
D.碳铵
② 常作为水培植物营养液的氮肥来源,若用容量瓶配制0.2 mol/L的
常作为水培植物营养液的氮肥来源,若用容量瓶配制0.2 mol/L的 溶液480 mL,需要称量
溶液480 mL,需要称量 固体的质量为
固体的质量为_______ g。
(3)在催化剂的作用下,向280~420℃的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质。写出 消除
消除 的化学反应方程式:
的化学反应方程式:_______ 。
(4)亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。工业制备亚硝酸钠的途径有两种。
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。工业制备亚硝酸钠的途径有两种。
途径一: 加热到380℃分解,原理为
加热到380℃分解,原理为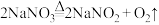 ;
;
途径二:NaOH溶液吸收NO、 气体。
气体。
①写出途径二反应的离子方程式:_______ 。
②制备等量的 ,途径一与途径二转移电子的物质的量之比为
,途径一与途径二转移电子的物质的量之比为_______ 。
(1)氨气是氮的最简单氢化物,电子式为
(2)①以氨气为原料可制得铵态氮肥。下列属于铵态氮肥的是
A.硝酸钾 B.
 C.尿素
C.尿素 D.碳铵
D.碳铵②
 常作为水培植物营养液的氮肥来源,若用容量瓶配制0.2 mol/L的
常作为水培植物营养液的氮肥来源,若用容量瓶配制0.2 mol/L的 溶液480 mL,需要称量
溶液480 mL,需要称量 固体的质量为
固体的质量为(3)在催化剂的作用下,向280~420℃的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质。写出
 消除
消除 的化学反应方程式:
的化学反应方程式:(4)亚硝酸钠(
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。工业制备亚硝酸钠的途径有两种。
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。工业制备亚硝酸钠的途径有两种。途径一:
 加热到380℃分解,原理为
加热到380℃分解,原理为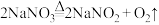 ;
;途径二:NaOH溶液吸收NO、
 气体。
气体。①写出途径二反应的离子方程式:
②制备等量的
 ,途径一与途径二转移电子的物质的量之比为
,途径一与途径二转移电子的物质的量之比为
您最近一年使用:0次
名校
解题方法
4 . 在催化剂的作用下,向 ℃的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质,转化相等物质的量下列氮氧化物时,消耗氨气最少的是
℃的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质,转化相等物质的量下列氮氧化物时,消耗氨气最少的是
 ℃的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质,转化相等物质的量下列氮氧化物时,消耗氨气最少的是
℃的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质,转化相等物质的量下列氮氧化物时,消耗氨气最少的是A. | B. | C.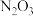 | D. |
您最近一年使用:0次
5 . 硫代硫酸钠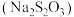 俗称“海波”,又名“大苏打”,是无色透明晶体,易溶于水。实验室制备
俗称“海波”,又名“大苏打”,是无色透明晶体,易溶于水。实验室制备 溶液的装置如图所示(部分装置省略)。
溶液的装置如图所示(部分装置省略)。
(1)装置A中发生反应的化学方程式为___________ 。
(2)装置B的作用是___________ 。
(3)装置C中溶解 固体的蒸馏水需加热煮沸一段时间,其目的是
固体的蒸馏水需加热煮沸一段时间,其目的是___________ 。
(4)装置C中 和
和 按物质的量之比为2:1投料后加热,将
按物质的量之比为2:1投料后加热,将 缓慢通入溶液中,即可获得
缓慢通入溶液中,即可获得 ,化学方程式为
,化学方程式为___________ 。
(5) 用于氰化物解毒的原理为
用于氰化物解毒的原理为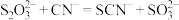 ,请设计实验检验该转化生成了
,请设计实验检验该转化生成了 :
:___________ 。
(6)测定某固体样品中 的质量分数的实验步骤如下:
的质量分数的实验步骤如下:
步骤Ⅰ:称取2.000g固体样品,加水溶解配制成 溶液;
溶液;
步骤Ⅱ:取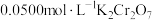 溶液20.00mL,用稀硫酸酸化,再加入过量的KI溶液;
溶液20.00mL,用稀硫酸酸化,再加入过量的KI溶液;
步骤Ⅲ:将步骤Ⅱ所得混合溶液加到步骤I所得 溶液中,恰好完全反应。
溶液中,恰好完全反应。
已知:① ;②
;② 。
。
请计算固体样品中 的质量分数:
的质量分数:___________ 。
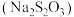 俗称“海波”,又名“大苏打”,是无色透明晶体,易溶于水。实验室制备
俗称“海波”,又名“大苏打”,是无色透明晶体,易溶于水。实验室制备 溶液的装置如图所示(部分装置省略)。
溶液的装置如图所示(部分装置省略)。
(1)装置A中发生反应的化学方程式为
(2)装置B的作用是
(3)装置C中溶解
 固体的蒸馏水需加热煮沸一段时间,其目的是
固体的蒸馏水需加热煮沸一段时间,其目的是(4)装置C中
 和
和 按物质的量之比为2:1投料后加热,将
按物质的量之比为2:1投料后加热,将 缓慢通入溶液中,即可获得
缓慢通入溶液中,即可获得 ,化学方程式为
,化学方程式为(5)
 用于氰化物解毒的原理为
用于氰化物解毒的原理为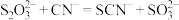 ,请设计实验检验该转化生成了
,请设计实验检验该转化生成了 :
:(6)测定某固体样品中
 的质量分数的实验步骤如下:
的质量分数的实验步骤如下:步骤Ⅰ:称取2.000g固体样品,加水溶解配制成
 溶液;
溶液;步骤Ⅱ:取
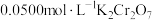 溶液20.00mL,用稀硫酸酸化,再加入过量的KI溶液;
溶液20.00mL,用稀硫酸酸化,再加入过量的KI溶液;步骤Ⅲ:将步骤Ⅱ所得混合溶液加到步骤I所得
 溶液中,恰好完全反应。
溶液中,恰好完全反应。已知:①
 ;②
;② 。
。请计算固体样品中
 的质量分数:
的质量分数:
您最近一年使用:0次
6 . 根据要求回答下列问题。
(1)工业上用碳酸钠与铝土矿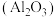 焙烧得到可溶性含铝化合物,写出该含铝化合物的化学式:
焙烧得到可溶性含铝化合物,写出该含铝化合物的化学式:___________ 。
(2)焦炭、 和
和 在高温下反应,得到
在高温下反应,得到 和一种可燃性气体,写出反应的化学方程式:
和一种可燃性气体,写出反应的化学方程式:___________ 。
(3)当 接触含有
接触含有 的空气时,其表面会逐渐发黑
的空气时,其表面会逐渐发黑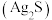 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。
(4)碱性条件下,向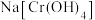 溶液中加入
溶液中加入 ,反应生成
,反应生成 ,写出反应的离子方程式:
,写出反应的离子方程式:___________ 。
(1)工业上用碳酸钠与铝土矿
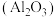 焙烧得到可溶性含铝化合物,写出该含铝化合物的化学式:
焙烧得到可溶性含铝化合物,写出该含铝化合物的化学式:(2)焦炭、
 和
和 在高温下反应,得到
在高温下反应,得到 和一种可燃性气体,写出反应的化学方程式:
和一种可燃性气体,写出反应的化学方程式:(3)当
 接触含有
接触含有 的空气时,其表面会逐渐发黑
的空气时,其表面会逐渐发黑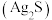 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)碱性条件下,向
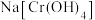 溶液中加入
溶液中加入 ,反应生成
,反应生成 ,写出反应的离子方程式:
,写出反应的离子方程式:
您最近一年使用:0次
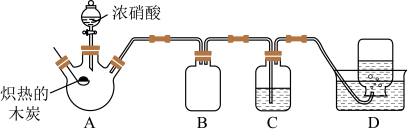
7 . 某化学小组采用如图所示装置对浓硝酸与木炭的反应进行探究(已知:
 )。
)。
(1)实验开始前,首先进行的操作是____________ 。
(2)装有浓硝酸的仪器的名称为____________ 。
(3)写出炽热的木炭与浓硝酸反应的化学方程式:________________ 。
(4)装置B的作用是________________ 。
(5)装置D中集气瓶收集到了无色气体,部分同学认为该气体是NO,还有部分同学认为是 。写出一种检验该气体的方法:
。写出一种检验该气体的方法:__________________ 。
(6)在催化剂作用下加热, 可用于处理
可用于处理 ,所得产物为
,所得产物为 和
和 ,则
,则 与
与 反应时,反应中的氧化剂是
反应时,反应中的氧化剂是___________ ,还原产物和氧化产物的质量之比为___________ 。每生成1.96g  ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为___________ 。如果用氨来处理NO,有关反应的化学方程式为_____________ 。

 )。
)。
(1)实验开始前,首先进行的操作是
(2)装有浓硝酸的仪器的名称为
(3)写出炽热的木炭与浓硝酸反应的化学方程式:
(4)装置B的作用是
(5)装置D中集气瓶收集到了无色气体,部分同学认为该气体是NO,还有部分同学认为是
 。写出一种检验该气体的方法:
。写出一种检验该气体的方法:(6)在催化剂作用下加热,
 可用于处理
可用于处理 ,所得产物为
,所得产物为 和
和 ,则
,则 与
与 反应时,反应中的氧化剂是
反应时,反应中的氧化剂是 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为
您最近一年使用:0次
解题方法
8 . 多功能净水剂高铁酸钠( )主要用于饮用水处理,
)主要用于饮用水处理, 进入水中能杀灭水中细菌,同时会生成
进入水中能杀灭水中细菌,同时会生成 胶体,
胶体, 胶体通过吸附水中悬浮物达到净水的功能。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可表示为:
胶体通过吸附水中悬浮物达到净水的功能。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可表示为:
 。回答下列问题:
。回答下列问题:
(1) 中Fe元素的化合价
中Fe元素的化合价___________
(2)由上述化学原理可知 的氧化性比NaClO的氧化性
的氧化性比NaClO的氧化性___________ (填“强”或“弱”);
(3)将上述化学反应方程式改写为离子反应方程式___________ ;
(4) 沉淀没有净水作用,而
沉淀没有净水作用,而 胶体则可以净水,形成这样差异的本质原因是
胶体则可以净水,形成这样差异的本质原因是___________ ;
(5) 具有杀菌消毒是利用其
具有杀菌消毒是利用其___________ 的性质;
(6)请用单线桥法标出上述反应的电子转移方向和数目___________ ;
(7)制备8.3g 需要消耗
需要消耗___________ gNaOH。
 )主要用于饮用水处理,
)主要用于饮用水处理, 进入水中能杀灭水中细菌,同时会生成
进入水中能杀灭水中细菌,同时会生成 胶体,
胶体, 胶体通过吸附水中悬浮物达到净水的功能。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可表示为:
胶体通过吸附水中悬浮物达到净水的功能。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可表示为:
 。回答下列问题:
。回答下列问题:(1)
 中Fe元素的化合价
中Fe元素的化合价(2)由上述化学原理可知
 的氧化性比NaClO的氧化性
的氧化性比NaClO的氧化性(3)将上述化学反应方程式改写为离子反应方程式
(4)
 沉淀没有净水作用,而
沉淀没有净水作用,而 胶体则可以净水,形成这样差异的本质原因是
胶体则可以净水,形成这样差异的本质原因是(5)
 具有杀菌消毒是利用其
具有杀菌消毒是利用其(6)请用单线桥法标出上述反应的电子转移方向和数目
(7)制备8.3g
 需要消耗
需要消耗
您最近一年使用:0次
解题方法
9 . 亚氯酸的 ,常温常压下二氧化氯
,常温常压下二氧化氯 是一种黄绿色气体,它具有漂白性,消毒能力较强,可替代传统的液氯作为饮用水消毒杀菌剂。实验室用以下方式制备
是一种黄绿色气体,它具有漂白性,消毒能力较强,可替代传统的液氯作为饮用水消毒杀菌剂。实验室用以下方式制备 :
:____________ 。
② 在水溶液中很快水解成
在水溶液中很快水解成 和另一种化合物,该化合物名称为:
和另一种化合物,该化合物名称为:______ 。上述流程中在 酸性溶液条件下加入
酸性溶液条件下加入 反应的离子方程式为:
反应的离子方程式为:____________ 。
(2)纯 易分解爆炸,故常与
易分解爆炸,故常与 的烧碱溶液反应生成
的烧碱溶液反应生成 保存,需要时再通过溶于酸溶液反应获得
保存,需要时再通过溶于酸溶液反应获得 ,该反应刚开始十分缓慢,稍后一段时间产生气体急剧加快。下列说法正确的是______。
,该反应刚开始十分缓慢,稍后一段时间产生气体急剧加快。下列说法正确的是______。
(3)设计实验验证溶液 中的金属阳离子与氯离子
中的金属阳离子与氯离子____________ 。
 ,常温常压下二氧化氯
,常温常压下二氧化氯 是一种黄绿色气体,它具有漂白性,消毒能力较强,可替代传统的液氯作为饮用水消毒杀菌剂。实验室用以下方式制备
是一种黄绿色气体,它具有漂白性,消毒能力较强,可替代传统的液氯作为饮用水消毒杀菌剂。实验室用以下方式制备 :
: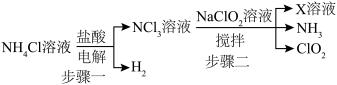
②
 在水溶液中很快水解成
在水溶液中很快水解成 和另一种化合物,该化合物名称为:
和另一种化合物,该化合物名称为: 酸性溶液条件下加入
酸性溶液条件下加入 反应的离子方程式为:
反应的离子方程式为:(2)纯
 易分解爆炸,故常与
易分解爆炸,故常与 的烧碱溶液反应生成
的烧碱溶液反应生成 保存,需要时再通过溶于酸溶液反应获得
保存,需要时再通过溶于酸溶液反应获得 ,该反应刚开始十分缓慢,稍后一段时间产生气体急剧加快。下列说法正确的是______。
,该反应刚开始十分缓慢,稍后一段时间产生气体急剧加快。下列说法正确的是______。| A.亚氯酸钠有强氧化性,在溶液中水解显酸性 |
B. 和 和 在碱性溶液中反应时, 在碱性溶液中反应时, 表现还原性 表现还原性 |
C.将 溶液进行加热浓缩,蒸发结晶,过滤洗涤,得到 溶液进行加热浓缩,蒸发结晶,过滤洗涤,得到 |
D.两份相同 溶液分别与等 溶液分别与等 的盐酸和硫酸反应,与盐酸反应可能快 的盐酸和硫酸反应,与盐酸反应可能快 |
(3)设计实验验证溶液
 中的金属阳离子与氯离子
中的金属阳离子与氯离子
您最近一年使用:0次
解题方法
10 . 过氧化钙 是一种白色或淡黄色的结晶状粉末,不溶于乙醇,易溶于酸,遇湿空气或水会长时间持续放出氧气,常在鱼类养殖、作物栽培、污水处理时作供氧剂。某实验学习小组按以下流程制备过氧化钙:
是一种白色或淡黄色的结晶状粉末,不溶于乙醇,易溶于酸,遇湿空气或水会长时间持续放出氧气,常在鱼类养殖、作物栽培、污水处理时作供氧剂。某实验学习小组按以下流程制备过氧化钙:______ 气体,需要除去该气体的原因是______ 。
(2)下列说法正确的是_________。
(3)步骤②中生成 的反应为
的反应为____________ 。
(4)用下图的装置对产品 质量分数进行测定(夹持装置省略)
质量分数进行测定(夹持装置省略)_________________ (保留三位有效数字),则此实验也可以通过测量____________________ 来计算产品的质量分数。
 是一种白色或淡黄色的结晶状粉末,不溶于乙醇,易溶于酸,遇湿空气或水会长时间持续放出氧气,常在鱼类养殖、作物栽培、污水处理时作供氧剂。某实验学习小组按以下流程制备过氧化钙:
是一种白色或淡黄色的结晶状粉末,不溶于乙醇,易溶于酸,遇湿空气或水会长时间持续放出氧气,常在鱼类养殖、作物栽培、污水处理时作供氧剂。某实验学习小组按以下流程制备过氧化钙: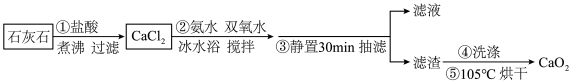
(2)下列说法正确的是_________。
| A.步骤①反应时盐酸过量,可保证较大的钙离子浓度 |
| B.步骤③静置的时间越长,则得到产品颗粒就越细小 |
| C.步骤③抽滤时,可用耐酸的玻璃砂芯漏斗进行过滤 |
| D.步骤⑤操作将滤渣用滤纸包裹后置于坩埚中再烘干 |
(3)步骤②中生成
 的反应为
的反应为(4)用下图的装置对产品
 质量分数进行测定(夹持装置省略)
质量分数进行测定(夹持装置省略)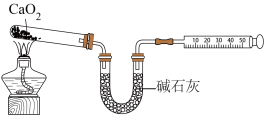
您最近一年使用:0次



