名校
解题方法
1 . 实验室用KI、酸性 溶液、
溶液、 为原料制备并收集
为原料制备并收集 ,下列关于实验装置说法错误是
,下列关于实验装置说法错误是
 溶液、
溶液、 为原料制备并收集
为原料制备并收集 ,下列关于实验装置说法错误是
,下列关于实验装置说法错误是
A.在Ⅰ中烧杯溶解KI并加入酸性 反应 反应 |
B.用 萃取,取Ⅱ中分液漏斗上层紫色溶液 萃取,取Ⅱ中分液漏斗上层紫色溶液 |
C.用Ⅲ装置蒸馏紫色溶液,回收 并获得粗碘 并获得粗碘 |
| D.用Ⅳ装置分离提纯粗碘 |
您最近一年使用:0次
解题方法
2 . 化学与科技、生活密切相关,下列说法正确的是
| A.75%的乙醇与84消毒液都具有强氧化性,可以杀菌消毒 |
| B.食品中常放一个包装袋,装有的硅胶、生石灰、还原铁粉等物质均为抗氧化剂 |
| C.我国空间站上使用大量高性能氮化硼陶瓷,氮化硼为分子晶体 |
D.将水果放在浸泡过 的硅藻土中运输,可以防止水果过熟变质 的硅藻土中运输,可以防止水果过熟变质 |
您最近一年使用:0次
解题方法
3 .  和
和 都具有广泛的用途。
都具有广泛的用途。
Ⅰ.工业上用软锰矿(主要含 )和硫锰矿(主要含
)和硫锰矿(主要含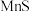 )联合制备
)联合制备 的流程如图。
的流程如图。
(1)为提高浸出速率,可采取的措施有_________________ (答出两条即可)。
(2)浸出过程中产生的 对
对 与
与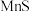 的反应起催化作用,机理如下。
的反应起催化作用,机理如下。
ⅰ.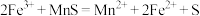 ;
;
ⅱ._________________ (离子方程式)。
(3)流程图中采用①和②共同除去浸出液中金属阳离子杂质,解释不能单独使用①去除这些杂质离子的原因:_____________ 。
(4)滤渣2的主要成分是_________________ 。
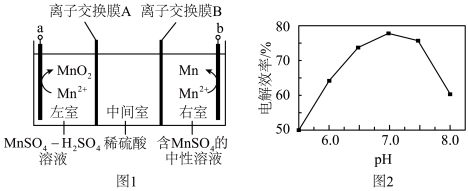
Ⅱ.以 溶液为原料,用图1装置(
溶液为原料,用图1装置(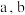 均为惰性电极)同步制备
均为惰性电极)同步制备 和
和 。
。_________________ 。
(6)图1中 电极上
电极上 的电解效率
的电解效率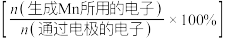 与溶液
与溶液 的关系如图2所示。随
的关系如图2所示。随 的增大,电解效率先增大后减小的原因是
的增大,电解效率先增大后减小的原因是_________________ 。
 和
和 都具有广泛的用途。
都具有广泛的用途。Ⅰ.工业上用软锰矿(主要含
 )和硫锰矿(主要含
)和硫锰矿(主要含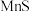 )联合制备
)联合制备 的流程如图。
的流程如图。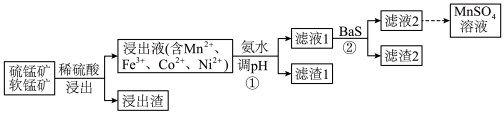
| 硫化物 | 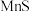 |  |  |  (易溶) (易溶) |
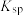 | 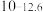 | 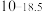 |  | |
| 氢氧化物 |  | 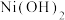 |  |  |
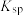 | 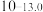 | 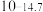 | 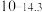 | 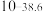 |
(1)为提高浸出速率,可采取的措施有
(2)浸出过程中产生的
 对
对 与
与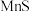 的反应起催化作用,机理如下。
的反应起催化作用,机理如下。ⅰ.
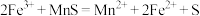 ;
;ⅱ.
(3)流程图中采用①和②共同除去浸出液中金属阳离子杂质,解释不能单独使用①去除这些杂质离子的原因:
(4)滤渣2的主要成分是
Ⅱ.以
 溶液为原料,用图1装置(
溶液为原料,用图1装置(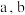 均为惰性电极)同步制备
均为惰性电极)同步制备 和
和 。
。
(6)图1中
 电极上
电极上 的电解效率
的电解效率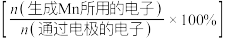 与溶液
与溶液 的关系如图2所示。随
的关系如图2所示。随 的增大,电解效率先增大后减小的原因是
的增大,电解效率先增大后减小的原因是
您最近一年使用:0次
名校
解题方法
4 . 某小组按如下步骤探究二氧化硫与铜单质、Cu2+的反应:
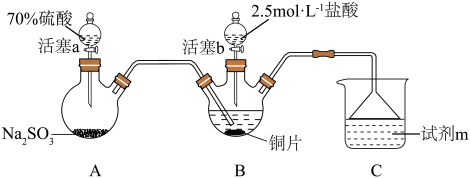
ⅰ.按图示连接好装置。
ⅲ.关闭活塞b,打开活塞a.光亮的紫红色铜片很快变暗,并有黑色的Cu2S生成,同时溶液变为棕色,此时溶液中的铜元素以[CuCl3]2-(棕黄色)的形式存在。
ⅳ.静置后,取上层棕色的清液于试管中,加入一定量蒸馏水稀释,溶液中有白色沉淀CuCl析出。
(1)装置A中发生反应的化学方程式为___________ ,该反应中硫酸体现出的化学性质为___________ ;装置C的作用是___________ ,试剂m可选择___________ (填标号)。
a.饱和NaCl溶液 b.浓硫酸 c.NaOH浓溶液
(2)步骤ⅲ中,SO2在盐酸中与Cu反应的离子方程式为___________ ;步骤ⅳ中发生反应的离子方程式为[CuCl3]2-⇌CuCl↓+2Cl-,下列有关该反应的说法正确的是___________ (填标号)。
A.该反应中有电子的转移
B.反应经过足够长的时间后,[CuCl3]2-中的Cu元素能全部沉淀
C.溶液中,[CuCl3]2-和Cl-能同时存在
D.其他条件不变,当溶液的颜色不再改变时,表明该反应在该条件下达到最大限度
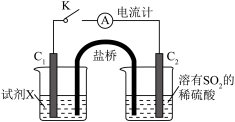
(3)在通风橱中利用如下装置进一步探究SO2与Cu2+的反应,盐桥(内有琼脂和饱和氯化钾溶液)用于连接两电极的电解质溶液。实验②中,闭合K后,C2电极上发生的电极反应为___________ ;不考虑其他副反应及Cu2+进入盐桥,实验②中,电路中转移0.02mole-时,左侧烧杯溶液中Cu2+的质量减少___________ g。
ⅰ.按图示连接好装置。
ⅲ.关闭活塞b,打开活塞a.光亮的紫红色铜片很快变暗,并有黑色的Cu2S生成,同时溶液变为棕色,此时溶液中的铜元素以[CuCl3]2-(棕黄色)的形式存在。
ⅳ.静置后,取上层棕色的清液于试管中,加入一定量蒸馏水稀释,溶液中有白色沉淀CuCl析出。
(1)装置A中发生反应的化学方程式为
a.饱和NaCl溶液 b.浓硫酸 c.NaOH浓溶液
(2)步骤ⅲ中,SO2在盐酸中与Cu反应的离子方程式为
A.该反应中有电子的转移
B.反应经过足够长的时间后,[CuCl3]2-中的Cu元素能全部沉淀
C.溶液中,[CuCl3]2-和Cl-能同时存在
D.其他条件不变,当溶液的颜色不再改变时,表明该反应在该条件下达到最大限度
(3)在通风橱中利用如下装置进一步探究SO2与Cu2+的反应,盐桥(内有琼脂和饱和氯化钾溶液)用于连接两电极的电解质溶液。实验②中,闭合K后,C2电极上发生的电极反应为
| 实验装置图 |
| ||
| 序号 | 试剂X | 实验现象 | |
| 电流计 | C1附近溶液 | ||
| ① | 0.1mol·L-1CuSO4溶液 | 指针几乎不偏转 | 无明显现象 |
| ② | 0.1mol·L-1NaCl和0.1mol·L-1CuSO4的混合溶液(足量) | 指针明显偏转 | 溶液变棕黄色 |
您最近一年使用:0次
5 . 连二亚硫酸钠 俗称保险粉,是印染工业中常用的漂白剂。实验室制备流程如下:
俗称保险粉,是印染工业中常用的漂白剂。实验室制备流程如下:
 俗称保险粉,是印染工业中常用的漂白剂。实验室制备流程如下:
俗称保险粉,是印染工业中常用的漂白剂。实验室制备流程如下: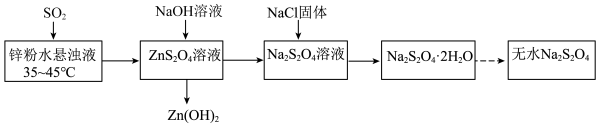
| A.将锌粉溶于水形成悬浊液可以提高反应速率 |
B.生成 的反应中氧化剂和还原剂物质的量之比为 的反应中氧化剂和还原剂物质的量之比为 |
C.温度超过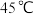 会导致 会导致 溶解度降低 溶解度降低 |
D.加入 有利于 有利于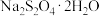 析出,提高产率 析出,提高产率 |
您最近一年使用:0次
名校
6 . 标准电极电位指离子有效浓度为1mol/L时相对标准氢电极的电极电位差值,电对的标准电极电势 越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①
越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①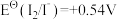 ;②
;②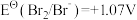 ;③
;③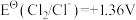 ;④
;④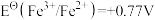 ;⑤
;⑤ ;⑥
;⑥ 。下列有关说法正确的是
。下列有关说法正确的是
 越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①
越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①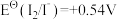 ;②
;②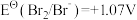 ;③
;③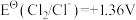 ;④
;④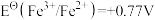 ;⑤
;⑤ ;⑥
;⑥ 。下列有关说法正确的是
。下列有关说法正确的是A.向1mol/L的HBr溶液中滴加 溶液,无明显现象发生 溶液,无明显现象发生 |
B.2mol/L的 与2mol/L的稀盐酸等体积混合有大量 与2mol/L的稀盐酸等体积混合有大量 产生 产生 |
C.在含 、 、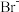 、 、 的混合溶液中若仅氧化 的混合溶液中若仅氧化 ,最佳的氧化剂是 ,最佳的氧化剂是 |
D.浓度相等时,还原性: |
您最近一年使用:0次
名校
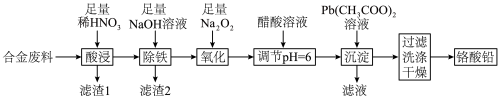
7 . 铬酸铅(PbCrO4)是黄色涂料“铬黄”的主要成分,实验室由某合金废料(主要成分为Fe、C、Cr2O3)制备PbCrO4的流程如图:
回答下列问题:
(1)基态82Pb2+的价层电子排布图为_______ 。
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是_______ (用化学方程式解释)。
(3)“滤渣2”中电负性最大的元素是_______ (填元素符号)。
(4)“氧化”时发生反应的离子方程式为_______ 。
(5)“调节pH=6”的目的是_______ 。
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
①结合PbX2的熔点变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______ (填“增强”“不变”或“减弱”,后同)、共价性_______ 。
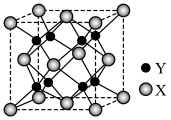
②PbF2的立方晶胞如图所示,其中X代表的离子是_______ (填离子符号);若该晶胞参数为anm,则正、负离子的最小核间距为_______ pm。
回答下列问题:
(1)基态82Pb2+的价层电子排布图为
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是
(3)“滤渣2”中电负性最大的元素是
(4)“氧化”时发生反应的离子方程式为
(5)“调节pH=6”的目的是
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
| 二卤化铅 | PbF2 | PbCl2 | PbBr2 | PbI2 |
| 熔点/℃ | 824 | 501 | 373 | 402 |
②PbF2的立方晶胞如图所示,其中X代表的离子是
您最近一年使用:0次
2024-05-12更新
|
142次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三下学期适应性月考(九)理综试卷-高中化学
名校
8 . 燃煤产生的烟气中含有较多 、
、 、
、 等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是
等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是
 、
、 、
、 等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是
等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是A.将 通入足量的 通入足量的 溶液中,发生反应的化学方程式为 溶液中,发生反应的化学方程式为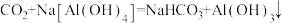 |
B.将 通入足量的酸性高锰酸钾溶液中,发生反应的离子方程式为 通入足量的酸性高锰酸钾溶液中,发生反应的离子方程式为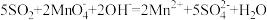 |
C.将 通入烧碱溶液中,发生反应的化学方程式为 通入烧碱溶液中,发生反应的化学方程式为 |
D.将 通入足量的次氯酸钠溶液中,发生反应的离子方程式为 通入足量的次氯酸钠溶液中,发生反应的离子方程式为 |
您最近一年使用:0次
名校
解题方法
9 . 以下是一系列非金属元素间的置换反应,其中不能说明反应前的非金属单质的氧化性强于产物中非金属单质的氧化性的是
A. | B.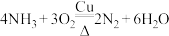 |
C. | D. |
您最近一年使用:0次
名校
解题方法
10 . 按要求写出下列反应的方程式:
(1)实验室制氨气的化学方程式:___________ 。
(2)浓硝酸久置呈黄色的原因用化学方程式解释:___________ 。
(3)工业制粗硅的化学方程式:___________ 。
(4)往硅酸钠溶液中通入过量二氧化碳的离子方程式:___________ 。
(5) 与稀硫酸反应的离子方程式:
与稀硫酸反应的离子方程式:___________ 。
(6)澄清石灰水中通入少量 的离子方程式:
的离子方程式:___________ 。
(7)银锌电池是一种常见的化学电源,其反应原理: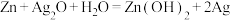 ,其工作原理如图所示。
,其工作原理如图所示。 电极反应式为
电极反应式为___________ 。
(8)将用导线相连的两个铂电极插入 溶液中,然后向两极分别通入
溶液中,然后向两极分别通入 和
和 ,则发生了原电池反应,该原电池中的负极反应式为
,则发生了原电池反应,该原电池中的负极反应式为___________ 。
(1)实验室制氨气的化学方程式:
(2)浓硝酸久置呈黄色的原因用化学方程式解释:
(3)工业制粗硅的化学方程式:
(4)往硅酸钠溶液中通入过量二氧化碳的离子方程式:
(5)
 与稀硫酸反应的离子方程式:
与稀硫酸反应的离子方程式:(6)澄清石灰水中通入少量
 的离子方程式:
的离子方程式:(7)银锌电池是一种常见的化学电源,其反应原理:
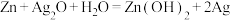 ,其工作原理如图所示。
,其工作原理如图所示。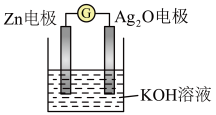
 电极反应式为
电极反应式为(8)将用导线相连的两个铂电极插入
 溶液中,然后向两极分别通入
溶液中,然后向两极分别通入 和
和 ,则发生了原电池反应,该原电池中的负极反应式为
,则发生了原电池反应,该原电池中的负极反应式为
您最近一年使用:0次