名校
解题方法
1 . 正钒酸(H3VO4)溶于水,其氧化性大于氯气,酸性条件下与乙二酸(H2C2O4)发生离子反应: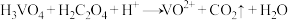 (未配平)。下列说法错误的是
(未配平)。下列说法错误的是
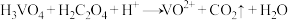 (未配平)。下列说法错误的是
(未配平)。下列说法错误的是A.该反应中,还原剂与氧化剂的物质的量之比为 |
B.每生成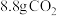 ,转移 ,转移 电子 电子 |
C.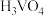 为强酸 为强酸 |
D.向正钒酸溶液中通入一定量的 ,溶液变浑浊 ,溶液变浑浊 |
您最近一年使用:0次
2 . AgCl可溶于氨水生成Ag(NH3)2Cl,Ag(NH3)2Cl与NH3反应可生成Ag。反应如下:4Ag(NH3)2Cl + N2H4 + 4H2O = 4Ag↓ + N2↑ + 4NH4Cl + 4NH3·H2O。下列关于该反应说法正确的是
| A.Ag(NH3)2Cl发生氧化反应 |
| B.还原性:N2H4<Ag |
C.N2H4的结构式为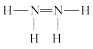 |
| D.每生成标准状况下11.2LN2,反应中转移2mol电子 |
您最近一年使用:0次
名校
3 . 利用氨的催化氧化原理制备硝酸并进行喷泉实验,装置如图所示(省略夹持装置),下列说法正确的是

A.可以利用 制备氨气 制备氨气 |
| B.一段时间后,可以在圆底烧瓶观察到无色喷泉 |
C.若要液体充满圆底烧瓶,理论上通入的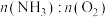 小于1∶2 小于1∶2 |
D.1mol  完全转化为硝酸,转移电子的数目为8 完全转化为硝酸,转移电子的数目为8 |
您最近一年使用:0次
2024-04-27更新
|
102次组卷
|
2卷引用:湖北省部分学校2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
4 . 硫铁矿(主要成分为FeS2)是工业制硫酸的主要原料。硫铁矿烧渣中含有Fe2O3、Fe3O4、Al2O3等成分,可用于制备硫酸和绿矾(FeSO4·7H2O),流程示意图如下。
(1)硫元素位于周期表中第___________ 周期,第___________ 族。
(2)硫铁矿煅烧时反应的化学方程式为___________ 。
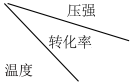
(3)SO2的催化氧化是工业制硫酸的关键步骤,压强和温度对SO2转化率的影响如下表:
为提高SO2的转化率,该反应应选择的温度是___________ ℃,压强采用“常压”的主要原因为___________ 。
(4)“还原”和“除铝”能否交换顺序?___________ (填“能”或“否”),原因是___________
(5)“结晶”过程的步骤如下:___________ (填操作和现象)。
(6)称取w g制得的晶体样品,加入适量水和稀硫酸溶解,滴入c mol/L的K2Cr2O7溶液,发生反应:6Fe2++ +14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为
+14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为___________ 。
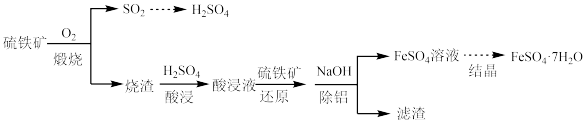
| Fe3+ | A13+ | Fe2+ | |
| 开始沉淀时的pH | |1.5 | 3.3 | 6.5 |
| 沉淀完全时的pH | 3.7 | 5.2 | 9.7 |
(1)硫元素位于周期表中第
(2)硫铁矿煅烧时反应的化学方程式为
(3)SO2的催化氧化是工业制硫酸的关键步骤,压强和温度对SO2转化率的影响如下表:
| 0.1 MPa | 0.5 MPa | 1 MPa | 10 MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
(4)“还原”和“除铝”能否交换顺序?
(5)“结晶”过程的步骤如下:
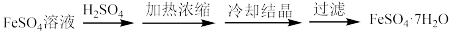
(6)称取w g制得的晶体样品,加入适量水和稀硫酸溶解,滴入c mol/L的K2Cr2O7溶液,发生反应:6Fe2++
 +14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为
+14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为
您最近一年使用:0次
名校
5 . 下列方程式或转化关系不正确的是
A.氨催化氧化生成N2O的化学方程式为2NH3+2O2 N2O+3H2O N2O+3H2O |
B.NH4Cl溶液与稀NaOH溶液反应的离子方程式为 +OH-=NH3∙H2O +OH-=NH3∙H2O |
C.N2 NH3 NH3 NH4Cl NH4Cl |
D.NH3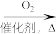 NO2 NO2 O2 O2 |
您最近一年使用:0次
名校
解题方法
6 . 炼铁的原理是利用CO还原铁的氧化物。以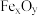 代表铁的氧化物,写出高温下CO冶炼铁的化学方程式:
代表铁的氧化物,写出高温下CO冶炼铁的化学方程式:___________ 。
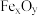 代表铁的氧化物,写出高温下CO冶炼铁的化学方程式:
代表铁的氧化物,写出高温下CO冶炼铁的化学方程式:
您最近一年使用:0次
名校
解题方法
7 . 已知还原性: ,则将
,则将 通入到
通入到 、
、 、
、 的混合溶液中,
的混合溶液中, 、
、 、
、 生成的先后顺序为
生成的先后顺序为
 ,则将
,则将 通入到
通入到 、
、 、
、 的混合溶液中,
的混合溶液中, 、
、 、
、 生成的先后顺序为
生成的先后顺序为A. , , , , | B. , , , , | C. , , , , | D. , , , , |
您最近一年使用:0次
名校
解题方法
8 . 七水硫酸锌在农业中可用作微量元素肥料,也被广泛用于工业领域。锌渣制备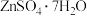 的工艺流程如下。
的工艺流程如下。 ,含有少量
,含有少量 下列说法正确的是
下列说法正确的是
 的工艺流程如下。
的工艺流程如下。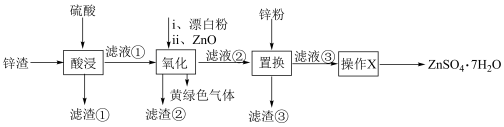
 ,含有少量
,含有少量 下列说法正确的是
下列说法正确的是A.滤渣①为 ,滤渣③为 ,滤渣③为 和 和 |
B.氧化操作发生的反应为: |
C.加入 的主要作用是调节溶液的 的主要作用是调节溶液的 |
| D.操作X用到的玻璃仪器有蒸发皿、玻璃棒、漏斗 |
您最近一年使用:0次
名校
9 . 目前汽车安全气囊的气体发生剂主要由叠氮化钠、三氧化二铁、硝酸铵等物质组成,下列说法正确的是
| A.安全气囊打开时,产生的气体只有氮气 |
| B.硝酸铵的作用只是吸收叠氮化钠分解产生的热量 |
| C.三氧化二铁的作用是与金属钠反应,防止钠造成二次伤害 |
| D.硝酸铵性质很稳定 |
您最近一年使用:0次
解题方法
10 . 联氨(N2H4)又称肼,在航天、能源等领域具有广泛应用。
Ⅰ.N2H4分子中所有原子均达到稀有气体原子的稳定结构。
(1)写出N2H4的电子式。___________
(2)N2H4晶体受热熔化时,破坏的作用力有___________。
(3)酸碱质子理论提出:凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱。
①由N2H4+H2O N2H
N2H +OH- 可知N2H4是
+OH- 可知N2H4是___________ 。
A.酸 B.碱
②选择足量的盐酸或NaOH溶液与N2H4充分反应,生成盐的化学式为___________ 。
Ⅱ.肼具有强还原性,可作火箭推进剂燃料,反应的热化学方程式表示为:2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ∆H<0。
(4)①结合化学反应原理分析,该反应可自发进行的原因是___________ 。
②N2H4和N2O4作为火箭推进剂的主要原因是___________ 。
Ⅲ.肼可还原钴离子制备纳米金属钴,纳米金属钴具有特殊的物理、化学和表面性质。
(5)下列状态的钴中,电离最外层一个电子所需能量最小的是_______ 。
A.[Ar]3d74s2 B.[Ar]3d74s14p1 C.[Ar]3d74s1
(6)Co2+被N2H4还原的离子方程式如下,完成方程式并配平_______ 。
 Co2++
Co2++ N2H4+
N2H4+ ___________=
___________= Co↓+
Co↓+ N2↑+
N2↑+ H2O
H2O
当转移7.224×1024个电子数时,生成金属钴___________ 克。
(7)金属钴可以形成多种配合物。一种配合物由Co3+、NH3、Cl-、H2O组成,实验显示Co3+、NH3、Cl-、H2O的物质的量之比为1∶3∶3∶1.向该配合物的水溶液加入AgNO3溶液,只能沉淀出三分之一的Cl-。
①该配合物的化学式是___________ 。
A.[Co(NH3)3ClH2O]Cl2 B.[Co(NH3)3Cl2H2O]Cl C.[Co(NH3)3H2O]Cl3
②该配合物的配体有___________ 。
Ⅰ.N2H4分子中所有原子均达到稀有气体原子的稳定结构。
(1)写出N2H4的电子式。
(2)N2H4晶体受热熔化时,破坏的作用力有___________。
| A.范德华力 | B.氢键 | C.共价键 | D.离子键 |
①由N2H4+H2O
 N2H
N2H +OH- 可知N2H4是
+OH- 可知N2H4是A.酸 B.碱
②选择足量的盐酸或NaOH溶液与N2H4充分反应,生成盐的化学式为
Ⅱ.肼具有强还原性,可作火箭推进剂燃料,反应的热化学方程式表示为:2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ∆H<0。
(4)①结合化学反应原理分析,该反应可自发进行的原因是
②N2H4和N2O4作为火箭推进剂的主要原因是
Ⅲ.肼可还原钴离子制备纳米金属钴,纳米金属钴具有特殊的物理、化学和表面性质。
(5)下列状态的钴中,电离最外层一个电子所需能量最小的是
A.[Ar]3d74s2 B.[Ar]3d74s14p1 C.[Ar]3d74s1
(6)Co2+被N2H4还原的离子方程式如下,完成方程式并配平
 Co2++
Co2++ N2H4+
N2H4+ ___________=
___________= Co↓+
Co↓+ N2↑+
N2↑+ H2O
H2O当转移7.224×1024个电子数时,生成金属钴
(7)金属钴可以形成多种配合物。一种配合物由Co3+、NH3、Cl-、H2O组成,实验显示Co3+、NH3、Cl-、H2O的物质的量之比为1∶3∶3∶1.向该配合物的水溶液加入AgNO3溶液,只能沉淀出三分之一的Cl-。
①该配合物的化学式是
A.[Co(NH3)3ClH2O]Cl2 B.[Co(NH3)3Cl2H2O]Cl C.[Co(NH3)3H2O]Cl3
②该配合物的配体有
您最近一年使用:0次