名校
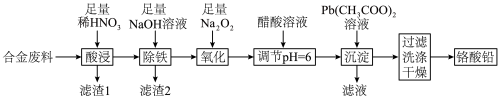
1 . 铬酸铅(PbCrO4)是黄色涂料“铬黄”的主要成分,实验室由某合金废料(主要成分为Fe、C、Cr2O3)制备PbCrO4的流程如图:
回答下列问题:
(1)基态82Pb2+的价层电子排布图为_______ 。
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是_______ (用化学方程式解释)。
(3)“滤渣2”中电负性最大的元素是_______ (填元素符号)。
(4)“氧化”时发生反应的离子方程式为_______ 。
(5)“调节pH=6”的目的是_______ 。
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
①结合PbX2的熔点变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______ (填“增强”“不变”或“减弱”,后同)、共价性_______ 。
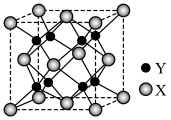
②PbF2的立方晶胞如图所示,其中X代表的离子是_______ (填离子符号);若该晶胞参数为anm,则正、负离子的最小核间距为_______ pm。
回答下列问题:
(1)基态82Pb2+的价层电子排布图为
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是
(3)“滤渣2”中电负性最大的元素是
(4)“氧化”时发生反应的离子方程式为
(5)“调节pH=6”的目的是
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
| 二卤化铅 | PbF2 | PbCl2 | PbBr2 | PbI2 |
| 熔点/℃ | 824 | 501 | 373 | 402 |
②PbF2的立方晶胞如图所示,其中X代表的离子是
您最近一年使用:0次
2024-05-12更新
|
149次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三下学期适应性月考(九)理综试卷-高中化学
2 . 连二亚硫酸钠 俗称保险粉,是印染工业中常用的漂白剂。实验室制备流程如下:
俗称保险粉,是印染工业中常用的漂白剂。实验室制备流程如下:
 俗称保险粉,是印染工业中常用的漂白剂。实验室制备流程如下:
俗称保险粉,是印染工业中常用的漂白剂。实验室制备流程如下: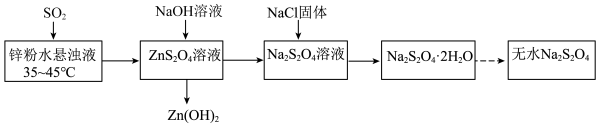
| A.将锌粉溶于水形成悬浊液可以提高反应速率 |
B.生成 的反应中氧化剂和还原剂物质的量之比为 的反应中氧化剂和还原剂物质的量之比为 |
C.温度超过 会导致 会导致 溶解度降低 溶解度降低 |
D.加入 有利于 有利于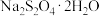 析出,提高产率 析出,提高产率 |
您最近一年使用:0次
名校
3 . 燃煤产生的烟气中含有较多 、
、 、
、 等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是
等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是
 、
、 、
、 等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是
等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是A.将 通入足量的 通入足量的 溶液中,发生反应的化学方程式为 溶液中,发生反应的化学方程式为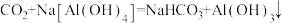 |
B.将 通入足量的酸性高锰酸钾溶液中,发生反应的离子方程式为 通入足量的酸性高锰酸钾溶液中,发生反应的离子方程式为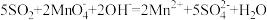 |
C.将 通入烧碱溶液中,发生反应的化学方程式为 通入烧碱溶液中,发生反应的化学方程式为 |
D.将 通入足量的次氯酸钠溶液中,发生反应的离子方程式为 通入足量的次氯酸钠溶液中,发生反应的离子方程式为 |
您最近一年使用:0次
名校
4 . 标准电极电位指离子有效浓度为1mol/L时相对标准氢电极的电极电位差值,电对的标准电极电势 越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①
越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①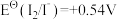 ;②
;②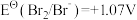 ;③
;③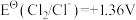 ;④
;④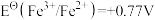 ;⑤
;⑤ ;⑥
;⑥ 。下列有关说法正确的是
。下列有关说法正确的是
 越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①
越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①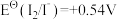 ;②
;②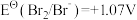 ;③
;③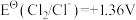 ;④
;④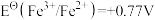 ;⑤
;⑤ ;⑥
;⑥ 。下列有关说法正确的是
。下列有关说法正确的是A.向1mol/L的HBr溶液中滴加 溶液,无明显现象发生 溶液,无明显现象发生 |
B.2mol/L的 与2mol/L的稀盐酸等体积混合有大量 与2mol/L的稀盐酸等体积混合有大量 产生 产生 |
C.在含 、 、 、 、 的混合溶液中若仅氧化 的混合溶液中若仅氧化 ,最佳的氧化剂是 ,最佳的氧化剂是 |
D.浓度相等时,还原性: |
您最近一年使用:0次
名校
解题方法
5 . 以下是一系列非金属元素间的置换反应,其中不能说明反应前的非金属单质的氧化性强于产物中非金属单质的氧化性的是
A. | B.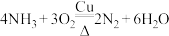 |
C. | D. |
您最近一年使用:0次
名校
解题方法
6 . 按要求写出下列反应的方程式:
(1)实验室制氨气的化学方程式:___________ 。
(2)浓硝酸久置呈黄色的原因用化学方程式解释:___________ 。
(3)工业制粗硅的化学方程式:___________ 。
(4)往硅酸钠溶液中通入过量二氧化碳的离子方程式:___________ 。
(5) 与稀硫酸反应的离子方程式:
与稀硫酸反应的离子方程式:___________ 。
(6)澄清石灰水中通入少量 的离子方程式:
的离子方程式:___________ 。
(7)银锌电池是一种常见的化学电源,其反应原理: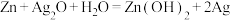 ,其工作原理如图所示。
,其工作原理如图所示。 电极反应式为
电极反应式为___________ 。
(8)将用导线相连的两个铂电极插入 溶液中,然后向两极分别通入
溶液中,然后向两极分别通入 和
和 ,则发生了原电池反应,该原电池中的负极反应式为
,则发生了原电池反应,该原电池中的负极反应式为___________ 。
(1)实验室制氨气的化学方程式:
(2)浓硝酸久置呈黄色的原因用化学方程式解释:
(3)工业制粗硅的化学方程式:
(4)往硅酸钠溶液中通入过量二氧化碳的离子方程式:
(5)
 与稀硫酸反应的离子方程式:
与稀硫酸反应的离子方程式:(6)澄清石灰水中通入少量
 的离子方程式:
的离子方程式:(7)银锌电池是一种常见的化学电源,其反应原理:
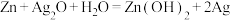 ,其工作原理如图所示。
,其工作原理如图所示。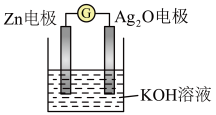
 电极反应式为
电极反应式为(8)将用导线相连的两个铂电极插入
 溶液中,然后向两极分别通入
溶液中,然后向两极分别通入 和
和 ,则发生了原电池反应,该原电池中的负极反应式为
,则发生了原电池反应,该原电池中的负极反应式为
您最近一年使用:0次
解题方法
7 . 下列物质应用体现其氧化性的是
| A.甲酸可用作医疗器械的消毒剂 |
| B.山梨酸钾、山梨酸、NaNO2等常用作食品防腐剂 |
| C.浸泡过高锰酸钾溶液的硅藻土可用于水果的保鲜剂 |
| D.用H2SO4和双氧水混合液可溶解Co2O3制得CoSO4溶液 |
您最近一年使用:0次
8 . 我国的冶金工业十分发达,钢铁年产量已达到十亿吨,占世界产量的一半以上,同时有色金属产量也超过了七千万吨。
(1)铜是人类最早使用的金属,其电阻率小、延展性好,常用于制作电路板,在使用氯化铁溶液蚀刻铜制电路板时,发生反应的化学方程式为___________ 。
(2)铝与 溶液反应的化学方程式为
溶液反应的化学方程式为___________ ;铝的化学性质较活泼,但在空气中不会完全锈蚀,其原因是___________ 。
(3)电镀是一种常见的金属处理工艺,然而在生产过程中,电镀厂会产生大量的高毒性废水,将其直接排放会造成严重的污染。因此,废水的处理是电镀行业面临的主要问题之一。
①在电镀之前,镀件需要用酸性 溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的
溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的 固体,将
固体,将 还原为
还原为 ,则还原过程中发生反应的离子方程式为
,则还原过程中发生反应的离子方程式为___________ ,当有 被完全处理时,理论上需要加入
被完全处理时,理论上需要加入 的质量为
的质量为___________ 。
②为了减缓镀件表面的金属沉积速率,得到均匀、光滑的镀层,电解液中除重金属盐外,还需要加入剧毒的 。已知
。已知 中各原子均满足8电子稳定结构,则
中各原子均满足8电子稳定结构,则 的电子式为
的电子式为___________ 。在碱性的废电解液中通入氯气可以将 氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为
氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为___________ 。
(1)铜是人类最早使用的金属,其电阻率小、延展性好,常用于制作电路板,在使用氯化铁溶液蚀刻铜制电路板时,发生反应的化学方程式为
(2)铝与
 溶液反应的化学方程式为
溶液反应的化学方程式为(3)电镀是一种常见的金属处理工艺,然而在生产过程中,电镀厂会产生大量的高毒性废水,将其直接排放会造成严重的污染。因此,废水的处理是电镀行业面临的主要问题之一。
①在电镀之前,镀件需要用酸性
 溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的
溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的 固体,将
固体,将 还原为
还原为 ,则还原过程中发生反应的离子方程式为
,则还原过程中发生反应的离子方程式为 被完全处理时,理论上需要加入
被完全处理时,理论上需要加入 的质量为
的质量为②为了减缓镀件表面的金属沉积速率,得到均匀、光滑的镀层,电解液中除重金属盐外,还需要加入剧毒的
 。已知
。已知 中各原子均满足8电子稳定结构,则
中各原子均满足8电子稳定结构,则 的电子式为
的电子式为 氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为
氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为
您最近一年使用:0次
9 . 合成氨是人类科学技术发展史上的一项重大成就。实验室利用如右图所示装置及药品制取氨气:_____________ 。
(2)下列装置中,可用于收集氨的是_________ (填标号)。______________ 。
(4)在一定条件下,将2molN2和6molH2在体积恒为5L的密闭容器中混合,发生如下反应:N2(g)+3H2(g) 2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:
2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:
①2min内该反应的平均反应速率v(N2)=______ mol/(L·min)
②一段时间后反应达到平衡,密闭容器中混合气体的压强比反应前减少了25%,计算此时容器中NH3的浓度为____________ mol/L。
③能说明该反应已经达到平衡状态的是____________ 。
a.气体的密度保持不变 b.NH3的含量保持不变
c.N2和H2的物质的量之比为1:3 d.N2的转化率不再发生改变
(5)工业上通常用氨转化法处理含NO、NO2等氮氧化物的尾气:已知8 mol氨恰好能将含NO和NO2共7mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为_____ 。
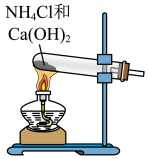
(2)下列装置中,可用于收集氨的是
a.  b.
b. 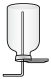 c.
c. 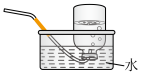
(4)在一定条件下,将2molN2和6molH2在体积恒为5L的密闭容器中混合,发生如下反应:N2(g)+3H2(g)
 2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:
2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:①2min内该反应的平均反应速率v(N2)=
②一段时间后反应达到平衡,密闭容器中混合气体的压强比反应前减少了25%,计算此时容器中NH3的浓度为
③能说明该反应已经达到平衡状态的是
a.气体的密度保持不变 b.NH3的含量保持不变
c.N2和H2的物质的量之比为1:3 d.N2的转化率不再发生改变
(5)工业上通常用氨转化法处理含NO、NO2等氮氧化物的尾气:已知8 mol氨恰好能将含NO和NO2共7mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
您最近一年使用:0次
名校
10 . 含硫石油、煤、天然气的燃烧,硫化矿石的熔炼和焙烧,及各种含硫原料的加工生产过程等均能产生二氧化硫。
(1)画出硫原子的原子结构示意图_______ 。
(2)实验室常用亚硫酸钠固体和70%的浓硫酸反应制取二氧化硫,该反应的化学方程式_______ ;用该方法制备 时,能随时控制反应速率的装置是
时,能随时控制反应速率的装置是_______ (填标号),原因是_______ 。 的含量,某小组同学将空气样品经过管道通入盛有
的含量,某小组同学将空气样品经过管道通入盛有 酸性
酸性 溶液的密闭容器中,若管道中空气流量为
溶液的密闭容器中,若管道中空气流量为 ,经过
,经过 恰好使酸性
恰好使酸性 溶液完全褪色(假定样品中的
溶液完全褪色(假定样品中的 可被溶液充分吸收且样品中其他成分不与
可被溶液充分吸收且样品中其他成分不与 反应)。
反应)。
①写出上述反应的离子方程式_______ 。
②该空气样品中 的含量为
的含量为_______  。
。
(4)为了减少二氧化硫产生的危害,可以采取的措施是_______ 。
(1)画出硫原子的原子结构示意图
(2)实验室常用亚硫酸钠固体和70%的浓硫酸反应制取二氧化硫,该反应的化学方程式
 时,能随时控制反应速率的装置是
时,能随时控制反应速率的装置是A. B.
B. C.
C.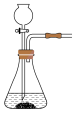 D.
D.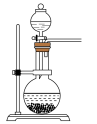
 的含量,某小组同学将空气样品经过管道通入盛有
的含量,某小组同学将空气样品经过管道通入盛有 酸性
酸性 溶液的密闭容器中,若管道中空气流量为
溶液的密闭容器中,若管道中空气流量为 ,经过
,经过 恰好使酸性
恰好使酸性 溶液完全褪色(假定样品中的
溶液完全褪色(假定样品中的 可被溶液充分吸收且样品中其他成分不与
可被溶液充分吸收且样品中其他成分不与 反应)。
反应)。①写出上述反应的离子方程式
②该空气样品中
 的含量为
的含量为 。
。(4)为了减少二氧化硫产生的危害,可以采取的措施是
您最近一年使用:0次



