1 . 我国C919大飞机制造过程中用到的某些新型材料是以 作催化剂制备的。
作催化剂制备的。 是白色粉末,微溶于水、难溶于乙醇及稀硫酸,在空气中迅速被氧化成绿色。某实验小组设计如下装置(夹持装置略),利用
是白色粉末,微溶于水、难溶于乙醇及稀硫酸,在空气中迅速被氧化成绿色。某实验小组设计如下装置(夹持装置略),利用 溶液与
溶液与 气体制备
气体制备 。回答下列问题:
。回答下列问题:
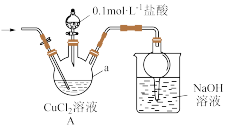
(1)检查装置气密性并加入药品,①打开止水夹先氮气通一段时间,后关闭止水夹;②打开分液漏斗旋塞,向仪器a中加盐酸调pH至2~3,关闭分液漏斗旋塞;③……,溶液中产生白色沉淀;④待反应完全后,再通一段时间。装置A中发生反应的离子方程式为_______ ;仪器a的名称是_______ ;操作③是_______ 。
(2)将装置A中的混合物过滤、洗涤、干燥后密封保存,洗涤时选择的最佳洗涤液是___ (填标号);判断沉淀洗涤干净的实验操作是___ 。
A.蒸馏水 B.稀硫酸 C.95%的乙醇 D.饱和食盐水
(3)测定产品纯度:称取所制备的CuCl产品mg,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,配成250mL溶液。移取25.00mL溶液于锥形瓶中,用cmol/L的Ce(SO4)2标准溶液滴定至终点,再重复滴定2次,三次平均消耗Ce(SO4)2标准溶液VmL,反应中Ce4+被还原为Ce3+,则样品中CuCl (摩尔质量为Mg/mol)的质量分数为___ 。滴定时Ce(SO4)2标准溶液应盛放在_______ (填“酸式”或“碱式”)滴定管中;下列操作会导致质量分数的测定值偏大的是_______ (填标号)。
A.滴定终点时,仰视读数
B.滴定前锥形瓶用蒸馏水洗净后没有干燥
C.滴定管在滴定前有气泡,滴定后气泡消失
D.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
 作催化剂制备的。
作催化剂制备的。 是白色粉末,微溶于水、难溶于乙醇及稀硫酸,在空气中迅速被氧化成绿色。某实验小组设计如下装置(夹持装置略),利用
是白色粉末,微溶于水、难溶于乙醇及稀硫酸,在空气中迅速被氧化成绿色。某实验小组设计如下装置(夹持装置略),利用 溶液与
溶液与 气体制备
气体制备 。回答下列问题:
。回答下列问题:
(1)检查装置气密性并加入药品,①打开止水夹先氮气通一段时间,后关闭止水夹;②打开分液漏斗旋塞,向仪器a中加盐酸调pH至2~3,关闭分液漏斗旋塞;③……,溶液中产生白色沉淀;④待反应完全后,再通一段时间。装置A中发生反应的离子方程式为
(2)将装置A中的混合物过滤、洗涤、干燥后密封保存,洗涤时选择的最佳洗涤液是
A.蒸馏水 B.稀硫酸 C.95%的乙醇 D.饱和食盐水
(3)测定产品纯度:称取所制备的CuCl产品mg,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,配成250mL溶液。移取25.00mL溶液于锥形瓶中,用cmol/L的Ce(SO4)2标准溶液滴定至终点,再重复滴定2次,三次平均消耗Ce(SO4)2标准溶液VmL,反应中Ce4+被还原为Ce3+,则样品中CuCl (摩尔质量为Mg/mol)的质量分数为
A.滴定终点时,仰视读数
B.滴定前锥形瓶用蒸馏水洗净后没有干燥
C.滴定管在滴定前有气泡,滴定后气泡消失
D.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
您最近一年使用:0次
名校
2 . 铋(Bi)位于元素周期表中第VA族,其价态为+3时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰MnSO4溶液,向其中依次滴加下列溶液,对应现象如表所示:
在上述实验条件下,下列结论正确的是
| 加入溶液 | ①适量铋酸钠溶液 | ②过量双氧水 | ③适量KI-淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 溶液紫红色消失,产生气泡 | 溶液缓慢变成蓝色 |
| A.氧化性强弱顺序为:BiO3->MnO4->H2O2>I2 |
| B.H2O2被高锰酸根离子还原成O2 |
| C.H2O2具有氧化性,把KI氧化成I2 |
| D.KI-淀粉溶液中滴加铋酸钠溶液,溶液不一定变蓝色 |
您最近一年使用:0次
2020-04-30更新
|
1220次组卷
|
3卷引用:山东省潍坊市临朐县2020届高三第一次综合模拟考试化学试题
解题方法
3 . 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4。回答下列问题:
(1)PbO2和PbO的混合物中,Pb和O的物质的量之比为8:11,则混合物中,PbO2和PbO的物质的量之比为___ 。
(2)用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式可表示为___ 。
(3)PbO2具有强氧化性,能氧化浓HCl生成Cl2,+4价的Pb被还原成+2价的Pb,+2价的Pb不具备该性质,据下列信息回答问题:①将amolPbO2加热分解一段时间,生成PbO和O2;②将①所得固体加入足量的浓盐酸,收集产生的Cl2;已知在①加热一段时间后剩余的固体中,+2价的Pb占铅元素质量分数为x;则反应过程中生成的氧气和氯气物质的量总和是多少___ ?
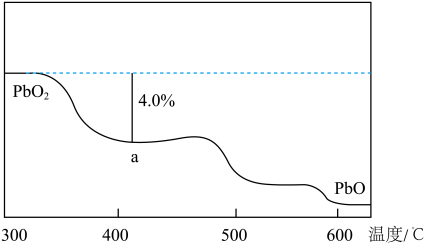
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%【(即样品起始质量—a点固体质量)/样品起始质量×100%】的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值___ 、___ 。
(1)PbO2和PbO的混合物中,Pb和O的物质的量之比为8:11,则混合物中,PbO2和PbO的物质的量之比为
(2)用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式可表示为
(3)PbO2具有强氧化性,能氧化浓HCl生成Cl2,+4价的Pb被还原成+2价的Pb,+2价的Pb不具备该性质,据下列信息回答问题:①将amolPbO2加热分解一段时间,生成PbO和O2;②将①所得固体加入足量的浓盐酸,收集产生的Cl2;已知在①加热一段时间后剩余的固体中,+2价的Pb占铅元素质量分数为x;则反应过程中生成的氧气和氯气物质的量总和是多少
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%【(即样品起始质量—a点固体质量)/样品起始质量×100%】的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值

您最近一年使用:0次
名校
4 . Ⅰ.回答下列问题:
(1)(NH4)2SO4溶液可以用来除铁锈的原因:_______ (用离子方程式说明)。
(2)部分弱酸的电离平衡常数如表:
室温下①0.1mol·L-1HCOONa②0.1 mol·L-1 NaClO③0.1 mol·L-1Na2CO3④ 0.1 mol·L-1NaHCO3溶液的pH由大到小的关系为_______ 。
(3)根据上述电离平衡常数,试写出下列化学反应的离子方程式:
①向碳酸钠溶液中通入少量二氧化硫气体_______
②向碳酸钠溶液中滴入过量甲酸_______
Ⅱ.常温下,HNO2的电离平衡常数Ka =2.6×10-4,亚硝酸钠(NaNO2)是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。
(4)亚硝酸钠有毒,不能随意丢弃,实验室一般将其与饱和氯化铵溶液共热使之转化成无毒无公害的物质,其产物之一为无色无味气体,则反应的化学方程式为_______ 。
(5)某活动小组同学设计实验方案鉴别NaCl溶液和NaNO2溶液,请填写下列表格。
Ⅲ.活动小组同学采用如下装置制备NaNO2(装置可重复使用,部分夹持仪器已省略)。

已知:①2NO+Na2O2=2NaNO2,
②酸性条件下,NO、NO2都能与 反应生成
反应生成 和Mn2+;NaNO2能使酸性高锰酸钾溶液褪色。
和Mn2+;NaNO2能使酸性高锰酸钾溶液褪色。
(6)实验装置的连接顺序为A→_______→_______→_______→_______→B;_
(7)C瓶内发生反应的离子方程式为_______ 。
(8)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10mol·L-1的酸性KMnO4溶液进行滴定,实验所得数据如下表。
①第一组实验数据出现较明显异常,造成异常的原因可能是_______ (填字母序号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.滴定前滴定管尖嘴中有气泡,滴定后滴定管尖嘴无气泡
c.判断终点时,滴入一滴酸性KMnO4溶液,锥形瓶内溶液呈浅红色,振荡后立即褪色
d.观察滴定终点时俯视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为_______ 。
(1)(NH4)2SO4溶液可以用来除铁锈的原因:
(2)部分弱酸的电离平衡常数如表:
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka =1.77×10-4 | Ka= 4.0×10-8 | Ka1=4.3 ×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(3)根据上述电离平衡常数,试写出下列化学反应的离子方程式:
①向碳酸钠溶液中通入少量二氧化硫气体
②向碳酸钠溶液中滴入过量甲酸
Ⅱ.常温下,HNO2的电离平衡常数Ka =2.6×10-4,亚硝酸钠(NaNO2)是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。
(4)亚硝酸钠有毒,不能随意丢弃,实验室一般将其与饱和氯化铵溶液共热使之转化成无毒无公害的物质,其产物之一为无色无味气体,则反应的化学方程式为
(5)某活动小组同学设计实验方案鉴别NaCl溶液和NaNO2溶液,请填写下列表格。
| 选用药品 | 实验现象(NaNO2溶液) | 利用NaNO2的性质 |
| ①酚酞试液 | ||
| ②淀粉-KI试纸 |
Ⅲ.活动小组同学采用如下装置制备NaNO2(装置可重复使用,部分夹持仪器已省略)。

已知:①2NO+Na2O2=2NaNO2,
②酸性条件下,NO、NO2都能与
 反应生成
反应生成 和Mn2+;NaNO2能使酸性高锰酸钾溶液褪色。
和Mn2+;NaNO2能使酸性高锰酸钾溶液褪色。(6)实验装置的连接顺序为A→_______→_______→_______→_______→B;
(7)C瓶内发生反应的离子方程式为
(8)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10mol·L-1的酸性KMnO4溶液进行滴定,实验所得数据如下表。
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.滴定前滴定管尖嘴中有气泡,滴定后滴定管尖嘴无气泡
c.判断终点时,滴入一滴酸性KMnO4溶液,锥形瓶内溶液呈浅红色,振荡后立即褪色
d.观察滴定终点时俯视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为
您最近一年使用:0次
5 . 二氧化氯(ClO2)和臭氧(O3)均具有强氧化性,可用于水处理。ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸;O3是一种微溶于水的蓝色气体,其体积分数超过25%时容易引起爆炸。
(1)以FeS2作还原剂,在硫酸介质中还原NaClO3制备ClO2,同时得到Fe2(SO4)3、Na2SO4,该反应的化学方程式为___________________________________________________ 。
(2)以过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2处理含CN-废水。实验室模拟该过程的实验装置(夹持装置略)如图1所示。
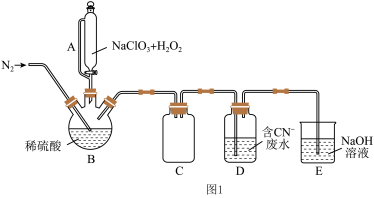
①反应容器B应置于30 ℃左右的水浴中,目的是__________________________________ 。
②通入氮气的目的除了有利于将ClO2排出,还有_________________________________ 。
③ClO2处理含CN-废水的离子方程式为_______________________________________ 。
④装置D的作用是________________________________ 。
(3)某科研机构经多次实验,利用O3、KCl和工业废渣(主要成分为NaNO3和NaNO2)制得KNO3,相关工艺参数如图2和图3[浓缩蒸发水量=m(反应液蒸发的水量)/m(反应液的总质量)]。
请选择最佳实验方案,参与完成他们的制备:将100 g废渣加入80 mL热水中,充分搅拌,__________________________________________ ,在50 ℃恒温水浴锅中充分反应后,过滤,__________________________ ,趁热过滤,________________________ , 过滤得KNO3粗品,再重结晶提纯得到KNO3。(需使用的试剂及用量:60 L 0.008 g/L O3和80 g KCl固体)

(1)以FeS2作还原剂,在硫酸介质中还原NaClO3制备ClO2,同时得到Fe2(SO4)3、Na2SO4,该反应的化学方程式为
(2)以过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2处理含CN-废水。实验室模拟该过程的实验装置(夹持装置略)如图1所示。

①反应容器B应置于30 ℃左右的水浴中,目的是
②通入氮气的目的除了有利于将ClO2排出,还有
③ClO2处理含CN-废水的离子方程式为
④装置D的作用是
(3)某科研机构经多次实验,利用O3、KCl和工业废渣(主要成分为NaNO3和NaNO2)制得KNO3,相关工艺参数如图2和图3[浓缩蒸发水量=m(反应液蒸发的水量)/m(反应液的总质量)]。
请选择最佳实验方案,参与完成他们的制备:将100 g废渣加入80 mL热水中,充分搅拌,

您最近一年使用:0次
2019-02-20更新
|
959次组卷
|
3卷引用:【市级联考】江苏省泰州市2019届高三上学期期末考试化学试题
【市级联考】江苏省泰州市2019届高三上学期期末考试化学试题(已下线)专题讲座(九) 热点实验综合探究 (精练)-2021年高考化学一轮复习讲练测江西省瑞金市第二中学2022-2023学年高三上学期开学考试化学试题
13-14高三下·浙江·阶段练习
解题方法
6 . 短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
(1)X元素在元素周期表中的位置_______ 。
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阳离子的电子式为_________ 。
(3)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为_______________ 。
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器_____ (填“能”或“不能”)用来腌制咸菜,原因是__________ 。
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式___________ 。关于该电池的下列说法,正确的是_______

A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性其对应的酸常存在于自然界中的植物中,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:_________________

X | Y | Z | |
W |
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阳离子的电子式为
(3)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式

A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性其对应的酸常存在于自然界中的植物中,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:

您最近一年使用:0次
名校
7 . 铝与NO3-在酸性或碱性条件下均可反应,回答下列问题:
(1)为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,完善并配平该反应:__ Al +___NO3- + ___OH- = ___ _________+ ____N2↑ + ____H2O。每消耗1mol NO3-,转移的电子数目为_____ 。
(2)某同学取一定质量的铁铝合金与100mLxmol/L稀硝酸充分反应,反应过程中没有气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)的关系如图所示。
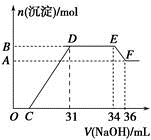
①写出EF段发生反应的离子方程式_________________________________________ 。
② C点对应的溶液中含有的阳离子除Na+外,还含有___________________________ 。
③ x=_________ 。
④铁铝合金中铝的物质的量分数为______________________ 。
(1)为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,完善并配平该反应:
(2)某同学取一定质量的铁铝合金与100mLxmol/L稀硝酸充分反应,反应过程中没有气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)的关系如图所示。

①写出EF段发生反应的离子方程式
② C点对应的溶液中含有的阳离子除Na+外,还含有
③ x=
④铁铝合金中铝的物质的量分数为
您最近一年使用:0次
2018-02-06更新
|
1136次组卷
|
2卷引用:重庆一中2017-2018学年高一上学期期末化学试题
解题方法
8 . 天津港“8.12”特别重大爆炸事故教训深刻。氰化钠(N元素显﹣3价)属于剧毒化学品,处理氰化物的方法主要有两种:
(1)碱性氯化法是在碱性条件下通入氯气,氯气将CN﹣氧化成无污染的气体。请补充并配平该反应的离子方程式:CN﹣+OH﹣+Cl2═CO2+ + +H2O。处理35吨NaCN,理论上需要液氯 吨。
(2)过氧化氢氧化法:NaCN+H2O2+H2O═NaHCO3+NH3↑。检测水坑里氰化钠的浓度,取水样1mL,加入11mL1mol•L﹣1H2O2溶液,充分反应后,加入过量的KI固体,充分反应后调节pH至7左右,用0.2500mol•L﹣1Na2S2O3溶液8.00mL(已知:实验中涉及的部分离子方程式为: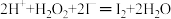 、
、 )。请计算水坑里氰化钠的浓度。
)。请计算水坑里氰化钠的浓度。
(1)碱性氯化法是在碱性条件下通入氯气,氯气将CN﹣氧化成无污染的气体。请补充并配平该反应的离子方程式:CN﹣+OH﹣+Cl2═CO2+ + +H2O。处理35吨NaCN,理论上需要液氯 吨。
(2)过氧化氢氧化法:NaCN+H2O2+H2O═NaHCO3+NH3↑。检测水坑里氰化钠的浓度,取水样1mL,加入11mL1mol•L﹣1H2O2溶液,充分反应后,加入过量的KI固体,充分反应后调节pH至7左右,用0.2500mol•L﹣1Na2S2O3溶液8.00mL(已知:实验中涉及的部分离子方程式为:
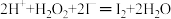 、
、 )。请计算水坑里氰化钠的浓度。
)。请计算水坑里氰化钠的浓度。
您最近一年使用:0次
名校
9 . F2和Xe在一定条件下生成氧化性极强且极易与水反应的XeF2、XeF4和XeF6三种化合物。其中XeF4与水可发生如下反应:6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑.下列判断中正确的是
| A.上述反应中氧化剂和还原剂的物质的量之比为1∶2 |
| B.XeF4按以上方式与水反应,每生成3molO2,转移12mol电子 |
| C.XeF2加入水中,在水分子的作用下,将重新生成Xe和F2 |
| D.XeF2、XeF4和XeF6在空气中都能长期存放 |
您最近一年使用:0次
2017-02-28更新
|
1337次组卷
|
2卷引用:2017届湖南省衡阳市高三下学期第一次联考理综化学试卷
名校
10 . 将一定量的Cl2通入体积为40mL、浓度为7.5mol/L的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),测得反应后溶液中有三种含氯元素的离子,其中ClO-物质的量为0.06mol和ClO3-物质的量0.03mol,下列说法不正确的是
| A.该反应的离子方程式为:5Cl2+10OH-=7Cl-+2ClO-+ClO3—+5H2O |
| B.该反应中,氧化剂与还原剂物质的量之比为5:3 |
| C.上述苛性钾溶液中含有0.3mol的KOH |
| D.反应后生成的ClO-和ClO3-两种离子在一定条件下均有氧化性 |
您最近一年使用:0次
2016-12-09更新
|
2582次组卷
|
5卷引用:2015-2016学年江苏省南通中学高一上学期期末化学试卷



