名校
1 . 半导体芯片行业是金属靶材的主要应用领域之一。利用镍铂靶材废料(主要成分为Ni、Pt以及微量Fe、Al的单质)采用选择性溶解法回收铂并制备硫酸镍晶体的一种工艺流程如下:

已知:①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
②王水是按浓盐酸和浓硝酸的体积比为3∶1配制而成;
③氧化性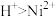
④室温: ;
;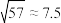
(1)“酸浸”时镍发生反应的化学方程式为_______ 。
(2)铂在王水中生成二元强酸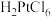 ,其中Pt元素的化合价为
,其中Pt元素的化合价为_______ ,该反应的离子方程式为_______ 。
(3)设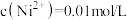 “调pH”应控制的pH范围是
“调pH”应控制的pH范围是_______ 。
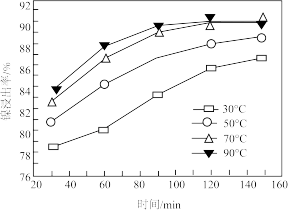
(4)当液固比为4∶1时,"酸浸"过程中镍的浸出率与温度和时间的关系如图所示,“酸浸”的最佳温度和时间是_______ 。
(5)沉铂过程中,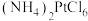 的沉淀率随温度的升高而增大,结合平衡移动原理解释
的沉淀率随温度的升高而增大,结合平衡移动原理解释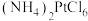 沉淀率随温度变化的主要原因
沉淀率随温度变化的主要原因_______ 。
(6)在“沉铂”过程中,若向 的溶液里加入等体积的
的溶液里加入等体积的 溶液,使
溶液,使 沉淀完全,则加入
沉淀完全,则加入 溶液的浓度最小值为
溶液的浓度最小值为_______ mol/L(结果保留两位小数,忽略溶液混合后体积的变化)。
(7)“操作1”中包括沉淀的洗涤,应选用下列哪种试剂最佳_______。

已知:①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ |  |  |  |
| 开始沉淀时(c=0.01mol/L)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时 (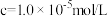 )的pH )的pH | 8.7 | 4.7 | 3.2 | 9.0 |
③氧化性
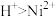
④室温:
 ;
;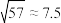
(1)“酸浸”时镍发生反应的化学方程式为
(2)铂在王水中生成二元强酸
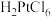 ,其中Pt元素的化合价为
,其中Pt元素的化合价为(3)设
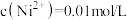 “调pH”应控制的pH范围是
“调pH”应控制的pH范围是(4)当液固比为4∶1时,"酸浸"过程中镍的浸出率与温度和时间的关系如图所示,“酸浸”的最佳温度和时间是

(5)沉铂过程中,
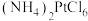 的沉淀率随温度的升高而增大,结合平衡移动原理解释
的沉淀率随温度的升高而增大,结合平衡移动原理解释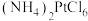 沉淀率随温度变化的主要原因
沉淀率随温度变化的主要原因(6)在“沉铂”过程中,若向
 的溶液里加入等体积的
的溶液里加入等体积的 溶液,使
溶液,使 沉淀完全,则加入
沉淀完全,则加入 溶液的浓度最小值为
溶液的浓度最小值为(7)“操作1”中包括沉淀的洗涤,应选用下列哪种试剂最佳_______。
| A.蒸馏水 | B.浓盐酸 | C.氯化铵溶液 | D.王水 |
您最近一年使用:0次
2022-04-29更新
|
1510次组卷
|
4卷引用:广东省粤港澳大湾区普通高中2022届高三第二次模拟考试化学试题
广东省粤港澳大湾区普通高中2022届高三第二次模拟考试化学试题湖南省衡山县岳云中学2021-2022学年高三下学期期中考试化学试卷(已下线)押广东卷化学第18题 化学工艺流程题-备战2022年高考化学临考题号押题(广东卷)(已下线)2022年全国乙卷高考变式题(非选择题)
名校
2 . 一种利用废铜渣(主要成分CuO,及少量 、
、 等杂质)制备超细铜粉的流程如下:
等杂质)制备超细铜粉的流程如下:
 、
、 等杂质)制备超细铜粉的流程如下:
等杂质)制备超细铜粉的流程如下: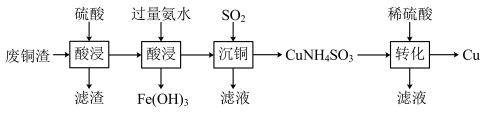
A.“酸浸”所得滤渣的主要成分为 |
B.若向“沉铁”后所得滤液中加入乙醇,析出的深蓝色晶体为 |
| C.“沉铜”发生的反应为复分解反应 |
D.“转化”后所得滤液中含有的主要阳离子: 、 、 、 、 |
您最近一年使用:0次
2023-05-27更新
|
1260次组卷
|
11卷引用:江苏省南通市2023届高三下学期第四次模拟考试化学试题
江苏省南通市2023届高三下学期第四次模拟考试化学试题江苏省淮安市2022-2023学年高二下学期6月期末考试化学试题江苏省盐城市伍佑中学2023届高三下学期模拟预测化学试题(已下线)第7讲 金属材料和金属矿物利用(已下线)考点16 铜及其金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江苏省常州市第一中学2022-2023学年高一下学期期末测试化学试题(已下线)选择题6-10(已下线)选择题6-10河南省许昌市禹州市高级中学2023-2024学年高三下学期4月月考理综试题-高中化学(已下线)专题04 金属与人类文明-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(江苏专用)江苏省泰州市靖江高级中学2023-2024学年高二下学期4月期中考试化学试题
名校
3 . 高效率和高选择性将CO2转化为CH4是CO2资源化利用的途径之一,我国科研工作者开发了一种空腔串联反应器,为电催化还原CO2提供了一种可行的转化方案,其原理如图所示。
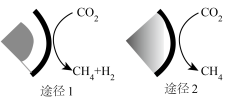
| A.22gCO2中所含共用电子对数目为4NA |
| B.1molCH4中所含质子数和中子数均为10NA |
| C.途径2生成标准状况下22.4LCH4,反应转移电子数为8NA |
| D.途径1所得产物物质的量之比为l:1,形成共价键数目为6NA |
您最近一年使用:0次
2023-03-19更新
|
1287次组卷
|
9卷引用:贵州省毕节市2023届高三诊断性考试(一模)理科综合化学试题
贵州省毕节市2023届高三诊断性考试(一模)理科综合化学试题(已下线)湖北省七市(州)2023届高三3月联合统一调研测试化学试题变式题(选择题1-5)(已下线)专题03 阿伏伽德罗常数的应用福建省莆田第一中学2022-2023学年高二下学期第二学段(期中)考试化学试题辽宁省大连市育明高级中学2023届高三下学期第1次模拟考试化学试题广东省茂名市第一中学2022-2023学年高三下学期5月月考化学试题四川省成都市树德中学2022-2023学年高二下学期5月月考化学试题广东省潮州市2022-2023学年高二下学期期末考试化学试题湖南省岳阳市汨罗市第一中学2023-2024学年高二下学期5月月考化学试题
2023高三上·全国·专题练习
名校
解题方法
4 . 信息型氧化还原反应方程式的书写:
(1)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为_______ 。
(2)滤液(含Fe2+和H+)加入H2O2氧化时发生反应的离子方程式为_______ 。
(3)在稀硫酸中,Z(Cr)的最高价含氧酸的钾盐(橙色)氧化M(O)的一种氢化物,Z(Cr)被还原为+3价,该反应的化学方程式是_______ 。
(4)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为8)中SO 将NO2转化为NO
将NO2转化为NO ,其离子方程式为
,其离子方程式为_______ 。
(5)CuSO4溶液能用作P4中毒的解毒剂,反应可生成P的最高价含氧酸和铜,该反应的化学方程式是_______ 。
(6)KClO3可用于实验室制O2 ,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1,写出该反应的化学方程式:_______ 。
(7)某地污水中的有机污染物主要成分是三氯乙烯(C2HCl3),向此污水中加入KMnO4(高锰酸钾的还原产物为MnO2)溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出该反应的化学方程式:_______ 。
(1)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为
(2)滤液(含Fe2+和H+)加入H2O2氧化时发生反应的离子方程式为
(3)在稀硫酸中,Z(Cr)的最高价含氧酸的钾盐(橙色)氧化M(O)的一种氢化物,Z(Cr)被还原为+3价,该反应的化学方程式是
(4)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为8)中SO
 将NO2转化为NO
将NO2转化为NO ,其离子方程式为
,其离子方程式为(5)CuSO4溶液能用作P4中毒的解毒剂,反应可生成P的最高价含氧酸和铜,该反应的化学方程式是
(6)KClO3可用于实验室制O2 ,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1,写出该反应的化学方程式:
(7)某地污水中的有机污染物主要成分是三氯乙烯(C2HCl3),向此污水中加入KMnO4(高锰酸钾的还原产物为MnO2)溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出该反应的化学方程式:
您最近一年使用:0次
名校
5 . 一种利用有机胺(TBA)联合生产碳酸氢钠和二氯乙烷的工艺流程如图所示。
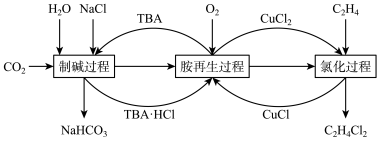
下列说法错误的是

下列说法错误的是
| A.“制碱过程”后通过加热蒸发结晶得到NaHCO3 |
| B.该工艺原子利用率100% |
| C.“氯化过程”每生成lmolC2H4Cl2,总反应中消耗0.5molO2 |
| D.“胺再生过程”反应为4CuCl+O2+4TBA·HCl=4CuCl2+4TBA+2H2O |
您最近一年使用:0次
2022-04-27更新
|
1445次组卷
|
7卷引用:山东省淄博市部分学校2022届高三阶段性诊断考试(二模)化学试题
名校
6 . 2021年,我国科学家首次在实验室实现 到淀粉的全合成,其合成路线如下:设
到淀粉的全合成,其合成路线如下:设 为阿伏加德罗常数,下列有关说法不正确的是
为阿伏加德罗常数,下列有关说法不正确的是
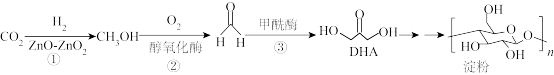
 到淀粉的全合成,其合成路线如下:设
到淀粉的全合成,其合成路线如下:设 为阿伏加德罗常数,下列有关说法不正确的是
为阿伏加德罗常数,下列有关说法不正确的是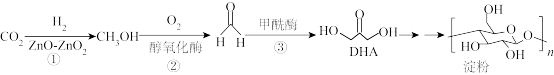
A.标况下,11.2L  中含有共用电子对数目为2 中含有共用电子对数目为2 |
| B.反应②、③无法在高温下进行 |
C.反应②中,3.2g  生成HCHO时转移电子数目为0.2 生成HCHO时转移电子数目为0.2 |
D.1mol DHA与乙酸发生取代反应,可消耗乙酸分子数目为 |
您最近一年使用:0次
2022-03-01更新
|
1432次组卷
|
9卷引用:广东省汕头市2022届高三下学期第一次模拟考试化学试题
广东省汕头市2022届高三下学期第一次模拟考试化学试题(已下线)押广东卷化学第11题 阿伏加德罗常数-备战2022年高考化学临考题号押题(广东卷)北京市通州区2022届高三查缺补漏化学试题北京市顺义牛栏山第一中学2022届高三下学期保温练习化学试题广西南宁市第二中学2021-2022学年高三下学期5月诊断理科综合化学试题北京市第十七中学2021-2022学年高三下学期5月模拟考试化学试题北京市顺义区第一中学2022届高三下学期三模化学试题(已下线)第一章 化学计量在实验中的应用(测)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题09 物质的量-备战2023年高考化学母题题源解密(广东卷)
名校
解题方法
7 . 镍是重要的战略金属资源,一种从某高镁低品位铜镍矿(主要成分为CuFeS2、FeS2、3NiO●4SiO2●H2O、3MgO●4SiO2●H2O等)中回收Cu、Ni的工艺流程如图所示:
回答下列问题:
(1)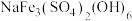 中,
中, 元素的化合价为
元素的化合价为_______ 。
(2)为提高“氧压浸出”的速率,可行的操作有_______ (任填一个)。
(3)“氧压浸出”的滤渣有S和_______ ,该环节中 发生的化学反应方程式为
发生的化学反应方程式为_______ 。
(4)“萃铜”时的反应为: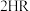 (有机相)
(有机相) (水相)
(水相)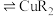 (有机相)
(有机相) (水相),下列说法正确的有_______。
(水相),下列说法正确的有_______。
(5)已知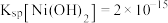 ,“滤液”中
,“滤液”中 ,“沉镍”时,控制
,“沉镍”时,控制 为8.50,此时
为8.50,此时 的沉淀率为
的沉淀率为_______ ,“沉镍”后的母液,含有的主要溶质为_______ (填化学式)。

回答下列问题:
(1)
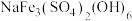 中,
中, 元素的化合价为
元素的化合价为(2)为提高“氧压浸出”的速率,可行的操作有
(3)“氧压浸出”的滤渣有S和
 发生的化学反应方程式为
发生的化学反应方程式为(4)“萃铜”时的反应为:
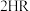 (有机相)
(有机相)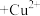 (水相)
(水相)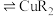 (有机相)
(有机相) (水相),下列说法正确的有_______。
(水相),下列说法正确的有_______。A.向萃取液中加入稀硫酸进行“反萃取”,可得到单质 |
B.萃余液中的阳离子为: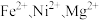 |
C.一定条件下,萃取平衡时,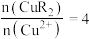 ,则 ,则 的萃取率为80% 的萃取率为80% |
D.为提高 的萃取率,可适当提高溶液 的萃取率,可适当提高溶液 |
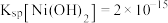 ,“滤液”中
,“滤液”中 ,“沉镍”时,控制
,“沉镍”时,控制 为8.50,此时
为8.50,此时 的沉淀率为
的沉淀率为
您最近一年使用:0次
2023-02-09更新
|
1298次组卷
|
3卷引用:广东省佛山市2023届普通高中教学质量检测(一)化学试题
解题方法
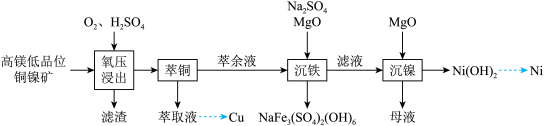
8 . 黄钠铁矾[NaFe3 (SO4)2(OH)6]是一种高效净水剂,Ni(OH)2可作为合成镍钴锰三元电极材料的原料,工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)制备黄钠铁矾和Ni (OH)2,工艺流程如图所示。
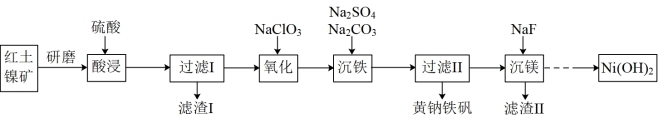
已知:①次亚磷酸钠(NaH2PO2)具有还原性;
②亚磷酸(H3PO3)是二元弱酸。
回答下列问题:
(1)下列说法正确的是_______ (填标号)。
(2)“氧化”过程中发生反应的离子方程式为:_______ ;为 了证明加入的NaClO3已足量,可取“氧化”后的溶液,向其中加入_______ 来检验(填标号)。
a. KSCN 溶液 b. K3[Fe(CN)6]溶液 C.酸性KMnO4溶液
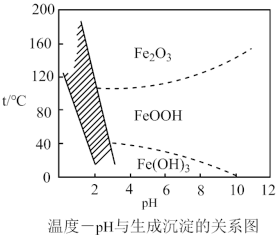
(3)“沉铁” 过程,控制不同的条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域),若控制pH=2.5,沉铁的最佳温度范围为_______ ;若反应在低于40℃时进行,加碳酸钠偏多,则所得黄钠铁矾中混有的杂质是_______ 。
(4)①“沉镁”是生成MgF2沉淀除去Mg2+。若溶液酸度过高,则Mg2+沉淀不完全,原因是_______ 。
②若“沉镁”后溶液的pH=8.0,则此时Ni2+浓度约为_______ mol·L-1 (已知:100.4≈2.5,
Ksp[Ni(OH)2]=10-14.6)。
(5)化学镀镍是金属表面镀镍的常用方法。以NiSO4和NaH2PO2为原料,在90℃的酸性溶液中镀镍,同时生成H3PO3。写出化学镀镍反应的离子方程式_______ 。

已知:①次亚磷酸钠(NaH2PO2)具有还原性;
②亚磷酸(H3PO3)是二元弱酸。
回答下列问题:
(1)下列说法正确的是_______ (填标号)。
| A.研磨粉碎的目的是增大反应速率 |
| B.用浓硫酸可提高“酸浸”时的浸取率 |
| C.过滤时用到的玻璃仪器主要有漏斗、烧杯、玻璃棒 |
| D.“滤渣I”的主要成分为H2SiO3 |
a. KSCN 溶液 b. K3[Fe(CN)6]溶液 C.酸性KMnO4溶液
(3)“沉铁” 过程,控制不同的条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域),若控制pH=2.5,沉铁的最佳温度范围为

(4)①“沉镁”是生成MgF2沉淀除去Mg2+。若溶液酸度过高,则Mg2+沉淀不完全,原因是
②若“沉镁”后溶液的pH=8.0,则此时Ni2+浓度约为
Ksp[Ni(OH)2]=10-14.6)。
(5)化学镀镍是金属表面镀镍的常用方法。以NiSO4和NaH2PO2为原料,在90℃的酸性溶液中镀镍,同时生成H3PO3。写出化学镀镍反应的离子方程式
您最近一年使用:0次
名校
9 . 次磷酸(H3PO2)是一元中强酸,次磷酸钠(NaH2PO2)广泛应用于化学镀镍,次磷酸钠的生产与镀镍过程如图所示。下列有关说法正确的是


A.Ni2+价电子的轨道表示式为 |
| B.“碱溶”时氧化剂与还原剂的物质的量之比为3:1 |
C.PH3、PO 中P的杂化方式相同,键角PO 中P的杂化方式相同,键角PO >PH3 >PH3 |
D.次磷酸铵与足量氢氧化钠共热,发生反应NH +H2PO +H2PO +3OH- +3OH- NH3↑+3H2O+PO NH3↑+3H2O+PO |
您最近一年使用:0次
2022-10-08更新
|
1443次组卷
|
8卷引用:广东省东华高级中学2023届高三上学期模拟考试化学试题
10 . 锑(Sb)可用作阻燃剂、电极材料、催化剂等物质的原材料。一种以辉锑矿(主要成分为Sb2S3,还含有Fe2O3、Al2O3、MgO、SiO2等)为原料提取锑的工艺如下:
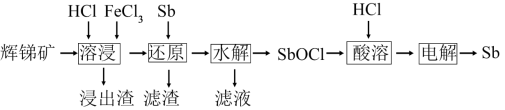
已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“溶浸”时氧化产物是S,Sb2S3被氧化的化学方程式为___________ 。
(2)“还原”时加入Sb的目的是将___________ 还原,提高产物的纯度。
(3)“水解”时需控制溶液pH=2.5。
①Sb3+发生水解的离子方程式为___________ 。
②下列能促进该水解反应的措施有___________ (填字母)。
A.升高温度 B.增大c(H+) C.增大c(Cl-) D.加入Na2CO3粉末
③为避免水解产物中混入Fe(OH)3,Fe3+浓度应小于___________ mol·L-1。
(4)“滤液”中含有的金属阳离子有___________ 。向“滤液”中通入足量___________ (填化学式)气体,再将滤液pH调至3.5,可析出Fe(OH)3沉淀。将沉淀溶于浓盐酸后,产物可返回___________ 工序循环使用。
(5)Sb可由SbCl 电解制得,阴极的电极反应式为
电解制得,阴极的电极反应式为___________ 。

已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| 开始沉淀时(c=0.01mol·L-1)的pH | 2.2 | 3.7 | 7.5 | 9.6 |
| 完全沉淀时(c=1.0×10-5mol·L-1)的pH | 3.2 | 4.7 | 9.0 | 11.1 |
(1)“溶浸”时氧化产物是S,Sb2S3被氧化的化学方程式为
(2)“还原”时加入Sb的目的是将
(3)“水解”时需控制溶液pH=2.5。
①Sb3+发生水解的离子方程式为
②下列能促进该水解反应的措施有
A.升高温度 B.增大c(H+) C.增大c(Cl-) D.加入Na2CO3粉末
③为避免水解产物中混入Fe(OH)3,Fe3+浓度应小于
(4)“滤液”中含有的金属阳离子有
(5)Sb可由SbCl
 电解制得,阴极的电极反应式为
电解制得,阴极的电极反应式为
您最近一年使用:0次
2022-03-17更新
|
1532次组卷
|
4卷引用:广东省广州市2022届高三一模考试化学试题



