1 . 化学在“三废”治理方面发挥着重要的作用。回答下列问题:
Ⅰ.制革厂含硫废水中主要含有 ,需要对含硫废水进行处理与利用。
,需要对含硫废水进行处理与利用。
(1) 的电子式为
的电子式为___________ ;
(2)废水混合处理不但可以同时处理不同类型的废水,同时可以获得某些化工原料。某地区使用含有硫离子的废水治理含有铜离子的废水,写出该反应的离子方程式___________ 。
(3)部分地区采用空气催化氧化法脱硫。该方法以空气中的氧作为氧化剂,将废水中的 转化为
转化为 ,反应中还原剂与氧化剂的物质的量之比为
,反应中还原剂与氧化剂的物质的量之比为___________ 。
Ⅱ.工业上用烟气制酸的废料(主要含S、Se、 、CuO、ZnO、
、CuO、ZnO、 等)为原料提取硒,流程如图:
等)为原料提取硒,流程如图:
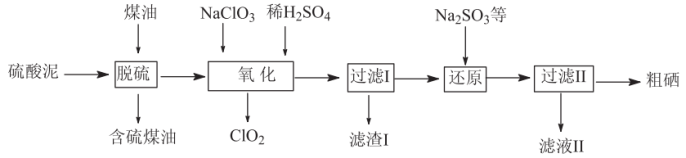
(4)硒与硫是同主族的相邻元素,其在周期表中的位置是___________ 。
(5)“脱硫”过程中,温度控制在95℃,原因是___________ 。
(6)“氧化”过程中,Se转化成弱酸 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
Ⅲ.粗硒经过下列流程可获得亚硒酸钠( )。
)。
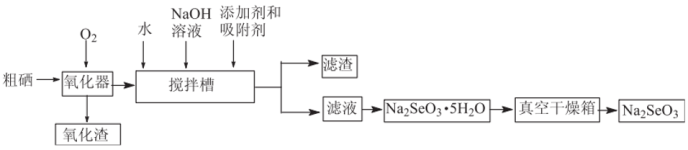
(7)已知在上述合成路线中粗硒在转化为二氧化硒时损失4%,搅拌槽中二氧化硒的利用率为95%,其他损耗忽略不计,试计算利用1t含硒79%的粗硒最终可生产___________ t(精确到0.01t)含亚硒酸钠95%的产品。
Ⅰ.制革厂含硫废水中主要含有
 ,需要对含硫废水进行处理与利用。
,需要对含硫废水进行处理与利用。(1)
 的电子式为
的电子式为(2)废水混合处理不但可以同时处理不同类型的废水,同时可以获得某些化工原料。某地区使用含有硫离子的废水治理含有铜离子的废水,写出该反应的离子方程式
(3)部分地区采用空气催化氧化法脱硫。该方法以空气中的氧作为氧化剂,将废水中的
 转化为
转化为 ,反应中还原剂与氧化剂的物质的量之比为
,反应中还原剂与氧化剂的物质的量之比为Ⅱ.工业上用烟气制酸的废料(主要含S、Se、
 、CuO、ZnO、
、CuO、ZnO、 等)为原料提取硒,流程如图:
等)为原料提取硒,流程如图:
(4)硒与硫是同主族的相邻元素,其在周期表中的位置是
(5)“脱硫”过程中,温度控制在95℃,原因是
(6)“氧化”过程中,Se转化成弱酸
 ,该反应的离子方程式为
,该反应的离子方程式为Ⅲ.粗硒经过下列流程可获得亚硒酸钠(
 )。
)。
(7)已知在上述合成路线中粗硒在转化为二氧化硒时损失4%,搅拌槽中二氧化硒的利用率为95%,其他损耗忽略不计,试计算利用1t含硒79%的粗硒最终可生产
您最近一年使用:0次
名校
2 . 硼氢化钠(NaBH4)和氨硼烷(BNH6)是优良的储氢材料,合成路线如图所示,下列叙述错误的是


| A.硼氢化钠中阴离子的VSEPR模型为正四面体形 |
| B.反应①中氧化剂与还原剂物质的量之比为1∶2 |
| C.SiO2是反应①的催化剂 |
| D.将氨硼烷移出体系有利于提高反应②转化率 |
您最近一年使用:0次
3 . 中国科学院天津工业生物技术研究所在实验室中首次实现从二氧化碳到淀粉分子的全合成,该技术同时解决了粮食危机和气候问题,路线如图所示:

下列说法正确的是:

下列说法正确的是:
A.反应1中,消耗1molCO2转移电子数 |
| B.温度越高,反应②、③的速率一定越快 |
C.将 与足量乙酸发生取代反应,可消耗乙酸 与足量乙酸发生取代反应,可消耗乙酸 |
| D.在Cu催化条件下也可实现反应② |
您最近一年使用:0次
名校
4 . 纳米氧化亚铜(Cu2O,颗粒直径1~100nm)具有特殊的光学、光电和催化性能,采用化学沉淀法制备晶型结构完整、粒度分布均匀的纳米Cu2O(在潮湿空气中会慢慢氧化生成CuO)的合成路线如图所示。下列说法正确的是
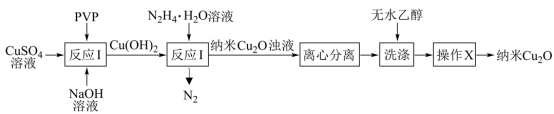

| A.反应Ⅰ为化合反应 |
| B.操作X为过滤 |
| C.反应Ⅱ中,每生成22.4L(标准状况)N2,转移4mol电子 |
| D.“洗涤”时,无水乙醇可用蒸馏水代替 |
您最近一年使用:0次
2021-10-09更新
|
413次组卷
|
3卷引用:重庆市西南大学附属中学2022届高三上学期第二次月考化学试题
5 . 氢化铝锂(LiAlH4)、硼氢化钠(NaBH4)在有机合成中应用广泛。回答下列问题:
(1)工业上制备氢化铝锂方法是:首先高温高压合成氢化铝钠,然后与氯化锂反应,相关化学方程式为Na+Al+2H2 NaAlH4;NaAlH4+LiCl
NaAlH4;NaAlH4+LiCl LiAlH4+NaCl。上述反应涉及的基本反应类型分别为
LiAlH4+NaCl。上述反应涉及的基本反应类型分别为_______ 、_______ 。
(2)NaBH4的电子式为_______ ,其与水反应生成NaBO2,该反应的化学方程式为_______ 。
(3)还原能力(单位质量转移电子数):LiAlH4_______ (填“>”“=”或“<")NaBH4。
(4)工业上湿法合成NaBH4路线如下:

①"合成”步骤中常将NaH分散到矿物油中再与硼酸三甲酯[化学式:B(OCH3)3,易溶于矿物油中]反应,其目的是_______ 。
②“合成”反应的化学方程式为_______ 。
(1)工业上制备氢化铝锂方法是:首先高温高压合成氢化铝钠,然后与氯化锂反应,相关化学方程式为Na+Al+2H2
 NaAlH4;NaAlH4+LiCl
NaAlH4;NaAlH4+LiCl LiAlH4+NaCl。上述反应涉及的基本反应类型分别为
LiAlH4+NaCl。上述反应涉及的基本反应类型分别为(2)NaBH4的电子式为
(3)还原能力(单位质量转移电子数):LiAlH4
(4)工业上湿法合成NaBH4路线如下:

①"合成”步骤中常将NaH分散到矿物油中再与硼酸三甲酯[化学式:B(OCH3)3,易溶于矿物油中]反应,其目的是
②“合成”反应的化学方程式为
您最近一年使用:0次
名校
6 . 2021年,我国科学家首次在实验室实现 到淀粉的全合成,其合成路线如下:设
到淀粉的全合成,其合成路线如下:设 为阿伏加德罗常数,下列有关说法不正确的是
为阿伏加德罗常数,下列有关说法不正确的是
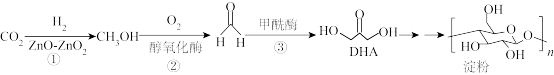
 到淀粉的全合成,其合成路线如下:设
到淀粉的全合成,其合成路线如下:设 为阿伏加德罗常数,下列有关说法不正确的是
为阿伏加德罗常数,下列有关说法不正确的是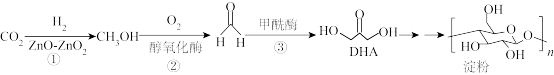
A.标况下,11.2L  中含有共用电子对数目为2 中含有共用电子对数目为2 |
| B.反应②、③无法在高温下进行 |
C.反应②中,3.2g  生成HCHO时转移电子数目为0.2 生成HCHO时转移电子数目为0.2 |
D.1mol DHA与乙酸发生取代反应,可消耗乙酸分子数目为 |
您最近一年使用:0次
2022-03-01更新
|
1425次组卷
|
9卷引用:广东省汕头市2022届高三下学期第一次模拟考试化学试题
广东省汕头市2022届高三下学期第一次模拟考试化学试题(已下线)押广东卷化学第11题 阿伏加德罗常数-备战2022年高考化学临考题号押题(广东卷)北京市通州区2022届高三查缺补漏化学试题北京市顺义牛栏山第一中学2022届高三下学期保温练习化学试题广西南宁市第二中学2021-2022学年高三下学期5月诊断理科综合化学试题北京市第十七中学2021-2022学年高三下学期5月模拟考试化学试题北京市顺义区第一中学2022届高三下学期三模化学试题(已下线)第一章 化学计量在实验中的应用(测)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题09 物质的量-备战2023年高考化学母题题源解密(广东卷)
名校
解题方法
7 .  (四氢铝钠)是一种强还原剂和供氢剂,在有机合成中广泛应用。以铝土矿(主要成分为
(四氢铝钠)是一种强还原剂和供氢剂,在有机合成中广泛应用。以铝土矿(主要成分为 ,含少量
,含少量 、
、 和
和 等)为原料制备四氢铝钠的流程如下。
等)为原料制备四氢铝钠的流程如下。 是酸性氧化物;
是酸性氧化物;
② 。
。
回答下列问题:
(1)浸渣的主要成分是___________ (填化学式)。
(2)“除杂”时铝元素转化的离子方程式为___________ 。
(3)将“沉铝”后的滤液蒸干、灼烧得到的固体是___________ (填化学式)。实验室进行“蒸干、灼烧”时不需要使用的仪器有___________ (填字母)。
A.酒精灯 B.烧杯 C.坩埚 D.蒸发皿
(4)实验室用氢气和钠共热制备 ,
, 的电子式为
的电子式为___________ 。
(5)写出 和
和 反应制备
反应制备 的化学方程式:
的化学方程式:___________ 。
(6)在化学上,含氢还原剂的还原能力用“有效氢”表示。“有效氢”的定义是单位质量含氢还原剂的还原能力相当于多少克氢气。一般地,含氢还原剂中氢元素被氧化成 ,还原能力用失去电子数多少表示。
,还原能力用失去电子数多少表示。 、
、 的“有效氢”之比为
的“有效氢”之比为___________ 。
 (四氢铝钠)是一种强还原剂和供氢剂,在有机合成中广泛应用。以铝土矿(主要成分为
(四氢铝钠)是一种强还原剂和供氢剂,在有机合成中广泛应用。以铝土矿(主要成分为 ,含少量
,含少量 、
、 和
和 等)为原料制备四氢铝钠的流程如下。
等)为原料制备四氢铝钠的流程如下。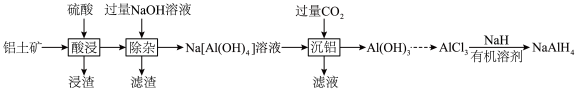
 是酸性氧化物;
是酸性氧化物;②
 。
。回答下列问题:
(1)浸渣的主要成分是
(2)“除杂”时铝元素转化的离子方程式为
(3)将“沉铝”后的滤液蒸干、灼烧得到的固体是
A.酒精灯 B.烧杯 C.坩埚 D.蒸发皿
(4)实验室用氢气和钠共热制备
 ,
, 的电子式为
的电子式为(5)写出
 和
和 反应制备
反应制备 的化学方程式:
的化学方程式:(6)在化学上,含氢还原剂的还原能力用“有效氢”表示。“有效氢”的定义是单位质量含氢还原剂的还原能力相当于多少克氢气。一般地,含氢还原剂中氢元素被氧化成
 ,还原能力用失去电子数多少表示。
,还原能力用失去电子数多少表示。 、
、 的“有效氢”之比为
的“有效氢”之比为
您最近一年使用:0次
名校
解题方法
8 . 乙醇是燃料,也是重要的有机化工原料,二氧化碳加氢还原制乙醇已成为研究热点,相关的反应如下:
反应i: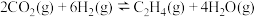
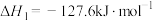
反应ii: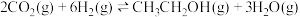
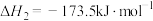
反应iii: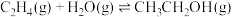
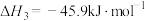
请回答下列问题:
(1)已知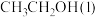 的燃烧热(
的燃烧热( )为
)为 ,表示
,表示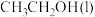 燃烧热的热化学方程式为
燃烧热的热化学方程式为________ 。
(2)在一定温度下,向2L恒容密闭容器中充入 和
和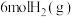 ,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如
,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如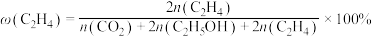 ]与时间的关系如图所示。
]与时间的关系如图所示。
①表示乙烯占比的曲线是________ (填“a”“b”或“c”)。
②若选择对反应i催化效果更好的催化剂,则A点可能移向________ (填“E”“E点上方”或“E点下方”)。
③已知C点、D点均为平衡点,则反应iii的平衡常数K=________ (保留小数点后一位)。
④设反应i和反应ii的化学平衡常数分别为 、
、 ,适当升温后,
,适当升温后,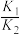
________ (填“增大”“减小”或“无法判断”),理由是________ 。
(3)近日,中国科学技术大学某课题组以Pd掺杂的 原子层为原型,在温和条件下,通过
原子层为原型,在温和条件下,通过 光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴(
光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴( )(
)(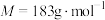 )在空气中受热时固体质量随温度变化的曲线如图所示。
)在空气中受热时固体质量随温度变化的曲线如图所示。________ ,CD段发生反应的化学方程式为________ 。
反应i:
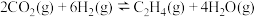
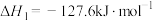
反应ii:
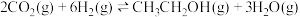
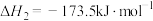
反应iii:
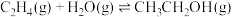
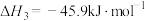
请回答下列问题:
(1)已知
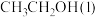 的燃烧热(
的燃烧热( )为
)为 ,表示
,表示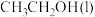 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)在一定温度下,向2L恒容密闭容器中充入
 和
和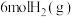 ,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如
,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如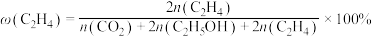 ]与时间的关系如图所示。
]与时间的关系如图所示。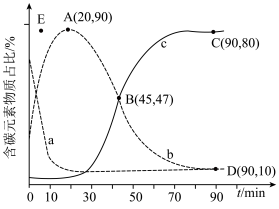
①表示乙烯占比的曲线是
②若选择对反应i催化效果更好的催化剂,则A点可能移向
③已知C点、D点均为平衡点,则反应iii的平衡常数K=
④设反应i和反应ii的化学平衡常数分别为
 、
、 ,适当升温后,
,适当升温后,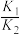
(3)近日,中国科学技术大学某课题组以Pd掺杂的
 原子层为原型,在温和条件下,通过
原子层为原型,在温和条件下,通过 光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴(
光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴( )(
)( )在空气中受热时固体质量随温度变化的曲线如图所示。
)在空气中受热时固体质量随温度变化的曲线如图所示。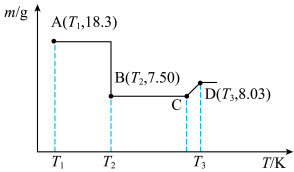
您最近一年使用:0次
解题方法
9 . 四氢铝钠( )是强还原剂和供氢剂,高铁酸钠(
)是强还原剂和供氢剂,高铁酸钠( )是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为
)是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为 、
、 和
和 含少量
含少量 )为原料制备四氢铝钠和高铁酸钠的流程如下(已知
)为原料制备四氢铝钠和高铁酸钠的流程如下(已知 是难溶于水的酸性氧化物):
是难溶于水的酸性氧化物):

回答下列问题:
(1) 中氢的化合价为
中氢的化合价为_______ 。
(2)浸渣的主要成分是_______ (填化学式);“转化”中 的具体作用是
的具体作用是_______ 。
(3)由 制备
制备 的离子方程式为
的离子方程式为_______ ;“分离”中铝元素转化成_______ (填离子符号)。
(4)“沉铝”后所得滤液经蒸干、灼烧得到固体是_______ 。
(5)“合成”中乙醚作溶剂,发生反应的化学方程式为_______ 。
(6)“有效氢”指单位质量(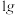 )含氢还原剂的还原能力相当于多少克氢气的还原能力。
)含氢还原剂的还原能力相当于多少克氢气的还原能力。 、
、 的“有效氢”如图所示,则乙代表
的“有效氢”如图所示,则乙代表_______ (填化学式)。

 )是强还原剂和供氢剂,高铁酸钠(
)是强还原剂和供氢剂,高铁酸钠( )是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为
)是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为 、
、 和
和 含少量
含少量 )为原料制备四氢铝钠和高铁酸钠的流程如下(已知
)为原料制备四氢铝钠和高铁酸钠的流程如下(已知 是难溶于水的酸性氧化物):
是难溶于水的酸性氧化物):
回答下列问题:
(1)
 中氢的化合价为
中氢的化合价为(2)浸渣的主要成分是
 的具体作用是
的具体作用是(3)由
 制备
制备 的离子方程式为
的离子方程式为(4)“沉铝”后所得滤液经蒸干、灼烧得到固体是
(5)“合成”中乙醚作溶剂,发生反应的化学方程式为
(6)“有效氢”指单位质量(
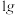 )含氢还原剂的还原能力相当于多少克氢气的还原能力。
)含氢还原剂的还原能力相当于多少克氢气的还原能力。 、
、 的“有效氢”如图所示,则乙代表
的“有效氢”如图所示,则乙代表
您最近一年使用:0次
10 . 叠氮化钠( )常用于汽车安全气囊的气源,工业上以
)常用于汽车安全气囊的气源,工业上以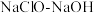 混合液和尿素
混合液和尿素 为原料,先制备水合肼(
为原料,先制备水合肼( ,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(
,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(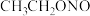 ,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
 )常用于汽车安全气囊的气源,工业上以
)常用于汽车安全气囊的气源,工业上以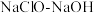 混合液和尿素
混合液和尿素 为原料,先制备水合肼(
为原料,先制备水合肼( ,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(
,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(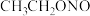 ,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
A.“反应器1”是将尿素溶液加入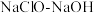 混合液中充分反应 混合液中充分反应 |
B.“余液”的主要成分可能是 、NaCl 、NaCl |
C.若“反应器2”中生成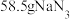 ,则转移电子的物质的量为3mol ,则转移电子的物质的量为3mol |
| D.实际工业生产中,“反应器2”应做冷却处理 |
您最近一年使用:0次



