名校
解题方法
1 .  是一种重要的化工产品。以菱锰矿(主要成分为
是一种重要的化工产品。以菱锰矿(主要成分为 ,还含有
,还含有 、FeO、CoO等)为原料制备
、FeO、CoO等)为原料制备 的工艺流程如下图。
的工艺流程如下图。
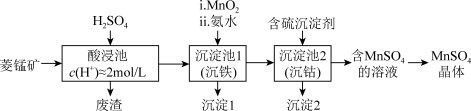
资料:金属离子沉淀的pH
(1)酸浸后所得溶液的金属阳离子包括 、
、 、
、_______ 。
(2)沉淀池1中,先加 充分反应后再加氨水,写出加
充分反应后再加氨水,写出加 时发生反应的离子方程式:
时发生反应的离子方程式:_______ 。
(3)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是_______ 。
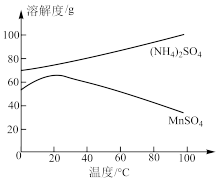
(4)图为 和
和 的溶解度曲线。从“含
的溶解度曲线。从“含 的溶液”中提取“
的溶液”中提取“ 晶体”的操作为
晶体”的操作为_______ 、洗涤、干燥。
(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下。
i.称取a g废渣,加酸将锰元素全部溶出成 ,过滤,将滤液定容于100mL容量瓶中;
,过滤,将滤液定容于100mL容量瓶中;
ii.取25.00 mL溶液于锥形瓶中,加入少量催化剂和过量 溶液,加热、充分反应后,煮沸溶液使过量的
溶液,加热、充分反应后,煮沸溶液使过量的 分解。
分解。
iii.加入指示剂,用b mol/L 溶液滴定,滴定至终点时消耗
溶液滴定,滴定至终点时消耗 溶液的体积为c mL ,
溶液的体积为c mL , 重新变成
重新变成 。
。
①补全步骤ⅱ中反应的离子方程式:_______ 。
 +
+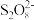 +_______
+_______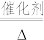
 +_______+_______
+_______+_______
②废渣中锰元素的质量分数为_______ 。
 是一种重要的化工产品。以菱锰矿(主要成分为
是一种重要的化工产品。以菱锰矿(主要成分为 ,还含有
,还含有 、FeO、CoO等)为原料制备
、FeO、CoO等)为原料制备 的工艺流程如下图。
的工艺流程如下图。
资料:金属离子沉淀的pH
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Mn2+ |
| 开始沉淀 | 1.5 | 6.3 | 7.4 | 7.6 |
| 完全沉淀 | 2.8 | 8.3 | 9.4 | 10.2 |
 、
、 、
、(2)沉淀池1中,先加
 充分反应后再加氨水,写出加
充分反应后再加氨水,写出加 时发生反应的离子方程式:
时发生反应的离子方程式:(3)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是
(4)图为
 和
和 的溶解度曲线。从“含
的溶解度曲线。从“含 的溶液”中提取“
的溶液”中提取“ 晶体”的操作为
晶体”的操作为
(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下。
i.称取a g废渣,加酸将锰元素全部溶出成
 ,过滤,将滤液定容于100mL容量瓶中;
,过滤,将滤液定容于100mL容量瓶中;ii.取25.00 mL溶液于锥形瓶中,加入少量催化剂和过量
 溶液,加热、充分反应后,煮沸溶液使过量的
溶液,加热、充分反应后,煮沸溶液使过量的 分解。
分解。iii.加入指示剂,用b mol/L
 溶液滴定,滴定至终点时消耗
溶液滴定,滴定至终点时消耗 溶液的体积为c mL ,
溶液的体积为c mL , 重新变成
重新变成 。
。①补全步骤ⅱ中反应的离子方程式:
 +
+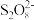 +_______
+_______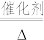
 +_______+_______
+_______+_______②废渣中锰元素的质量分数为
您最近一年使用:0次
2023-04-15更新
|
268次组卷
|
3卷引用: 山东省青岛第十七中学2020-2021学年高三下学期期中考试化学试题
名校
解题方法
2 . 大力发展新能源汽车产业是我国兑现碳中和承诺的重要战略之一。随着这一产业的发展,如何处理废旧锂电池成为一个亟需解决的问题。某废弃的钴酸锂( )电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:
)电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:

已知: 与草酸根离子(
与草酸根离子( )结合生成较稳定的
)结合生成较稳定的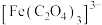 ,
,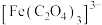 在强酸性条件下分解重新生成
在强酸性条件下分解重新生成 。
。
(1)操作①的名称为______ ;由此可推测,氧化铝______ (填“能”或“不能”)溶于氢氧化钠溶液。
(2)溶液②中所含主要溶质为LiCl、 ,请写出
,请写出 和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)
和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)______ 。
(3)将溶液中的 转化为
转化为 沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是
沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是__________________ 。
(4)为证明操作④获得的 沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入
沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入______ ,若无白色沉淀生成,则证明沉淀洗涤干净。
(5)取3.66 g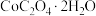 (相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为
(相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为______ (填化学式);在956℃条件下反应完全后,剩余固体相对最开始反应前失重59%,此时固体成分的化学式为 ,
,
______ 。
(6)某同学设计如图装置测定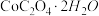 晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是
晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是______ (填选项)。

A. B中应装入浓硫酸,目的是除去水蒸气
B. 利用干燥管前后质量差可计算出结晶水的含量
C. 图中半透膜可让气体通过又可防止固体粉末进入导管
D. 反应结束后,应先停止加热,一段时间后再停止通空气
(7)溶液④中,铁元素主要以______ 离子形态存在,应加入______ 后再进行后续操作。
(8) 溶液在工业上常用于电路板的蚀刻,发生的反应为
溶液在工业上常用于电路板的蚀刻,发生的反应为 。某同学向含有
。某同学向含有 、
、 和
和 三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为
三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为______ (填选项)。
A. Fe B. Fe和Zn C. Fe和Cu D. Cu和Zn
(9)某a g混合粉末中含有铁、石墨、硫和碳酸氢铵,在空气中充分加热至完全反应后,重新称量剩余固体质量,仍为a g,则混合物中铁的质量分数为______ 。
 )电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:
)电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:
已知:
 与草酸根离子(
与草酸根离子( )结合生成较稳定的
)结合生成较稳定的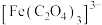 ,
,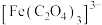 在强酸性条件下分解重新生成
在强酸性条件下分解重新生成 。
。(1)操作①的名称为
(2)溶液②中所含主要溶质为LiCl、
 ,请写出
,请写出 和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)
和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)(3)将溶液中的
 转化为
转化为 沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是
沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是(4)为证明操作④获得的
 沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入
沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入(5)取3.66 g
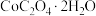 (相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为
(相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为 ,
,
(6)某同学设计如图装置测定
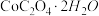 晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是
晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是
A. B中应装入浓硫酸,目的是除去水蒸气
B. 利用干燥管前后质量差可计算出结晶水的含量
C. 图中半透膜可让气体通过又可防止固体粉末进入导管
D. 反应结束后,应先停止加热,一段时间后再停止通空气
(7)溶液④中,铁元素主要以
(8)
 溶液在工业上常用于电路板的蚀刻,发生的反应为
溶液在工业上常用于电路板的蚀刻,发生的反应为 。某同学向含有
。某同学向含有 、
、 和
和 三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为
三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为A. Fe B. Fe和Zn C. Fe和Cu D. Cu和Zn
(9)某a g混合粉末中含有铁、石墨、硫和碳酸氢铵,在空气中充分加热至完全反应后,重新称量剩余固体质量,仍为a g,则混合物中铁的质量分数为
您最近一年使用:0次
3 . 氧钒碱式碳酸铵晶体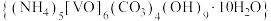 ,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知
,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知 易被
易被 氧化)。回答下列问题。
氧化)。回答下列问题。
Ⅰ.制备
步骤1:向 中加入足量盐酸酸化的
中加入足量盐酸酸化的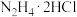 溶液,微沸数分钟。
溶液,微沸数分钟。
步骤2:向足量 溶液中缓慢加入制得的
溶液中缓慢加入制得的 溶液,有气泡产生并析出紫红色晶体。
溶液,有气泡产生并析出紫红色晶体。
步骤3:反应结束后抽滤,先后用饱和 溶液、无水乙醇洗涤,静置得产品。
溶液、无水乙醇洗涤,静置得产品。
(1)“步骤1”产生无色无污染的气体,该反应的化学方程式为______ 。
(2)用无水乙醇洗涤的目的是______ 。
(3)“步骤2”可在如图装置中进行。______ 。(按气流方向,用字母标号表示)。
②检查装置气密性,加入试剂。先打开 ,通入一段时间气体目的是
,通入一段时间气体目的是______ ,当观察到______ (填实验现象)时,再关闭 ,打开
,打开 ,进行实验。
,进行实验。
③生成氧钒碱式碳酸铵晶体的化学方程式为______ 。
Ⅱ.产品中氮元素含量的测定
精确称取wg晶体加入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液充分反应,通入水蒸气,将氨全部蒸出,并用蒸馏水冲洗导管内壁,用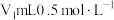 的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5
的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5 盐酸标准溶液滴定,到终点时消耗
盐酸标准溶液滴定,到终点时消耗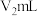 盐酸。
盐酸。
已知: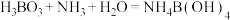 ,
, 。
。
(4)“冰盐水”的作用是______ 。
(5)样品中氮元素质量分数的表达式为______ 。
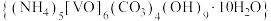 ,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知
,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知 易被
易被 氧化)。回答下列问题。
氧化)。回答下列问题。Ⅰ.制备
步骤1:向
 中加入足量盐酸酸化的
中加入足量盐酸酸化的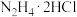 溶液,微沸数分钟。
溶液,微沸数分钟。步骤2:向足量
 溶液中缓慢加入制得的
溶液中缓慢加入制得的 溶液,有气泡产生并析出紫红色晶体。
溶液,有气泡产生并析出紫红色晶体。步骤3:反应结束后抽滤,先后用饱和
 溶液、无水乙醇洗涤,静置得产品。
溶液、无水乙醇洗涤,静置得产品。(1)“步骤1”产生无色无污染的气体,该反应的化学方程式为
(2)用无水乙醇洗涤的目的是
(3)“步骤2”可在如图装置中进行。
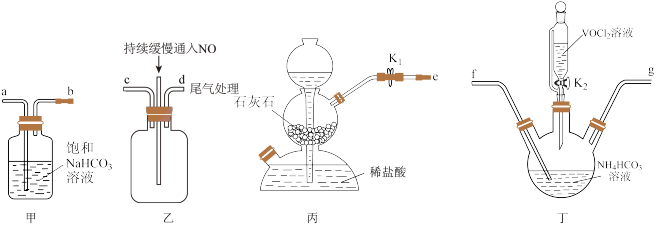
②检查装置气密性,加入试剂。先打开
 ,通入一段时间气体目的是
,通入一段时间气体目的是 ,打开
,打开 ,进行实验。
,进行实验。③生成氧钒碱式碳酸铵晶体的化学方程式为
Ⅱ.产品中氮元素含量的测定
精确称取wg晶体加入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液充分反应,通入水蒸气,将氨全部蒸出,并用蒸馏水冲洗导管内壁,用
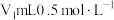 的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5
的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5 盐酸标准溶液滴定,到终点时消耗
盐酸标准溶液滴定,到终点时消耗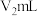 盐酸。
盐酸。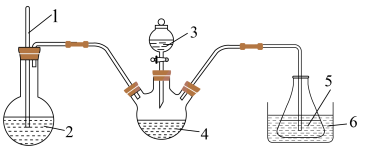
已知:
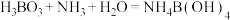 ,
, 。
。(4)“冰盐水”的作用是
(5)样品中氮元素质量分数的表达式为
您最近一年使用:0次
2024·福建·模拟预测
解题方法
4 . 双氰胺( )为白色晶体,在冷水中溶解度较小,溶于热水、乙醇,其水溶液在80℃以上会发生分解等副反应,主要用于生产树脂、涂料、含氮复合肥等。实验室以石灰氮
)为白色晶体,在冷水中溶解度较小,溶于热水、乙醇,其水溶液在80℃以上会发生分解等副反应,主要用于生产树脂、涂料、含氮复合肥等。实验室以石灰氮 为原料制备双氰胺的流程如下:
为原料制备双氰胺的流程如下:


(1)已知:氰基是吸电子基团。氰氨
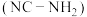 的碱性
的碱性(2)写出步骤Ⅰ的化学反应方程式:
(3)步骤Ⅱ中调节溶液pH为9.1,pH不能过低的原因:
(4)步骤Ⅲ中蒸发浓缩时,常采用真空蒸发浓缩,目的是
(5)凯氏定氮法是测定有机物中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐。
已知:
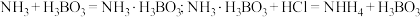

②仪器清洗后,g中加入硼酸
 和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭
和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭 ,d中保留少量水。打开
,d中保留少量水。打开 ,加热b,使水蒸气进入e。d中保留少量水的目的是
,加热b,使水蒸气进入e。d中保留少量水的目的是③取双氰胺样品m克进行测定,滴定g中吸收液时消耗浓度为
 的盐酸VmL,则样品中氮的质量分数为
的盐酸VmL,则样品中氮的质量分数为
您最近一年使用:0次
23-24高三上·河南南阳·阶段练习
5 . 镍酸锂( )被认为是一种具有较好发展前景的锂离子电池材料。一种以铁镍铜合金废料为原料生产
)被认为是一种具有较好发展前景的锂离子电池材料。一种以铁镍铜合金废料为原料生产 的工艺流程如图。
的工艺流程如图。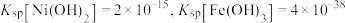 ,
,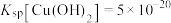 ,
, ,
,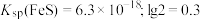 。
。
②常温下,有关金属阳离子开始沉淀和沉淀完全的pH如表。
回答下列问题:
(1)“酸溶”后,废料中的铁、镍和铜完全溶于混酸中,所得溶液中的溶质为 及过量的
及过量的 ,则尾气的主要成分为
,则尾气的主要成分为_____ 。
(2)“氧化”是将“酸溶”后溶液中的少量 氧化,适当升高温度会加快“氧化”速率,但温度高于60℃时,“氧化”速率会降低,其原因为
氧化,适当升高温度会加快“氧化”速率,但温度高于60℃时,“氧化”速率会降低,其原因为_____ 。
(3)“除铁”后滤渣的主要成分为_____ (写化学式),表格中的
_____ 。
(4)“沉铜”时,加入的试剂X可能为_____ (填字母)。
a.NaOH溶液 b. 气体 c.
气体 c. 溶液 d.FeS
溶液 d.FeS
(5)“沉镍”析出 沉淀,则滤液中的溶质主要为
沉淀,则滤液中的溶质主要为_____ (填化学式);在空气中“煅烧”的化学方程式为_____ 。
(6)若1.0t铁镍铜合金废料(含镍质量分数为59.0%)经过上述流程制得 ,则
,则 的产率为
的产率为_____ %(结果保留3位有效数字)。
 )被认为是一种具有较好发展前景的锂离子电池材料。一种以铁镍铜合金废料为原料生产
)被认为是一种具有较好发展前景的锂离子电池材料。一种以铁镍铜合金废料为原料生产 的工艺流程如图。
的工艺流程如图。
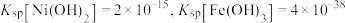 ,
,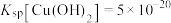 ,
, ,
,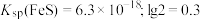 。
。②常温下,有关金属阳离子开始沉淀和沉淀完全的pH如表。
| 金属阳离子 |  |  |  |  |
| 开始沉淀的pH | 2.2 | 5.8 | 4.2 | 6.7 |
沉淀完全( )的pH )的pH | x | 8.8 | 7.7 | 9.3 |
(1)“酸溶”后,废料中的铁、镍和铜完全溶于混酸中,所得溶液中的溶质为
 及过量的
及过量的 ,则尾气的主要成分为
,则尾气的主要成分为(2)“氧化”是将“酸溶”后溶液中的少量
 氧化,适当升高温度会加快“氧化”速率,但温度高于60℃时,“氧化”速率会降低,其原因为
氧化,适当升高温度会加快“氧化”速率,但温度高于60℃时,“氧化”速率会降低,其原因为(3)“除铁”后滤渣的主要成分为

(4)“沉铜”时,加入的试剂X可能为
a.NaOH溶液 b.
 气体 c.
气体 c. 溶液 d.FeS
溶液 d.FeS(5)“沉镍”析出
 沉淀,则滤液中的溶质主要为
沉淀,则滤液中的溶质主要为(6)若1.0t铁镍铜合金废料(含镍质量分数为59.0%)经过上述流程制得
 ,则
,则 的产率为
的产率为
您最近一年使用:0次
名校
6 . 大连理工大学课题组通过CuO/ 催化,使NO-CO-
催化,使NO-CO- 反应体系在温和条件下产生
反应体系在温和条件下产生 ,为NO和CO的烟气处理提供了新的途径,其相关的反应为:
,为NO和CO的烟气处理提供了新的途径,其相关的反应为: (未配平),
(未配平), 是阿伏加德罗常数的值,下列有关说法正确的是
是阿伏加德罗常数的值,下列有关说法正确的是
 催化,使NO-CO-
催化,使NO-CO- 反应体系在温和条件下产生
反应体系在温和条件下产生 ,为NO和CO的烟气处理提供了新的途径,其相关的反应为:
,为NO和CO的烟气处理提供了新的途径,其相关的反应为: (未配平),
(未配平), 是阿伏加德罗常数的值,下列有关说法正确的是
是阿伏加德罗常数的值,下列有关说法正确的是A.标准状况下,1.12L NO中含有电子数为1.5 |
B.将 个 个 溶于100mL水中,所得溶液的质量分数约为29.9% 溶于100mL水中,所得溶液的质量分数约为29.9% |
C.生成22g  能消除NO的数目为0.2 能消除NO的数目为0.2 |
D.若NO和CO混合气体的平均相对分子质量为29,则含有CO的数目为0.5 |
您最近一年使用:0次
2024-03-13更新
|
280次组卷
|
3卷引用:山东省青岛第二中学2023-2024学年高一上学期第二次月考化学试卷
7 . 氧钒碱式碳酸铵晶体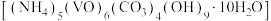 可用于制备热敏材料。以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机物等)来制备氧钒碱式碳酸铵晶体的一种工艺流程如下:
可用于制备热敏材料。以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机物等)来制备氧钒碱式碳酸铵晶体的一种工艺流程如下:

已知:含钒离子在溶液中的主要存在形式与溶液pH的关系:
(1)“焙烧”过程中除了 、
、 、
、 、
、 中的某些物质参加反应外,“焙烧”的另一个作用是
中的某些物质参加反应外,“焙烧”的另一个作用是_______ 。
(2)写出“焙烧”过程中生成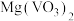 的化学方程式:
的化学方程式:_______ 。
(3)“调 ”的作用除了沉淀某些金属阳离子外,还有的作用是
”的作用除了沉淀某些金属阳离子外,还有的作用是_______ 。
(4)若“净化Ⅱ”加入过量的 ,可能导致的后果为
,可能导致的后果为_______ 。
(5)称量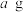 产品于锥形瓶中,先用
产品于锥形瓶中,先用 蒸馏水与
蒸馏水与 稀硫酸溶解后,再加入
稀硫酸溶解后,再加入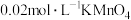 溶液至稍过量,充分反应后继续滴加1%的
溶液至稍过量,充分反应后继续滴加1%的 溶液至稍过量,再用尿素除去过量
溶液至稍过量,再用尿素除去过量 ,最后用
,最后用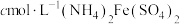 标准溶液滴定至终点,消耗标准溶液的体积为
标准溶液滴定至终点,消耗标准溶液的体积为 。(已知滴定反应为
。(已知滴定反应为 )
)
① 溶液的作用是
溶液的作用是_______ 。
②粗产品中钒的质量分数表达式为_______ (以 计)。
计)。
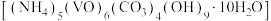 可用于制备热敏材料。以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机物等)来制备氧钒碱式碳酸铵晶体的一种工艺流程如下:
可用于制备热敏材料。以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机物等)来制备氧钒碱式碳酸铵晶体的一种工艺流程如下:
已知:含钒离子在溶液中的主要存在形式与溶液pH的关系:
| pH | 4~6 | 6~8 | 8~10 |
| 主要离子 |  |  | 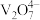 |
 、
、 、
、 、
、 中的某些物质参加反应外,“焙烧”的另一个作用是
中的某些物质参加反应外,“焙烧”的另一个作用是(2)写出“焙烧”过程中生成
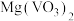 的化学方程式:
的化学方程式:(3)“调
 ”的作用除了沉淀某些金属阳离子外,还有的作用是
”的作用除了沉淀某些金属阳离子外,还有的作用是(4)若“净化Ⅱ”加入过量的
 ,可能导致的后果为
,可能导致的后果为(5)称量
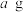 产品于锥形瓶中,先用
产品于锥形瓶中,先用 蒸馏水与
蒸馏水与 稀硫酸溶解后,再加入
稀硫酸溶解后,再加入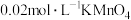 溶液至稍过量,充分反应后继续滴加1%的
溶液至稍过量,充分反应后继续滴加1%的 溶液至稍过量,再用尿素除去过量
溶液至稍过量,再用尿素除去过量 ,最后用
,最后用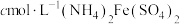 标准溶液滴定至终点,消耗标准溶液的体积为
标准溶液滴定至终点,消耗标准溶液的体积为 。(已知滴定反应为
。(已知滴定反应为 )
)①
 溶液的作用是
溶液的作用是②粗产品中钒的质量分数表达式为
 计)。
计)。
您最近一年使用:0次
2023-03-16更新
|
283次组卷
|
2卷引用:山东省青岛第二中学2022-2023学年高三上学期期中考试化学试题
名校
8 . 碘元素是人体必需的微量元素之一。某小组设计以下实验从海带中提取碘并测定食盐中碘元素的含量。
Ⅰ.海带提碘
(1)同学们称取一定量干海带,将海带先剪碎,然后用水浸泡、洗净、晾干,放入__________ (填仪器名称)中灼烧至海带完全成灰烬,然后继续进行下列流程。 溶液,然后再加入0.5mL
溶液,然后再加入0.5mL ,振荡后静置,若观察到
,振荡后静置,若观察到_________ (填实验现象),则证明海带中含有碘元素,上述过程中涉及的离子反应方程式为______________ 。
(3)萃取实验中,若要使碘尽可能地完全转移到 中,可采取的操作是
中,可采取的操作是______________ 。
Ⅱ.人体碘的重要来源之一是食用加碘食盐(含 )。为测定加碘食盐中的碘含量,学习小组设计如下实验:
)。为测定加碘食盐中的碘含量,学习小组设计如下实验:
①配制1L 硫代硫酸钠(
硫代硫酸钠( )标准溶液;
)标准溶液;
②用天平准确称取wg食盐样品,加适量蒸馏水使其完全溶解;
③用稀硫酸酸化所得溶液,加入足量KI溶液,使 与KI反应完全生成
与KI反应完全生成 ;
;
④向③中混合液逐滴加入浓度为 的
的 溶液,恰好反应完全时,消耗
溶液,恰好反应完全时,消耗 溶液6.00mL。(已知:
溶液6.00mL。(已知: )
)
已知: 易溶于水,具有强还原性。
易溶于水,具有强还原性。
(4)配制硫代硫酸钠溶液时用分析天平准确称量 固体的质量为
固体的质量为______ g。(保留小数点后2位)
(5)配制前蒸馏水需先煮沸再冷却,其目的是__________ 。
(6)下列情况中,导致所配溶液的物质的量浓度偏低的是________.(填标号)。
(7)上述食盐样品中碘元素的含量为__________ mg/kg(用含w的代数式表示)。
Ⅰ.海带提碘
(1)同学们称取一定量干海带,将海带先剪碎,然后用水浸泡、洗净、晾干,放入

 溶液,然后再加入0.5mL
溶液,然后再加入0.5mL ,振荡后静置,若观察到
,振荡后静置,若观察到(3)萃取实验中,若要使碘尽可能地完全转移到
 中,可采取的操作是
中,可采取的操作是Ⅱ.人体碘的重要来源之一是食用加碘食盐(含
 )。为测定加碘食盐中的碘含量,学习小组设计如下实验:
)。为测定加碘食盐中的碘含量,学习小组设计如下实验:①配制1L
 硫代硫酸钠(
硫代硫酸钠( )标准溶液;
)标准溶液;②用天平准确称取wg食盐样品,加适量蒸馏水使其完全溶解;
③用稀硫酸酸化所得溶液,加入足量KI溶液,使
 与KI反应完全生成
与KI反应完全生成 ;
;④向③中混合液逐滴加入浓度为
 的
的 溶液,恰好反应完全时,消耗
溶液,恰好反应完全时,消耗 溶液6.00mL。(已知:
溶液6.00mL。(已知: )
)已知:
 易溶于水,具有强还原性。
易溶于水,具有强还原性。(4)配制硫代硫酸钠溶液时用分析天平准确称量
 固体的质量为
固体的质量为(5)配制前蒸馏水需先煮沸再冷却,其目的是
(6)下列情况中,导致所配溶液的物质的量浓度偏低的是________.(填标号)。
| A.容量瓶在使用前未干燥,里面有少量蒸馏水 |
| B.转移溶液至容量瓶过程中,有少量溶液溅出 |
| C.定容时俯视刻度线读数 |
| D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线 |
(7)上述食盐样品中碘元素的含量为
您最近一年使用:0次
名校
9 . 白硼钙石的主要成分是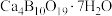 (含有少量
(含有少量 、FeO、
、FeO、 和
和 等杂质),利用白硼钙石制取强还原剂
等杂质),利用白硼钙石制取强还原剂 的工艺流程如下:
的工艺流程如下: 微溶于水,易溶于乙醇;偏硼酸钠(
微溶于水,易溶于乙醇;偏硼酸钠( )易溶于水,溶解度随温度升高而增大,难溶于乙醇,碱性条件下稳定。
)易溶于水,溶解度随温度升高而增大,难溶于乙醇,碱性条件下稳定。
(1) 中H的化合价为
中H的化合价为_________ ,该物质所含的化学键类型有_________________ 。
(2)写出“酸浸过滤”中发生的主要化学反应方程式______________________________ 。
(3)“气体”的主要成分为________________ 。“滤渣1”的主要成分是___________________ 。
(4)“操作X”为____________________________ 。
(5)写出“反应Y”的化学方程式________________________________________ 。
(6)“有效氢含量”(即:每克含氢还原剂的还原能力相当于多少克 的还原能力)可用衡量含氢还原剂的还原能力,则
的还原能力)可用衡量含氢还原剂的还原能力,则 的有效氢含量为
的有效氢含量为__________ (保留2位有效数字)。
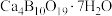 (含有少量
(含有少量 、FeO、
、FeO、 和
和 等杂质),利用白硼钙石制取强还原剂
等杂质),利用白硼钙石制取强还原剂 的工艺流程如下:
的工艺流程如下:
 微溶于水,易溶于乙醇;偏硼酸钠(
微溶于水,易溶于乙醇;偏硼酸钠( )易溶于水,溶解度随温度升高而增大,难溶于乙醇,碱性条件下稳定。
)易溶于水,溶解度随温度升高而增大,难溶于乙醇,碱性条件下稳定。(1)
 中H的化合价为
中H的化合价为(2)写出“酸浸过滤”中发生的主要化学反应方程式
(3)“气体”的主要成分为
(4)“操作X”为
(5)写出“反应Y”的化学方程式
(6)“有效氢含量”(即:每克含氢还原剂的还原能力相当于多少克
 的还原能力)可用衡量含氢还原剂的还原能力,则
的还原能力)可用衡量含氢还原剂的还原能力,则 的有效氢含量为
的有效氢含量为
您最近一年使用:0次
名校
解题方法
10 . 填空。
(1)有下列四个反应:
①SO3+H2O=H2SO4
②Cl2+H2O=HCl+HClO
③2F2+2H2O=4HF+O2
④SO2+2NaOH=Na2SO3+H2O
上述反应中不属于氧化还原反应的是___________ (填序号,下同);H2O只作还原剂的是___________ ;属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是___________ 。
(2)工业盐的主要成分是NaNO2,以前有许多起因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有___________ 性。下列不能实现这种转化的物质是___________ (填字母)。
a.酸性KMnO4溶液 b.FeCl3 c.O2 d.浓硫酸
(3)已知氧化性Fe3+>Cu2+>Fe2+,在溶有Fe2(SO4)3和CuSO4的溶液中加入一定量的铁粉,下列说法正确的是___________。(填字母)
(4)我国古代炼丹术中用的铅丹与硝酸反应方程式是:X(铅丹)+4HNO3=PbO2+2Pb(NO3)2+2H2O,则铅丹的化学式为___________ ,其中+2价的Pb和+4价的Pb含量之比为:___________ 。
(5)治理汽车尾气方法之一是在汽车的排气管上安装“催化转化器”,CO和NO可以转化为两种无毒的气体,写出化学方程式,用单线桥标出电子转移的方向和数目:___________ 。
(1)有下列四个反应:
①SO3+H2O=H2SO4
②Cl2+H2O=HCl+HClO
③2F2+2H2O=4HF+O2
④SO2+2NaOH=Na2SO3+H2O
上述反应中不属于氧化还原反应的是
(2)工业盐的主要成分是NaNO2,以前有许多起因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有
a.酸性KMnO4溶液 b.FeCl3 c.O2 d.浓硫酸
(3)已知氧化性Fe3+>Cu2+>Fe2+,在溶有Fe2(SO4)3和CuSO4的溶液中加入一定量的铁粉,下列说法正确的是___________。(填字母)
| A.若铁粉无剩余,且溶液中有Cu2+,则溶液中可能有Fe3+ |
| B.若铁粉无剩余,溶液中一定有Fe2+,一定无Cu2+ |
| C.若铁粉有剩余,则不溶物一定有铜 |
| D.若铁粉有剩余,则溶液中一定有Fe2+和Cu2+ |
(5)治理汽车尾气方法之一是在汽车的排气管上安装“催化转化器”,CO和NO可以转化为两种无毒的气体,写出化学方程式,用单线桥标出电子转移的方向和数目:
您最近一年使用:0次



