1 . 氧钒碱式碳酸铵晶体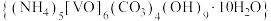 ,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知
,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知 易被
易被 氧化)。回答下列问题。
氧化)。回答下列问题。
Ⅰ.制备
步骤1:向 中加入足量盐酸酸化的
中加入足量盐酸酸化的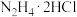 溶液,微沸数分钟。
溶液,微沸数分钟。
步骤2:向足量 溶液中缓慢加入制得的
溶液中缓慢加入制得的 溶液,有气泡产生并析出紫红色晶体。
溶液,有气泡产生并析出紫红色晶体。
步骤3:反应结束后抽滤,先后用饱和 溶液、无水乙醇洗涤,静置得产品。
溶液、无水乙醇洗涤,静置得产品。
(1)“步骤1”产生无色无污染的气体,该反应的化学方程式为______ 。
(2)用无水乙醇洗涤的目的是______ 。
(3)“步骤2”可在如图装置中进行。______ 。(按气流方向,用字母标号表示)。
②检查装置气密性,加入试剂。先打开 ,通入一段时间气体目的是
,通入一段时间气体目的是______ ,当观察到______ (填实验现象)时,再关闭 ,打开
,打开 ,进行实验。
,进行实验。
③生成氧钒碱式碳酸铵晶体的化学方程式为______ 。
Ⅱ.产品中氮元素含量的测定
精确称取wg晶体加入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液充分反应,通入水蒸气,将氨全部蒸出,并用蒸馏水冲洗导管内壁,用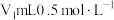 的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5
的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5 盐酸标准溶液滴定,到终点时消耗
盐酸标准溶液滴定,到终点时消耗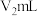 盐酸。
盐酸。
已知: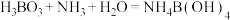 ,
, 。
。
(4)“冰盐水”的作用是______ 。
(5)样品中氮元素质量分数的表达式为______ 。
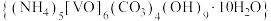 ,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知
,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知 易被
易被 氧化)。回答下列问题。
氧化)。回答下列问题。Ⅰ.制备
步骤1:向
 中加入足量盐酸酸化的
中加入足量盐酸酸化的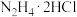 溶液,微沸数分钟。
溶液,微沸数分钟。步骤2:向足量
 溶液中缓慢加入制得的
溶液中缓慢加入制得的 溶液,有气泡产生并析出紫红色晶体。
溶液,有气泡产生并析出紫红色晶体。步骤3:反应结束后抽滤,先后用饱和
 溶液、无水乙醇洗涤,静置得产品。
溶液、无水乙醇洗涤,静置得产品。(1)“步骤1”产生无色无污染的气体,该反应的化学方程式为
(2)用无水乙醇洗涤的目的是
(3)“步骤2”可在如图装置中进行。
②检查装置气密性,加入试剂。先打开
 ,通入一段时间气体目的是
,通入一段时间气体目的是 ,打开
,打开 ,进行实验。
,进行实验。③生成氧钒碱式碳酸铵晶体的化学方程式为
Ⅱ.产品中氮元素含量的测定
精确称取wg晶体加入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液充分反应,通入水蒸气,将氨全部蒸出,并用蒸馏水冲洗导管内壁,用
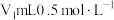 的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5
的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5 盐酸标准溶液滴定,到终点时消耗
盐酸标准溶液滴定,到终点时消耗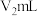 盐酸。
盐酸。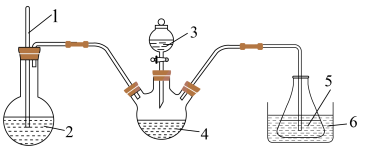
已知:
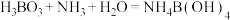 ,
, 。
。(4)“冰盐水”的作用是
(5)样品中氮元素质量分数的表达式为
您最近一年使用:0次
23-24高三上·山东德州·期末
解题方法
2 . Co、La元素及其化合物在工业及生活方面有重要应用。回答下列问题:
(1)基态Co的价电子排布图_______ ,核外电子的空间运动状态有_______ 种。
(2)一定条件下, 、
、 、
、 和
和 反应可制得
反应可制得 ,反应的方程式为
,反应的方程式为_______ , 的配位数为
的配位数为_______ 。区别 和
和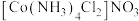 两种溶液的试剂是
两种溶液的试剂是_______ 。
(3) 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是_______ ,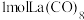 含
含_______  键。
键。 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
_______ 。晶体 的密度为
的密度为_______  。(写出计算式即可)
。(写出计算式即可)
(1)基态Co的价电子排布图
(2)一定条件下,
 、
、 、
、 和
和 反应可制得
反应可制得 ,反应的方程式为
,反应的方程式为 的配位数为
的配位数为 和
和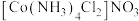 两种溶液的试剂是
两种溶液的试剂是(3)
 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是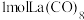 含
含 键。
键。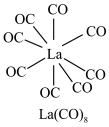
 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
 的密度为
的密度为 。(写出计算式即可)
。(写出计算式即可)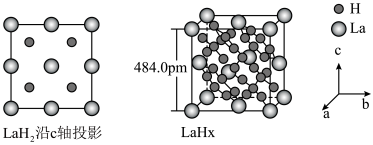
您最近一年使用:0次
名校
3 . 白硼钙石的主要成分是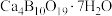 (含有少量
(含有少量 、FeO、
、FeO、 和
和 等杂质),利用白硼钙石制取强还原剂
等杂质),利用白硼钙石制取强还原剂 的工艺流程如下:
的工艺流程如下: 微溶于水,易溶于乙醇;偏硼酸钠(
微溶于水,易溶于乙醇;偏硼酸钠( )易溶于水,溶解度随温度升高而增大,难溶于乙醇,碱性条件下稳定。
)易溶于水,溶解度随温度升高而增大,难溶于乙醇,碱性条件下稳定。
(1) 中H的化合价为
中H的化合价为_________ ,该物质所含的化学键类型有_________________ 。
(2)写出“酸浸过滤”中发生的主要化学反应方程式______________________________ 。
(3)“气体”的主要成分为________________ 。“滤渣1”的主要成分是___________________ 。
(4)“操作X”为____________________________ 。
(5)写出“反应Y”的化学方程式________________________________________ 。
(6)“有效氢含量”(即:每克含氢还原剂的还原能力相当于多少克 的还原能力)可用衡量含氢还原剂的还原能力,则
的还原能力)可用衡量含氢还原剂的还原能力,则 的有效氢含量为
的有效氢含量为__________ (保留2位有效数字)。
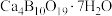 (含有少量
(含有少量 、FeO、
、FeO、 和
和 等杂质),利用白硼钙石制取强还原剂
等杂质),利用白硼钙石制取强还原剂 的工艺流程如下:
的工艺流程如下:
 微溶于水,易溶于乙醇;偏硼酸钠(
微溶于水,易溶于乙醇;偏硼酸钠( )易溶于水,溶解度随温度升高而增大,难溶于乙醇,碱性条件下稳定。
)易溶于水,溶解度随温度升高而增大,难溶于乙醇,碱性条件下稳定。(1)
 中H的化合价为
中H的化合价为(2)写出“酸浸过滤”中发生的主要化学反应方程式
(3)“气体”的主要成分为
(4)“操作X”为
(5)写出“反应Y”的化学方程式
(6)“有效氢含量”(即:每克含氢还原剂的还原能力相当于多少克
 的还原能力)可用衡量含氢还原剂的还原能力,则
的还原能力)可用衡量含氢还原剂的还原能力,则 的有效氢含量为
的有效氢含量为
您最近一年使用:0次
名校
4 . 二氧化氯( )是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于10%时,易发生爆炸,是一种无毒的绿色消毒剂。实验室可用下图所示装置(夹持仪器已省略)制备
)是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于10%时,易发生爆炸,是一种无毒的绿色消毒剂。实验室可用下图所示装置(夹持仪器已省略)制备 水溶液。下列说法错误的是
水溶液。下列说法错误的是
 )是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于10%时,易发生爆炸,是一种无毒的绿色消毒剂。实验室可用下图所示装置(夹持仪器已省略)制备
)是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于10%时,易发生爆炸,是一种无毒的绿色消毒剂。实验室可用下图所示装置(夹持仪器已省略)制备 水溶液。下列说法错误的是
水溶液。下列说法错误的是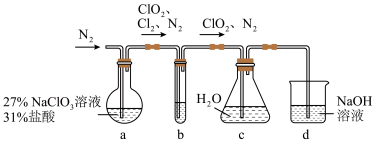
A.装置a的反应产物中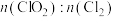 的比值一定为2:1 的比值一定为2:1 |
| B.装置b的主要作用是除去混合气体中的HCl |
C.通入氮气的目的为稀释装置a中产生的 并使其中产生的气体全部进入后续装置 并使其中产生的气体全部进入后续装置 |
D.装置d可除去多余的 |
您最近一年使用:0次
2024·甘肃平凉·模拟预测
5 . 环己酮是无色油状液体, 时在水中的溶解度为
时在水中的溶解度为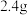 。实验室由环己醇制备环己酮。
。实验室由环己醇制备环己酮。
【实验原理】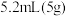 环已醇和
环已醇和 冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。
冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。
Ⅱ.在室温下继续搅拌 ,然后加入饱和亚硫酸氢钠溶液。
,然后加入饱和亚硫酸氢钠溶液。
Ⅲ.在反应混合物中加入 水、
水、 氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。
氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。
Ⅳ.在搅拌情况下向馏出液中加入无水碳酸钠至中性,然后再加入精制食盐使之饱和,将此液体倒入分液漏斗,分出有机层。
Ⅴ.向有机层中加入无水 ,静置,过滤,对滤液进行蒸馏,得到产品
,静置,过滤,对滤液进行蒸馏,得到产品 。
。
回答下列问题。
(1)仪器X的名称为_______ 。
(2)步骤Ⅰ中,加入冰醋酸除作为溶剂外,还有的作用是_______ 。用淀粉碘化钾试纸可检验反应后的液体,如果试纸变_______ 色,说明次氯酸钠过量。
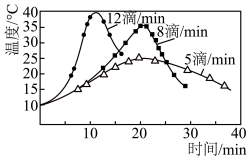
(3)步骤Ⅰ中,次氯酸钠溶液要在冰水浴冷却下逐滴加入,勿使氧化反应进行得过于猛烈而升温过高,否则产物环己酮将进一步被氧化而发生碳链断裂。在次氯酸钠的不同滴加速度下,在冰水浴存在的情况下,溶液温度随滴加时间变化曲线如图,为了控制好反应温度,应选择的滴速为_______ 滴/ 。
。_______ 。
(5)在步骤Ⅳ中,加入精制食盐的目的是_______ 。
(6)在步骤Ⅴ中,加入无水 的作用为
的作用为_______ 。
(7)产品的产率为_______ (精确至0.1%)。
 时在水中的溶解度为
时在水中的溶解度为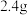 。实验室由环己醇制备环己酮。
。实验室由环己醇制备环己酮。【实验原理】
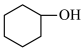 +NaClO
+NaClO
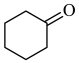 +NaCl+H2O
+NaCl+H2O 
【装置示意图】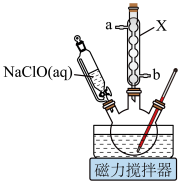
 环已醇和
环已醇和 冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。
冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。Ⅱ.在室温下继续搅拌
 ,然后加入饱和亚硫酸氢钠溶液。
,然后加入饱和亚硫酸氢钠溶液。Ⅲ.在反应混合物中加入
 水、
水、 氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。
氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。Ⅳ.在搅拌情况下向馏出液中加入无水碳酸钠至中性,然后再加入精制食盐使之饱和,将此液体倒入分液漏斗,分出有机层。
Ⅴ.向有机层中加入无水
 ,静置,过滤,对滤液进行蒸馏,得到产品
,静置,过滤,对滤液进行蒸馏,得到产品 。
。回答下列问题。
(1)仪器X的名称为
(2)步骤Ⅰ中,加入冰醋酸除作为溶剂外,还有的作用是
(3)步骤Ⅰ中,次氯酸钠溶液要在冰水浴冷却下逐滴加入,勿使氧化反应进行得过于猛烈而升温过高,否则产物环己酮将进一步被氧化而发生碳链断裂。在次氯酸钠的不同滴加速度下,在冰水浴存在的情况下,溶液温度随滴加时间变化曲线如图,为了控制好反应温度,应选择的滴速为
 。
。
(5)在步骤Ⅳ中,加入精制食盐的目的是
(6)在步骤Ⅴ中,加入无水
 的作用为
的作用为(7)产品的产率为
您最近一年使用:0次
2024·福建·模拟预测
解题方法
6 . 双氰胺( )为白色晶体,在冷水中溶解度较小,溶于热水、乙醇,其水溶液在80℃以上会发生分解等副反应,主要用于生产树脂、涂料、含氮复合肥等。实验室以石灰氮
)为白色晶体,在冷水中溶解度较小,溶于热水、乙醇,其水溶液在80℃以上会发生分解等副反应,主要用于生产树脂、涂料、含氮复合肥等。实验室以石灰氮 为原料制备双氰胺的流程如下:
为原料制备双氰胺的流程如下:


(1)已知:氰基是吸电子基团。氰氨
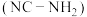 的碱性
的碱性(2)写出步骤Ⅰ的化学反应方程式:
(3)步骤Ⅱ中调节溶液pH为9.1,pH不能过低的原因:
(4)步骤Ⅲ中蒸发浓缩时,常采用真空蒸发浓缩,目的是
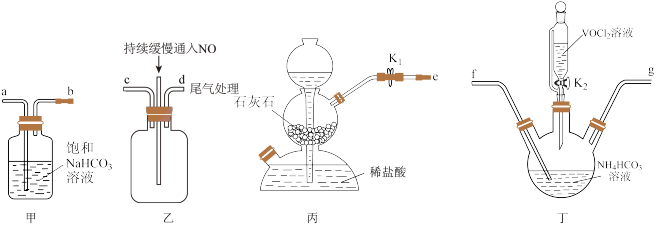
(5)凯氏定氮法是测定有机物中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐。
已知:
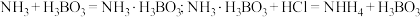

②仪器清洗后,g中加入硼酸
 和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭
和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭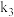 ,d中保留少量水。打开
,d中保留少量水。打开 ,加热b,使水蒸气进入e。d中保留少量水的目的是
,加热b,使水蒸气进入e。d中保留少量水的目的是③取双氰胺样品m克进行测定,滴定g中吸收液时消耗浓度为
 的盐酸VmL,则样品中氮的质量分数为
的盐酸VmL,则样品中氮的质量分数为
您最近一年使用:0次
23-24高三下·河北沧州·阶段练习
名校
解题方法
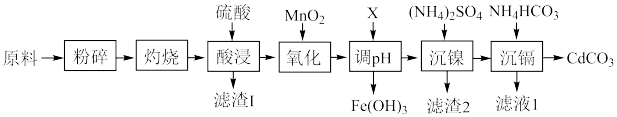
7 . 镍-镉电池是一种非常理想的直流供电电池。废旧镍-镉电池中含有镍、镉、铁及少量钴和有机质等。回收利用废旧镍-镉电池的一种工艺流程如图所示。
(1)“灼烧”时控制温度600~700℃,并通入足量空气,该工序的作用是_____ 。
(2)“氧化”工序发生主要反应的离子方程式为_____ 。
(3)试剂X可选择_____(填标号)。
(4)已知: 的溶度积
的溶度积 ,“调pH”时溶液中
,“调pH”时溶液中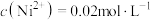 ,则应控制pH小于
,则应控制pH小于_____ 。
(5)滤渣2可表示为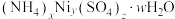 。取3.05g样品溶于适量蒸馏水,加入过量NaOH溶液并加热,产生标准状况下448mL气体和0.93g沉淀,则滤渣2的化学式为
。取3.05g样品溶于适量蒸馏水,加入过量NaOH溶液并加热,产生标准状况下448mL气体和0.93g沉淀,则滤渣2的化学式为_____ 。
(6)滤液1经处理之后可循环至_____ 工序中使用。
(7) 可用于冶炼镉,产生的粗镉可利用电解精炼的方法进行提纯,在电解池的
可用于冶炼镉,产生的粗镉可利用电解精炼的方法进行提纯,在电解池的_____ (填“阳极”或“阴极”)产生纯镉。
(8)一项研究表明,采用溶剂萃取法可将 、
、 、
、 从混合溶液中有效分离。如图为不同pH下DEHPA和Cyanex272对溶液中三种离子的萃取效率,则此方法的流程为
从混合溶液中有效分离。如图为不同pH下DEHPA和Cyanex272对溶液中三种离子的萃取效率,则此方法的流程为_____ 。
(1)“灼烧”时控制温度600~700℃,并通入足量空气,该工序的作用是
(2)“氧化”工序发生主要反应的离子方程式为
(3)试剂X可选择_____(填标号)。
| A.氨水 | B.NaOH溶液 | C.NiO | D. 溶液 溶液 |
(4)已知:
 的溶度积
的溶度积 ,“调pH”时溶液中
,“调pH”时溶液中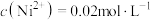 ,则应控制pH小于
,则应控制pH小于(5)滤渣2可表示为
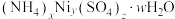 。取3.05g样品溶于适量蒸馏水,加入过量NaOH溶液并加热,产生标准状况下448mL气体和0.93g沉淀,则滤渣2的化学式为
。取3.05g样品溶于适量蒸馏水,加入过量NaOH溶液并加热,产生标准状况下448mL气体和0.93g沉淀,则滤渣2的化学式为(6)滤液1经处理之后可循环至
(7)
 可用于冶炼镉,产生的粗镉可利用电解精炼的方法进行提纯,在电解池的
可用于冶炼镉,产生的粗镉可利用电解精炼的方法进行提纯,在电解池的(8)一项研究表明,采用溶剂萃取法可将
 、
、 、
、 从混合溶液中有效分离。如图为不同pH下DEHPA和Cyanex272对溶液中三种离子的萃取效率,则此方法的流程为
从混合溶液中有效分离。如图为不同pH下DEHPA和Cyanex272对溶液中三种离子的萃取效率,则此方法的流程为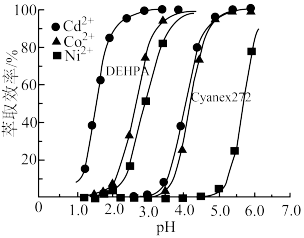
您最近一年使用:0次
2024-04-24更新
|
374次组卷
|
6卷引用:T18-工业流程题
23-24高三上·黑龙江绥化·期末
解题方法
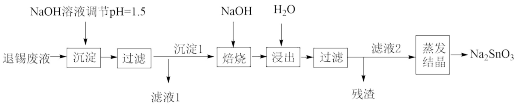
8 . 电子印制工业产生的某退锡废液含硝酸、锡化合物及少量Fe3+和Cu2+等,对其处理的流程如图。
(1)Na2SnO3的回收
①产品Na2SnO3中Sn的化合价是___________ 。
②退锡工艺是利用稀HNO3与Sn反应生成Sn2+,且无气体生成,则生成的硝酸盐是___________ ,废液中的Sn2+易转化成SnO2·xH2O。
③沉淀1的主要成分是SnO2,焙烧时,与NaOH反应的化学方程式为___________ 。
(2)滤液1的处理
①滤液1中Fe3+和Cu2+的浓度相近,加入NaOH溶液,先得到的沉淀是___________ 。
②25℃时,为了使Cu2+沉淀完全,需调节溶液H+浓度不大于___________ mol•L-1.
(3)产品中锡含量的测定
称取产品1.500g,用大量盐酸溶解,在CO2保护下,先用Al片将Sn4+还原为Sn2+,再用0.1000mol•L-1KIO3标准溶液滴定,以淀粉作指示剂滴定过程中IO 被还原为I—,终点时消耗KIO3溶液20.00mL。
被还原为I—,终点时消耗KIO3溶液20.00mL。
终点时的现象为___________ ,产生I2的离子反应方程式为___________ 。
| 化学式 | Sn(OH)4(或SnO2·2H2O) | Fe(OH)3 | Cu(OH)2 |
| 溶度积 | 1.0×10-56 | 4×10-38 | 2.5×10-20 |
①产品Na2SnO3中Sn的化合价是
②退锡工艺是利用稀HNO3与Sn反应生成Sn2+,且无气体生成,则生成的硝酸盐是
③沉淀1的主要成分是SnO2,焙烧时,与NaOH反应的化学方程式为
(2)滤液1的处理
①滤液1中Fe3+和Cu2+的浓度相近,加入NaOH溶液,先得到的沉淀是
②25℃时,为了使Cu2+沉淀完全,需调节溶液H+浓度不大于
(3)产品中锡含量的测定
称取产品1.500g,用大量盐酸溶解,在CO2保护下,先用Al片将Sn4+还原为Sn2+,再用0.1000mol•L-1KIO3标准溶液滴定,以淀粉作指示剂滴定过程中IO
 被还原为I—,终点时消耗KIO3溶液20.00mL。
被还原为I—,终点时消耗KIO3溶液20.00mL。终点时的现象为
您最近一年使用:0次
名校
9 . 物质类别和元素化合价是研究物质性质的两个重要角度。
Ⅰ.硫在不同价态之间的转化: 溶液
溶液 溶液
溶液
(1)反应①的转化说明
 的类别属于
的类别属于 溶液,从化合价的角度分析,反应②合理的是
溶液,从化合价的角度分析,反应②合理的是a. b.
b. c.
c.
Ⅱ.某兴趣小组模拟工业制取 的装置(夹持和加热装置略)如图所示。
的装置(夹持和加热装置略)如图所示。
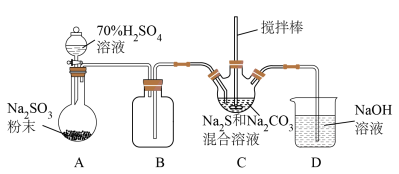
(2)装置A中发生反应的化学方程式为
(3)装置C发生的反应有①
 ;②……;③
;②……;③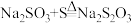 ,反应②的离子方程式为
,反应②的离子方程式为 ,应使三颈烧瓶中
,应使三颈烧瓶中 和
和 恰好完全反应,则三颈烧瓶中
恰好完全反应,则三颈烧瓶中 和
和 物质的量之比应为
物质的量之比应为(4)工业上常用
 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为 ,发生反应的离子方程式为
,发生反应的离子方程式为 可用于氰化物解毒,解毒原理为
可用于氰化物解毒,解毒原理为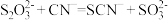 。体外模拟该解毒实验,检验该转化有
。体外模拟该解毒实验,检验该转化有 生成的实验操作是
生成的实验操作是
您最近一年使用:0次
2024·山东济宁·一模
10 . 从废旧磷酸铁锂电极材料(LiFePO4、导电石墨、铝箔)中回收锂的工艺流程如图,下列说法错误的是
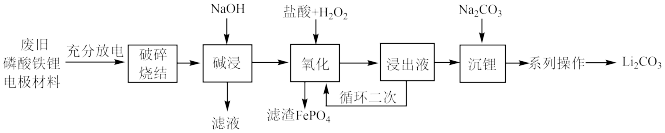
| A.旧电池拆解前进行充分放电是因为放电可使Li+在负极富集 |
| B.“氧化”时,H2O2可用KClO3代替 |
| C.“氧化”时发生的化学反应方程式为:2LiFePO4+H2O2+2HCl=2LiCl+2FePO4+2H2O |
| D.“系列操作”具体包括水浴加热、趁热过滤、洗涤、干燥 |
您最近一年使用:0次



