1 . 铬铁渣是火法炼铬所产生的废渣,其中铬以低价态的 存在,主要杂质为铁、铝、硅的氧化物,从铬铁渣中提取铬的一种流程如图所示
存在,主要杂质为铁、铝、硅的氧化物,从铬铁渣中提取铬的一种流程如图所示 存在,在碱性介质中以
存在,在碱性介质中以 存在。下列说法错误的是
存在。下列说法错误的是
 存在,主要杂质为铁、铝、硅的氧化物,从铬铁渣中提取铬的一种流程如图所示
存在,主要杂质为铁、铝、硅的氧化物,从铬铁渣中提取铬的一种流程如图所示
 存在,在碱性介质中以
存在,在碱性介质中以 存在。下列说法错误的是
存在。下列说法错误的是A.焙烧后,含铬化合物主要以 存在 存在 |
| B.加水浸取过滤,滤渣1的主要成分应含有铁元素 |
| C.除铝步骤,为使杂质沉淀彻底,应加入足量稀硫酸 |
D.还原步骤发生的离子反应是: |
您最近一年使用:0次
名校
解题方法
2 . 硝酸厂烟气中的大量NO经还原法可转化为无害物质。常温下,将NO与 的混合气体通入
的混合气体通入 与
与 的混合溶液中,其转化过程如图所示。下列说法错误的是
的混合溶液中,其转化过程如图所示。下列说法错误的是
 的混合气体通入
的混合气体通入 与
与 的混合溶液中,其转化过程如图所示。下列说法错误的是
的混合溶液中,其转化过程如图所示。下列说法错误的是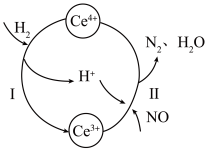
A.该转化过程的实质为NO被 还原 还原 |
| B.反应I中氧化剂与还原剂的物质的量之比为1∶2 |
C.反应II的离子反应方程式为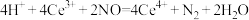 |
D.反应过程中混合溶液内 和 和 的总数不变 的总数不变 |
您最近一年使用:0次
2023-11-29更新
|
671次组卷
|
5卷引用: 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末考试化学模拟卷(二)
名校
解题方法
3 . 分类思想是化学学科学习与研究的一种极为重要的思维方式。回答下列向题:
(1)有如下几种物质: 、
、 、
、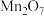 、
、 、
、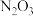 五种成盐氧化物,按化学性质可将它们分成
五种成盐氧化物,按化学性质可将它们分成________ (填“二”或“三”)类,写出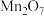 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:___________ 。
(2)磷能形成多种具有独特性质的物质。
①如磷能形成红磷、白磷、黑磷等多种单质,它们互为________ (填相互关系)。白磷有剧毒,硫酸铜可作为白磷中毒的解毒剂,请配平相应的化学方程式:________
____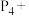 ______
______ _____
_____ _____
_____ ____
____ _____
_____
②磷的一种组成为 的盐,能与盐酸反应,但不能与
的盐,能与盐酸反应,但不能与 溶液反应,下列有关
溶液反应,下列有关 、
、 的分析中正确的是
的分析中正确的是________ (填字母)。
A. 是酸式盐 B.
是酸式盐 B. 是正盐
是正盐
C.均具有较强的还原性 D. 是三元弱酸
是三元弱酸
(1)有如下几种物质:
 、
、 、
、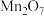 、
、 、
、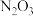 五种成盐氧化物,按化学性质可将它们分成
五种成盐氧化物,按化学性质可将它们分成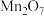 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:(2)磷能形成多种具有独特性质的物质。
①如磷能形成红磷、白磷、黑磷等多种单质,它们互为
____
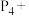 ______
______ _____
_____ _____
_____ ____
____ _____
_____
②磷的一种组成为
 的盐,能与盐酸反应,但不能与
的盐,能与盐酸反应,但不能与 溶液反应,下列有关
溶液反应,下列有关 、
、 的分析中正确的是
的分析中正确的是A.
 是酸式盐 B.
是酸式盐 B. 是正盐
是正盐C.均具有较强的还原性 D.
 是三元弱酸
是三元弱酸
您最近一年使用:0次
2023-11-13更新
|
280次组卷
|
2卷引用: 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末考试化学模拟卷(二)
4 . 含氯物质在日常生活中具有许多重要用途,回答下列问题:
(1)亚氯酸钠( )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
(2)我国从2000年起逐步用 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为___________ 。
(3)工业上可利用 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。
(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为___________ 。
(5)请完成该过程的化学方程式并配平。
______ _______
_______ ______
______ _______
_______ _______
_______ ______(________)
______(________) ___________
若反应生成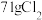 ,被氧化的HCl质量为
,被氧化的HCl质量为___________ 。
(6)已知氧化性: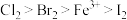 ,则:
,则:
① 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: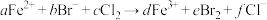 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是___________ 。
A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
② 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为___________ 。
(7)实验室用下列方法均可制取氯气
①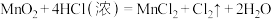
②
③
④
若各反应转移的电子数相同,①②③④生成的氯气质量比为___________ 。
(1)亚氯酸钠(
 )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________A.NaCl、 | B.NaCl、NaClO |
C. 、 、 | D.NaCl、 |
 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为(3)工业上可利用
 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、
 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为(5)请完成该过程的化学方程式并配平。
______
 _______
_______ ______
______ _______
_______ _______
_______ ______(________)
______(________) 若反应生成
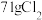 ,被氧化的HCl质量为
,被氧化的HCl质量为(6)已知氧化性:
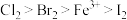 ,则:
,则:①
 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: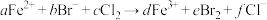 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
②
 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为(7)实验室用下列方法均可制取氯气
①
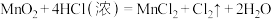
②

③

④

若各反应转移的电子数相同,①②③④生成的氯气质量比为
您最近一年使用:0次
2023-10-11更新
|
800次组卷
|
3卷引用: 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末考试化学模拟卷(二)
解题方法
5 . 氧钒(Ⅳ)碱式碳酸铵晶体{(NH4)5[CVO)6(CO3)4(OH)9]•10H2O}是制备多种含钒产品和催化剂的基础原料和前驱体。
已知:①氧钒(Ⅳ)碱式碳酸铵晶体呈紫红色,难溶于水和乙醇;
②VO2+有较强还原性,易被氧化。
实验室以V2O5为原料制备该晶体的流程如图:
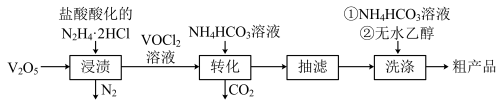
请回答下列问题:
(1)“浸渍”时反应的化学方程式为___________ 。
(2)“转化”时需要在CO2氛围中进行的原因是___________ 。
(3)“转化”可在下图装置中进行:
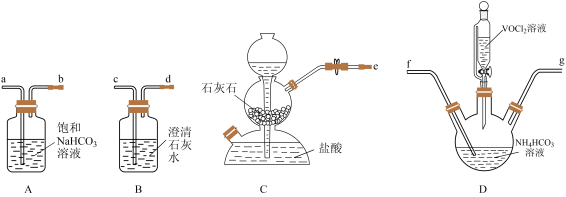
①上述装置连接的合理顺序为e→___________ (按气流方向,用小写字母表示)。
②写出装置D中生成氧钮(Ⅳ)碱式碳酸铵晶体的化学方程式___________ 。
(4)“抽滤”装置如图所示,抽滤原理是___________ 。

(5)“洗涤”时用饱和NH4HCO3溶液洗涤晶体,检验晶体已洗涤干净的操作是___________ 。
(6)为测定粗产品中钒元素的含量,称取l.0g粗产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后加入0.01mol/LKMnO4溶液至稍过量,充分反应后继续滴加2%的NaNO2溶液至稍过量,再用尿素除去过量的NaNO2,滴入几滴铁氰化钾K3[Fe(CN)6]溶液,最后用0.2mol/L(NH4)2Fe(SO4)2标准溶液滴定,滴定终点消耗标准溶液的体积为20.00mL。(已知粗产品中杂质不含钒,也不参与反应;滴定反应为
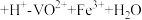 )
)
①滴定终点时的现象为___________ 。
②粗产品中钒元素的质量分数为___________ %。
已知:①氧钒(Ⅳ)碱式碳酸铵晶体呈紫红色,难溶于水和乙醇;
②VO2+有较强还原性,易被氧化。
实验室以V2O5为原料制备该晶体的流程如图:

请回答下列问题:
(1)“浸渍”时反应的化学方程式为
(2)“转化”时需要在CO2氛围中进行的原因是
(3)“转化”可在下图装置中进行:

①上述装置连接的合理顺序为e→
②写出装置D中生成氧钮(Ⅳ)碱式碳酸铵晶体的化学方程式
(4)“抽滤”装置如图所示,抽滤原理是

(5)“洗涤”时用饱和NH4HCO3溶液洗涤晶体,检验晶体已洗涤干净的操作是
(6)为测定粗产品中钒元素的含量,称取l.0g粗产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后加入0.01mol/LKMnO4溶液至稍过量,充分反应后继续滴加2%的NaNO2溶液至稍过量,再用尿素除去过量的NaNO2,滴入几滴铁氰化钾K3[Fe(CN)6]溶液,最后用0.2mol/L(NH4)2Fe(SO4)2标准溶液滴定,滴定终点消耗标准溶液的体积为20.00mL。(已知粗产品中杂质不含钒,也不参与反应;滴定反应为

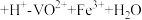 )
)①滴定终点时的现象为
②粗产品中钒元素的质量分数为
您最近一年使用:0次
6 . 某废铁铬催化剂(含 、
、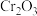 、MgO、
、MgO、 及少量不溶性杂质)回收铁、铬的工艺流程如下图所示:
及少量不溶性杂质)回收铁、铬的工艺流程如下图所示:
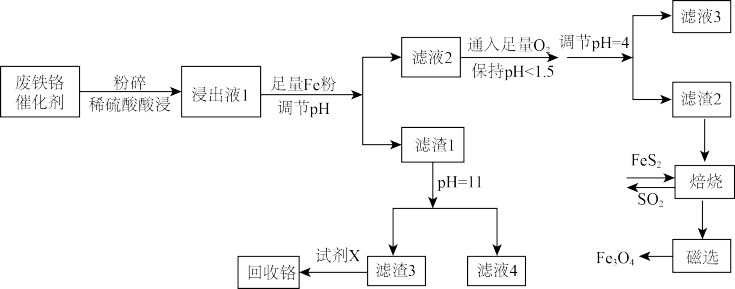
已知:i.有关金属离子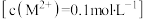 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:
ii.
ⅲ.已知Cr的金属性强于Fe
(1)滤渣3成分的化学式为_______ ;回收铬时,铬的存在形式为_______ (填化学式)。
(2)加入铁粉后,调节pH的范围为_______ 。
(3)由滤渣1得到滤液4发生反应的离子方程式为_______ 。
(4)由滤液3得到结晶水合物的操作是_______ 、过滤、洗涤、干燥。
(5)滤渣2与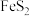 混合后隔绝空气焙烧,总反应的化学方程式为
混合后隔绝空气焙烧,总反应的化学方程式为_______ ;该过程加入少量CaO的目的是_______ 。
 、
、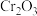 、MgO、
、MgO、 及少量不溶性杂质)回收铁、铬的工艺流程如下图所示:
及少量不溶性杂质)回收铁、铬的工艺流程如下图所示:
已知:i.有关金属离子
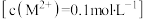 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:| 金属离子 |  | 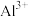 |  |  | 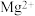 |
| 开始沉淀pH | 1.5 | 4.0 | 4.6 | 7.6 | 9.5 |
| 沉淀完全pH | 2.8 | 5.2 | 6.8 | 9.7 | 11.1 |
| 开始溶解的pH | ― | 7.8 | 12 | ― | ― |
| 溶解完全的pH | ― | 10.8 | >14 | ― | ― |

ⅲ.已知Cr的金属性强于Fe
(1)滤渣3成分的化学式为
(2)加入铁粉后,调节pH的范围为
(3)由滤渣1得到滤液4发生反应的离子方程式为
(4)由滤液3得到结晶水合物的操作是
(5)滤渣2与
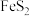 混合后隔绝空气焙烧,总反应的化学方程式为
混合后隔绝空气焙烧,总反应的化学方程式为
您最近一年使用:0次
2022-10-13更新
|
637次组卷
|
3卷引用:山东聊城第二中学2022-2023学年高三上学期期中考试化学试题
山东聊城第二中学2022-2023学年高三上学期期中考试化学试题湖北省部分重点中学2022-2023学年高三上学期10月联考化学试题(已下线)回归教材重难点04 “9种”物质的性质及应用-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)
7 . 以硅藻土为载体的五氧化二钒( )是接触法制备硫酸的催化剂。利用钒钛磁铁矿冶炼后产生的钒渣(主要含
)是接触法制备硫酸的催化剂。利用钒钛磁铁矿冶炼后产生的钒渣(主要含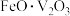 、
、 、
、 等)生产
等)生产 的工艺流程如下。
的工艺流程如下。

查资料知:① 在
在 时开始沉淀,
时开始沉淀, 时沉淀完全;
时沉淀完全; 在
在 时开始沉淀,
时开始沉淀, 时沉淀完全;
时沉淀完全;
②多钒酸盐在水中溶解度较小; 微溶于冷水,可溶于热水,不溶于乙醇。
微溶于冷水,可溶于热水,不溶于乙醇。
③部分含钒物质在不同pH溶液中的主要存在形式如下:
回答下列问题:
(1)“焙烧”包括氧化和钠化成盐两个过程,氧化的目的是获得 ,氧化过程中
,氧化过程中 发生反应的化学方程式为
发生反应的化学方程式为_______ ;“焙烧”时钒渣与空气逆流混合的目的为_______ 。
(2)“酸浸”时含V化合物发生的离子反应方程式为_______ ;铝元素在“_______ ”(填操作单元名称)过程中被除去;“滤渣2”的主要成分为_______ 。
(3)“一系列操作”包括过滤、洗涤、干燥等,洗涤时最好选用的试剂为_______ ;
A.冷水 B.热水 C.乙醇 D. 溶液
溶液
“沉钒”得到偏钒酸铵(NH4VO3),若滤液中 ,不考虑溶液体积变化,为使钒元素的沉降率达到98%,至少应调节
,不考虑溶液体积变化,为使钒元素的沉降率达到98%,至少应调节 为
为_______  。[已知
。[已知 ]
]
(4)“煅烧”过程中,部分 可能会被
可能会被 转化成
转化成 ,同时生成无污染的气体,反应中氧化产物与还原产物的物质的量之比为
,同时生成无污染的气体,反应中氧化产物与还原产物的物质的量之比为_______ 。
 )是接触法制备硫酸的催化剂。利用钒钛磁铁矿冶炼后产生的钒渣(主要含
)是接触法制备硫酸的催化剂。利用钒钛磁铁矿冶炼后产生的钒渣(主要含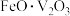 、
、 、
、 等)生产
等)生产 的工艺流程如下。
的工艺流程如下。
查资料知:①
 在
在 时开始沉淀,
时开始沉淀, 时沉淀完全;
时沉淀完全; 在
在 时开始沉淀,
时开始沉淀, 时沉淀完全;
时沉淀完全;②多钒酸盐在水中溶解度较小;
 微溶于冷水,可溶于热水,不溶于乙醇。
微溶于冷水,可溶于热水,不溶于乙醇。③部分含钒物质在不同pH溶液中的主要存在形式如下:
| pH | <1 | 1~4 | 4~6 | 6~8.5 | 8.5~13 | >13 |
| 主要形式 |  |  | 多矾酸根 |  | 多矾酸根 | 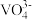 |
回答下列问题:
(1)“焙烧”包括氧化和钠化成盐两个过程,氧化的目的是获得
 ,氧化过程中
,氧化过程中 发生反应的化学方程式为
发生反应的化学方程式为(2)“酸浸”时含V化合物发生的离子反应方程式为
(3)“一系列操作”包括过滤、洗涤、干燥等,洗涤时最好选用的试剂为
A.冷水 B.热水 C.乙醇 D.
 溶液
溶液“沉钒”得到偏钒酸铵(NH4VO3),若滤液中
 ,不考虑溶液体积变化,为使钒元素的沉降率达到98%,至少应调节
,不考虑溶液体积变化,为使钒元素的沉降率达到98%,至少应调节 为
为 。[已知
。[已知 ]
](4)“煅烧”过程中,部分
 可能会被
可能会被 转化成
转化成 ,同时生成无污染的气体,反应中氧化产物与还原产物的物质的量之比为
,同时生成无污染的气体,反应中氧化产物与还原产物的物质的量之比为
您最近一年使用:0次
8 . 重铬酸钾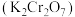 是一种强氧化剂,在实验室和工业中都有很广泛的应用.某实验小组以铬铁矿[主要成分为
是一种强氧化剂,在实验室和工业中都有很广泛的应用.某实验小组以铬铁矿[主要成分为 ,还含有少量的
,还含有少量的 、
、 、
、 等]为原料,制备
等]为原料,制备 ,流程如图:
,流程如图:

已知:①酸化1后的溶液中含有 、
、 等。
等。
② 具有还原性,当溶液酸性很强时易被强氧化剂氧化。
具有还原性,当溶液酸性很强时易被强氧化剂氧化。
(1)高温氧化时发生多个反应,其中 和
和 分别转化为
分别转化为 和
和_______ ; 参与反应的产物中含有
参与反应的产物中含有 、
、 等,该反应化学方程式为
等,该反应化学方程式为_______ 。
(2)滤渣1的成分为_______ 。
(3)为使溶液中铝元素尽可能生成沉淀而除去,则需调节溶液中 、
、 浓度均不超过
浓度均不超过 .为达此目的酸化1溶液的
.为达此目的酸化1溶液的 范围是
范围是_______ 。已知: ;
;
(4)酸化2时,酸化的作用是_______ ,在酸化时溶液酸性不能太强的原因是_______ 。
(5)称取 ,样品
,样品 ,配成
,配成 溶液,取
溶液,取 于碘量瓶中,加入稀硫酸和足量碘化钾,并放于暗处,约
于碘量瓶中,加入稀硫酸和足量碘化钾,并放于暗处,约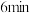 后加入适量水和数滴淀粉指示剂,用
后加入适量水和数滴淀粉指示剂,用 标准溶液滴定至终点(杂质不参与反应),共用去
标准溶液滴定至终点(杂质不参与反应),共用去 标准溶液
标准溶液 ,所得样品中
,所得样品中 的质量分数为
的质量分数为_______ 。相关反应:(ⅰ) (ⅱ)
(ⅱ)
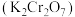 是一种强氧化剂,在实验室和工业中都有很广泛的应用.某实验小组以铬铁矿[主要成分为
是一种强氧化剂,在实验室和工业中都有很广泛的应用.某实验小组以铬铁矿[主要成分为 ,还含有少量的
,还含有少量的 、
、 、
、 等]为原料,制备
等]为原料,制备 ,流程如图:
,流程如图:
已知:①酸化1后的溶液中含有
 、
、 等。
等。②
 具有还原性,当溶液酸性很强时易被强氧化剂氧化。
具有还原性,当溶液酸性很强时易被强氧化剂氧化。(1)高温氧化时发生多个反应,其中
 和
和 分别转化为
分别转化为 和
和 参与反应的产物中含有
参与反应的产物中含有 、
、 等,该反应化学方程式为
等,该反应化学方程式为(2)滤渣1的成分为
(3)为使溶液中铝元素尽可能生成沉淀而除去,则需调节溶液中
 、
、 浓度均不超过
浓度均不超过 .为达此目的酸化1溶液的
.为达此目的酸化1溶液的 范围是
范围是 ;
;
(4)酸化2时,酸化的作用是
(5)称取
 ,样品
,样品 ,配成
,配成 溶液,取
溶液,取 于碘量瓶中,加入稀硫酸和足量碘化钾,并放于暗处,约
于碘量瓶中,加入稀硫酸和足量碘化钾,并放于暗处,约 后加入适量水和数滴淀粉指示剂,用
后加入适量水和数滴淀粉指示剂,用 标准溶液滴定至终点(杂质不参与反应),共用去
标准溶液滴定至终点(杂质不参与反应),共用去 标准溶液
标准溶液 ,所得样品中
,所得样品中 的质量分数为
的质量分数为 (ⅱ)
(ⅱ)
您最近一年使用:0次
名校
9 . 中学常见反应的化学方程式是A+B X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为了1:4。请回答:
X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为了1:4。请回答:
(1)若Y是黄绿色气体,则Y的电子式是______ ,该反应的离子方程式是______ 。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是________ .
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①元素在周期表中的位置是______ (填所在周期和族);Y的化学式是______ 。
②含amol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是______ mol。
(4)若A、B、X、Y均为化合物,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色,则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是_________ 。
 X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为了1:4。请回答:
X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为了1:4。请回答:(1)若Y是黄绿色气体,则Y的电子式是
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①元素在周期表中的位置是
②含amol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是
(4)若A、B、X、Y均为化合物,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色,则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是
您最近一年使用:0次
2019-10-21更新
|
254次组卷
|
2卷引用:山东省聊城第一中学2020届高三上学期期中考试化学试题
名校
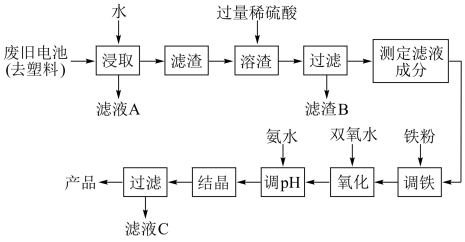
10 . 碱性锌锰电池的工作原理:Zn+2MnO2+2H2O 2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1−x)Fe2O4,其工艺流程如图所示:
2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1−x)Fe2O4,其工艺流程如图所示:
(1)已知MnxZn(1−x)Fe2O4中锰元素的化合价与实验室用二氧化锰制 取氯气时还原产物中的锰相同,则铁元素的化合价为
取氯气时还原产物中的锰相同,则铁元素的化合价为___________ 。
(2)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:_________________________________ 。
(3)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1−x)Fe2O4相符合。
①写出“调铁”工序中发生反应的离子方程式:______________________ 、_______ 。
②若测得滤液的成分为c(Mn2+)+c( Zn2+)=a mol·L−1,c(Fe2+)+c(Fe3+)=b mol·L−1,滤液体积为1 m3,“调铁”工序中,需加入的铁粉质量为
Zn2+)=a mol·L−1,c(Fe2+)+c(Fe3+)=b mol·L−1,滤液体积为1 m3,“调铁”工序中,需加入的铁粉质量为__________  _kg(忽略溶液体积变化,用含a、b的代数式表示)。
_kg(忽略溶液体积变化,用含a、b的代数式表示)。
(4)在“氧化”工序中,加入双氧水的目的是把 Fe 2+氧化为 Fe 3+;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是______________________ 。
(5)用氨水“调pH”后,经“结晶”、“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氮肥,该氮肥的溶液中离子浓度由大到小的排序为_______________ 。
 2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1−x)Fe2O4,其工艺流程如图所示:
2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1−x)Fe2O4,其工艺流程如图所示:
(1)已知MnxZn(1−x)Fe2O4中锰元素的化合价与实验室用二氧化锰制
 取氯气时还原产物中的锰相同,则铁元素的化合价为
取氯气时还原产物中的锰相同,则铁元素的化合价为(2)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:
(3)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1−x)Fe2O4相符合。
①写出“调铁”工序中发生反应的离子方程式:
②若测得滤液的成分为c(Mn2+)+c(
 Zn2+)=a mol·L−1,c(Fe2+)+c(Fe3+)=b mol·L−1,滤液体积为1 m3,“调铁”工序中,需加入的铁粉质量为
Zn2+)=a mol·L−1,c(Fe2+)+c(Fe3+)=b mol·L−1,滤液体积为1 m3,“调铁”工序中,需加入的铁粉质量为 _kg(忽略溶液体积变化,用含a、b的代数式表示)。
_kg(忽略溶液体积变化,用含a、b的代数式表示)。(4)在“氧化”工序中,加入双氧水的目的是把 Fe 2+氧化为 Fe 3+;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是
(5)用氨水“调pH”后,经“结晶”、“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氮肥,该氮肥的溶液中离子浓度由大到小的排序为
您最近一年使用:0次
2019-04-15更新
|
1231次组卷
|
8卷引用:山东省聊城市第一中学2021届高三下学期开学模拟考试化学试题



