名校
1 .  具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。
具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。
Ⅰ.下列是制备 的一种流程:
的一种流程:
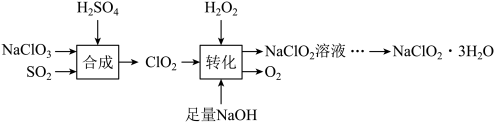
已知: 饱和溶液在低于38℃时析出
饱和溶液在低于38℃时析出 ,高于38℃时析出
,高于38℃时析出 。
。
(1)写出“合成”中发生反应的离子方程式:___________ 。若生成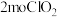 时,电子转移的数目是
时,电子转移的数目是___________ 。
(2)“转化”过程中 的作用是
的作用是___________ (选填“氧化剂”或“还原剂”),写出反应的化学方程式是___________ 。
(3)由 溶液得到
溶液得到 的操作为:蒸发浓缩,
的操作为:蒸发浓缩,___________ ,过滤洗涤,得到 产品。
产品。
Ⅱ.为确定产品的纯度,进行如下实验:
步骤1:取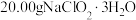 样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。
样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。
步骤2:取出20.00mL配制的溶液于锥形瓶中,加入略过量的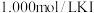 溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用
溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用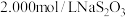 溶液滴定至终点。
溶液滴定至终点。
步骤3:重复以上操作2-3次测得滴定 溶液的平均体积为22.00mL。
溶液的平均体积为22.00mL。
已知: ,
,
(4)试计算该 样品的纯度
样品的纯度___________ 。
 具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。
具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。Ⅰ.下列是制备
 的一种流程:
的一种流程:
已知:
 饱和溶液在低于38℃时析出
饱和溶液在低于38℃时析出 ,高于38℃时析出
,高于38℃时析出 。
。(1)写出“合成”中发生反应的离子方程式:
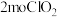 时,电子转移的数目是
时,电子转移的数目是(2)“转化”过程中
 的作用是
的作用是(3)由
 溶液得到
溶液得到 的操作为:蒸发浓缩,
的操作为:蒸发浓缩, 产品。
产品。Ⅱ.为确定产品的纯度,进行如下实验:
步骤1:取
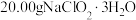 样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。
样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。步骤2:取出20.00mL配制的溶液于锥形瓶中,加入略过量的
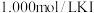 溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用
溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用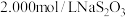 溶液滴定至终点。
溶液滴定至终点。步骤3:重复以上操作2-3次测得滴定
 溶液的平均体积为22.00mL。
溶液的平均体积为22.00mL。已知:
 ,
,
(4)试计算该
 样品的纯度
样品的纯度
您最近一年使用:0次
名校
2 . 工业生产中除去电石渣浆(含 )中的
)中的 并制取硫酸盐的一种常用流程如图所示。下列说法正确的是
并制取硫酸盐的一种常用流程如图所示。下列说法正确的是
 )中的
)中的 并制取硫酸盐的一种常用流程如图所示。下列说法正确的是
并制取硫酸盐的一种常用流程如图所示。下列说法正确的是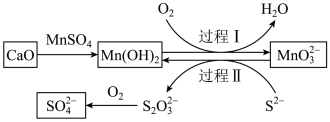
A.碱性条件下,氧化性: |
B.过程Ⅱ中,反应的离子方程式为 |
C.将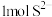 转化为 转化为 理论上需要 理论上需要 的体积为 的体积为 (标准状况) (标准状况) |
| D.该过程中涉及的化学反应均是氧化还原反应 |
您最近一年使用:0次
2024-01-14更新
|
952次组卷
|
4卷引用:山东省淄博第十一中学2023-2024学年高一下学期4月阶段性考试化学试卷
23-24高一上·全国·期末
名校
3 . 氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,以下为制备两种消毒剂的方法,请回答下列问题:
(1)实验室沿用舍勒的方法制取 时选用图中装置
时选用图中装置_______ (填“A”或“B”),反应的离子方程式为_______ ,装置B中管f的作用是_______ 。
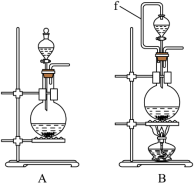
(2)实验室制取干燥、纯净的 ,所需图装置的接口连接顺序为:发生装置→
,所需图装置的接口连接顺序为:发生装置→_______ (填字母)。
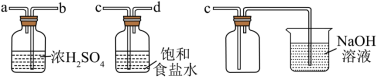
(3)反应停止后,实验小组检验烧瓶中还有 和盐酸。小组同学探究不继续产生
和盐酸。小组同学探究不继续产生 的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
【提出猜想】
猜想1: 降低,氧化剂
降低,氧化剂_______ (填化学式)氧化性减弱。
猜想2:_______ 减弱。
猜想3: 增大,氧化剂氧化性减弱。
增大,氧化剂氧化性减弱。
【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
【实验拓展】经过探究,小组同学认为硫酸、 固体和
固体和 混合加热也可制取
混合加热也可制取 。请配平该反应的方程式:
。请配平该反应的方程式:_______ 。
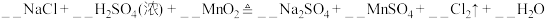
(1)实验室沿用舍勒的方法制取
 时选用图中装置
时选用图中装置
(2)实验室制取干燥、纯净的
 ,所需图装置的接口连接顺序为:发生装置→
,所需图装置的接口连接顺序为:发生装置→
(3)反应停止后,实验小组检验烧瓶中还有
 和盐酸。小组同学探究不继续产生
和盐酸。小组同学探究不继续产生 的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。【提出猜想】
猜想1:
 降低,氧化剂
降低,氧化剂猜想2:
猜想3:
 增大,氧化剂氧化性减弱。
增大,氧化剂氧化性减弱。【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
| 序号 | 实验操作 | 有、无氯气 | 结论 |
| 1 | 加入浓硫酸,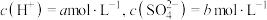 | 有氯气 | 猜想1正确 |
| 2 | 加入氯化钠固体,使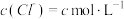 | 有氯气 | 猜想2正确 |
| 3 | 加入浓硫酸和 固体,使 固体,使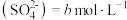 | 猜想3正确 |
 固体和
固体和 混合加热也可制取
混合加热也可制取 。请配平该反应的方程式:
。请配平该反应的方程式: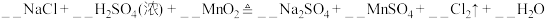
您最近一年使用:0次
2024-01-07更新
|
667次组卷
|
4卷引用:江西省上饶市清源学校2023-2024学年高三上学期12月考试化学试题
江西省上饶市清源学校2023-2024学年高三上学期12月考试化学试题河南省新乡市原阳县第一高级中学2023-2024学年高一上学期1月月考化学试题(已下线)期末测试卷01-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册) 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末综合测试题(一)
名校
解题方法
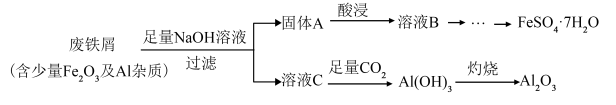
4 . Ⅰ.某化学兴趣小组利用某工业废铁屑制备食品添加剂FeSO4·7H2O,流程图如下___________ (填写化学式);
(2)“酸浸”时需加入试剂的化学式为___________ ,请写出该过程中属于非氧化还原反应的离子方程式___________ ;
(3)溶液C→Al(OH)3的离子方程式是___________ ;
(4)“灼烧”操作应选择下列哪一种仪器___________(填序号)
Ⅱ.高锰酸钾溶液常用于物质的定性检验与定量分析。
(5)现用其测定某补血剂片中亚铁的含量:称取含 (式量为278)的补血剂片a g,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,上述过程发生反应的离子反应式:
(式量为278)的补血剂片a g,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,上述过程发生反应的离子反应式: ___________ ;
(6)甲同学四次实验消耗的KMnO4溶液体积数据如下
根据甲同学的实验数据,该补血剂中 的质量分数为
的质量分数为___________ (用a表示)。
(7)补铁剂使用时建议与维生素C同服,乙同学猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
由上述实验能否得出“维生素C可将Fe3+转化为Fe2+”的结论?回答并说明理由:___________ 。
(2)“酸浸”时需加入试剂的化学式为
(3)溶液C→Al(OH)3的离子方程式是
(4)“灼烧”操作应选择下列哪一种仪器___________(填序号)
A. | B. | C. | D. |
Ⅱ.高锰酸钾溶液常用于物质的定性检验与定量分析。
(5)现用其测定某补血剂片中亚铁的含量:称取含
 (式量为278)的补血剂片a g,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,上述过程发生反应的离子反应式:
(式量为278)的补血剂片a g,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,上述过程发生反应的离子反应式: (6)甲同学四次实验消耗的KMnO4溶液体积数据如下
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V(KMnO4液)/mL | 24.98 | 25.02 | 25.00 | 20.00 |
 的质量分数为
的质量分数为(7)补铁剂使用时建议与维生素C同服,乙同学猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
| 实验方案 | 实验现象 |
| 取适量Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 | 紫色褪去 |
您最近一年使用:0次
2023-12-30更新
|
238次组卷
|
4卷引用:浙江省瑞安中学2023-2024学年高一上学期12月月考化学试卷
名校
解题方法
5 . 镍、钴是重要的战略物资,但资源匮乏。一种利用酸浸出法从冶金厂废炉渣中提取镍和钴的工艺流程如下:
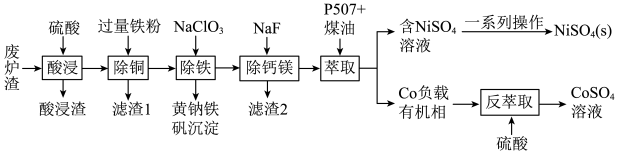
已知:i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)“滤渣1”的主要成分是___________ 。(写化学式)
(2)黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12,“除铁”的离子方程式为___________ 。
(3)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是___________ (结合平衡理论解释)。Ca2+和Mg2+沉淀完全时,溶液中F-的浓度c(F-)最小为___________ mol·L-1。[已知离子浓度≤10-5mol/L时,认为该离子沉淀完全,Ksp(CaF2)=1.0×10-10(mol/L)3,Ksp(MgF2)=7.5×10-11(mol/L)3]
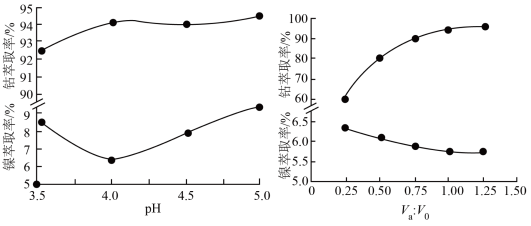
(4)镍、钴萃取率与料液pH、萃取剂体积与料液体积比Va:V0的关系曲线如下图所示,则“萃取”时应选择的pH和Va:V0分别为___________ 、___________ 。
(5)获得NiSO4(s)的“一系列操作”是___________ 。
(6)该工艺流程中,可循环利用的物质是___________ 。

已知:i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)“滤渣1”的主要成分是
(2)黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12,“除铁”的离子方程式为
(3)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是
(4)镍、钴萃取率与料液pH、萃取剂体积与料液体积比Va:V0的关系曲线如下图所示,则“萃取”时应选择的pH和Va:V0分别为

(5)获得NiSO4(s)的“一系列操作”是
(6)该工艺流程中,可循环利用的物质是
您最近一年使用:0次
2023-12-27更新
|
605次组卷
|
4卷引用:山东省实验中学2023-2024学年高三上学期11月二诊化学试题
山东省实验中学2023-2024学年高三上学期11月二诊化学试题山东省淄博市部分学校2023-2024学年高三上学期联考化学试卷广东省深圳市实验学校高中部2023-2024学年高二上学期第三阶段考试化学试题(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
名校
解题方法
6 . MnO2是重要化工原料,由软锰矿制备MnO2的一种工艺流程如下:

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
③该工艺条件下,MnO2与H2SO4不反应。
(1)溶出
①溶出前,软锰矿需研磨,目的是___________ 。
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:
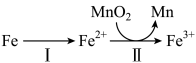
i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是___________ 。
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是___________ 。
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:___________ 。
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为___________ 。
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为___________ (用质量分数表示)。[已知:MnO2及 均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
| Fe3+ | A13+ | Mn2+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
(1)溶出
①溶出前,软锰矿需研磨,目的是
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:

i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为
 均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
您最近一年使用:0次
2023-12-15更新
|
183次组卷
|
3卷引用:北京师范大学2023--2024学年附属实验中学高一上学期化学12月统练
2022·北京·高考真题
7 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。
ⅱ、浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO 。
。
ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
(1)B中试剂是_____ 。
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_____ 。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_____ 。
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO 氧化为MnO
氧化为MnO 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_____ ,但通过实验测定溶液的碱性变化很小。
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填化学式)氧化,可证明实验Ⅲ的悬浊液中氧化剂过量。
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是_____ 。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_____ 。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO
 (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。ⅱ、浓碱条件下,MnO
 可被OH-还原为MnO
可被OH-还原为MnO 。
。ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
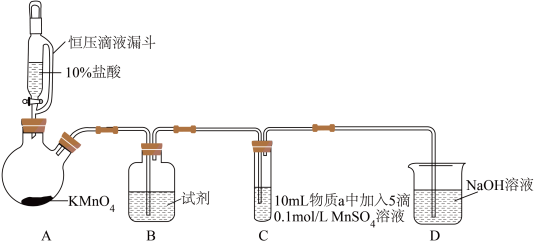
| 实验 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO
 氧化为MnO
氧化为MnO 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
2023-11-29更新
|
886次组卷
|
29卷引用:新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题
新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题北京一零一中学2023-2024学年高三上学期11月统练五化学试题北京市日坛中学2023-2024学年高三上学期10月检测化学试题江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题(已下线)2022年北京市高考真题化学试题(部分试题)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题2022年北京市高考真题化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)2022年北京高考真题变式题1-14(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)专题三 离子反应-实战高考·二轮复习核心突破突破超重点 高效突破综合实验 实验4 创新探究实验角度1控制变量法探究(已下线)2022年北京高考真题化学试题变式题(实验探究题)(已下线)题型46 实验原理探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)微专题 物质性质综合实验探究北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
8 . 硝酸厂烟气中的大量NO经还原法可转化为无害物质。常温下,将NO与 的混合气体通入
的混合气体通入 与
与 的混合溶液中,其转化过程如图所示。下列说法错误的是
的混合溶液中,其转化过程如图所示。下列说法错误的是
 的混合气体通入
的混合气体通入 与
与 的混合溶液中,其转化过程如图所示。下列说法错误的是
的混合溶液中,其转化过程如图所示。下列说法错误的是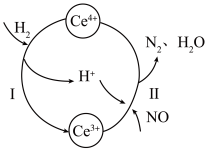
A.该转化过程的实质为NO被 还原 还原 |
| B.反应I中氧化剂与还原剂的物质的量之比为1∶2 |
C.反应II的离子反应方程式为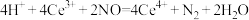 |
D.反应过程中混合溶液内 和 和 的总数不变 的总数不变 |
您最近一年使用:0次
2023-11-29更新
|
706次组卷
|
5卷引用:江苏省宜兴中学、泰兴中学、泰州中学2023-2024学年高一上学期12月联合质量检测化学试卷
9 .  (铋酸钠,浅黄色不溶于冷水的固体)是分析化学常用试剂。工业上以辉铋矿粉(主要成分是
(铋酸钠,浅黄色不溶于冷水的固体)是分析化学常用试剂。工业上以辉铋矿粉(主要成分是 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备铋酸钠的流程如下。下列说法错误的是
等杂质)为原料制备铋酸钠的流程如下。下列说法错误的是
 (铋酸钠,浅黄色不溶于冷水的固体)是分析化学常用试剂。工业上以辉铋矿粉(主要成分是
(铋酸钠,浅黄色不溶于冷水的固体)是分析化学常用试剂。工业上以辉铋矿粉(主要成分是 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备铋酸钠的流程如下。下列说法错误的是
等杂质)为原料制备铋酸钠的流程如下。下列说法错误的是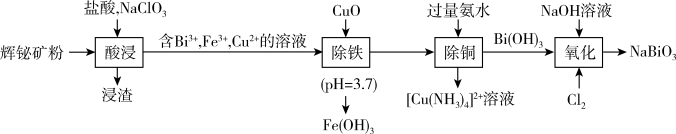
A.“酸浸”过程中,用硝酸代替“盐酸, ”更环保 ”更环保 |
B.“除铜”中涉及的离子方程式为: |
C.检验“酸浸”液中是否含有 ,可以选择“ ,可以选择“ 液”或“ 液”或“ 溶液和双氧水” 溶液和双氧水” |
D.“氧化”过程中,每消耗标准状况下5.6L ,生成70g ,生成70g |
您最近一年使用:0次
2023-11-15更新
|
219次组卷
|
2卷引用:江西省赣州中学(中学生标准学术能力诊断性测试)2023-2024学年高三上学期11月测试化学试题
名校
解题方法
10 . 分类思想是化学学科学习与研究的一种极为重要的思维方式。回答下列向题:
(1)有如下几种物质: 、
、 、
、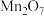 、
、 、
、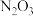 五种成盐氧化物,按化学性质可将它们分成
五种成盐氧化物,按化学性质可将它们分成________ (填“二”或“三”)类,写出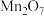 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:___________ 。
(2)磷能形成多种具有独特性质的物质。
①如磷能形成红磷、白磷、黑磷等多种单质,它们互为________ (填相互关系)。白磷有剧毒,硫酸铜可作为白磷中毒的解毒剂,请配平相应的化学方程式:________
____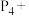 ______
______ _____
_____ _____
_____ ____
____ _____
_____
②磷的一种组成为 的盐,能与盐酸反应,但不能与
的盐,能与盐酸反应,但不能与 溶液反应,下列有关
溶液反应,下列有关 、
、 的分析中正确的是
的分析中正确的是________ (填字母)。
A. 是酸式盐 B.
是酸式盐 B. 是正盐
是正盐
C.均具有较强的还原性 D. 是三元弱酸
是三元弱酸
(1)有如下几种物质:
 、
、 、
、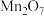 、
、 、
、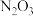 五种成盐氧化物,按化学性质可将它们分成
五种成盐氧化物,按化学性质可将它们分成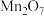 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:(2)磷能形成多种具有独特性质的物质。
①如磷能形成红磷、白磷、黑磷等多种单质,它们互为
____
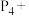 ______
______ _____
_____ _____
_____ ____
____ _____
_____
②磷的一种组成为
 的盐,能与盐酸反应,但不能与
的盐,能与盐酸反应,但不能与 溶液反应,下列有关
溶液反应,下列有关 、
、 的分析中正确的是
的分析中正确的是A.
 是酸式盐 B.
是酸式盐 B. 是正盐
是正盐C.均具有较强的还原性 D.
 是三元弱酸
是三元弱酸
您最近一年使用:0次
2023-11-13更新
|
286次组卷
|
2卷引用:吉林省吉林市第一中学2023--2024学年高一上学期第一次月考化学试题(创新班)



