2024高三·全国·专题练习
名校
1 . 回答下列问题:
(1)随着钴酸锂电池的普及使用,从废旧的钴酸锂电池中提取锂、钴等金属材料意义重大。下图是废旧钴酸锂电池材料(主要成分为LiCoO2,含少量铁、铝、铜等元素的化合物)回收工艺流程:_______ 。
②滤液1中加入Na2SO3的主要目的是_______ ,加入NaClO3的主要目的是_______ 。
③“沉钴”过程中,(NH4)2C2O4的加入量(图甲)、沉淀反应的温度(图乙)与钴的沉淀率关系如图所示: )∶n(Co2+)为1.15的原因是
)∶n(Co2+)为1.15的原因是_______ ,温度高于50℃,钴的沉淀率降低的原因是_______ 。
(2)亚氯酸钠(NaClO2)具有强氧化性,受热易分解,可作漂白剂、食品消毒剂等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:_______ 。
②采取“减压蒸发”而不用“常压蒸发”,原因是_______ 。
③“反应2”中使用H2O2而不用其他物质的原因是_______ 。
(1)随着钴酸锂电池的普及使用,从废旧的钴酸锂电池中提取锂、钴等金属材料意义重大。下图是废旧钴酸锂电池材料(主要成分为LiCoO2,含少量铁、铝、铜等元素的化合物)回收工艺流程:

②滤液1中加入Na2SO3的主要目的是
③“沉钴”过程中,(NH4)2C2O4的加入量(图甲)、沉淀反应的温度(图乙)与钴的沉淀率关系如图所示:

 )∶n(Co2+)为1.15的原因是
)∶n(Co2+)为1.15的原因是(2)亚氯酸钠(NaClO2)具有强氧化性,受热易分解,可作漂白剂、食品消毒剂等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:

②采取“减压蒸发”而不用“常压蒸发”,原因是
③“反应2”中使用H2O2而不用其他物质的原因是
您最近一年使用:0次
名校
解题方法
2 . 稀有金属钒和钛在钢铁、化工、航空航天等领域应用广泛。从钒钛磁铁矿中提取钒、钛的工艺流程图如下: 、
、 、
、 和
和 等。
等。
②“高温氯化”后的产物中含少量的 、
、 、
、 、
、 杂质,相关物质的沸点如下表:
杂质,相关物质的沸点如下表:
回答下列问题:
(1)钛在周期表中的位置为___________ ,上述获得钛单质的“还原”工序中需要通入氩气的目的是___________ 。
(2)滤液X中含有的主要金属离子有___________ 。
(3)“高温氯化”工序生成 和一种可燃性气体Y,该反应的化学方程式为
和一种可燃性气体Y,该反应的化学方程式为___________ ; 的粗产品可以通过分馏提纯,但收集的
的粗产品可以通过分馏提纯,但收集的 中总是混有
中总是混有 的原因是
的原因是___________ 。
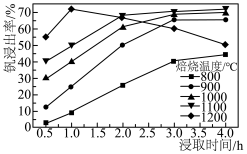
(4)钒的浸出率随焙烧温度和浸取时间的变化如图所示,则“焙烧”时最适合的反应条件为___________ 。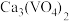 转化成
转化成 进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为
进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为___________ 。
(6)采用USTB工艺电解制备高纯钛,过程以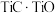 固体为阳极、碳棒为阴极,
固体为阳极、碳棒为阴极, 熔融盐为电解质。阳极产生
熔融盐为电解质。阳极产生 与
与 ,阴极只发生
,阴极只发生 的还原反应。请写出电池阳极反应的电极反应式:
的还原反应。请写出电池阳极反应的电极反应式:___________ 。
 、
、 、
、 和
和 等。
等。②“高温氯化”后的产物中含少量的
 、
、 、
、 、
、 杂质,相关物质的沸点如下表:
杂质,相关物质的沸点如下表:| 化合物 |  |  |  |  |  |
| 沸点/℃ | 136 | 310 | 56.5 | 180 | 127 |
(1)钛在周期表中的位置为
(2)滤液X中含有的主要金属离子有
(3)“高温氯化”工序生成
 和一种可燃性气体Y,该反应的化学方程式为
和一种可燃性气体Y,该反应的化学方程式为 的粗产品可以通过分馏提纯,但收集的
的粗产品可以通过分馏提纯,但收集的 中总是混有
中总是混有 的原因是
的原因是(4)钒的浸出率随焙烧温度和浸取时间的变化如图所示,则“焙烧”时最适合的反应条件为
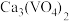 转化成
转化成 进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为
进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为(6)采用USTB工艺电解制备高纯钛,过程以
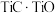 固体为阳极、碳棒为阴极,
固体为阳极、碳棒为阴极, 熔融盐为电解质。阳极产生
熔融盐为电解质。阳极产生 与
与 ,阴极只发生
,阴极只发生 的还原反应。请写出电池阳极反应的电极反应式:
的还原反应。请写出电池阳极反应的电极反应式:
您最近一年使用:0次
2024-04-22更新
|
470次组卷
|
4卷引用:河南省焦作市博爱县第一中学2023-2024学年高三下学期5月月考化学试题
名校
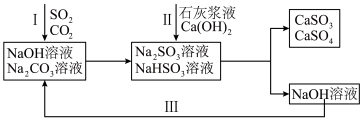
3 . 双碱法是一种用于燃煤尾气脱硫的工艺,其具有脱硫效率高、成本低等优点,以下是一种脱硫工艺简要流程。 时,
时, 和
和 的电离常数如下表所示。
的电离常数如下表所示。
1.等浓度的 和
和 溶液,
溶液,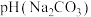
___________ 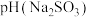 (填“>”、“<”或“=”),请依据电离平衡常数分析原因:
(填“>”、“<”或“=”),请依据电离平衡常数分析原因:___________ 。
2.过程I中, 溶液吸收
溶液吸收 时,随着
时,随着 的通入,会得到不同溶质组成的溶液。
的通入,会得到不同溶质组成的溶液。 时,
时, 的物质的量分数
的物质的量分数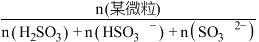 与pH的关系如图所示。
与pH的关系如图所示。___________ 。
②等浓度 和
和 的混合溶液中,下列关系正确的是
的混合溶液中,下列关系正确的是___________ 。
A.
B.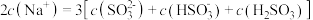
C.
D.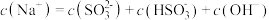
3.生成的 沉淀会被空气中氧气氧化,写出
沉淀会被空气中氧气氧化,写出 被氧化过程的化学方程式为:
被氧化过程的化学方程式为:___________ 。
4.工业上也可以用氨水吸收尾气中的 。氨水吸收
。氨水吸收 后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。
后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。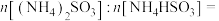
___________ 。
 时,
时, 和
和 的电离常数如下表所示。
的电离常数如下表所示。 |  |
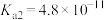 | |
 |  |
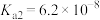 |
1.等浓度的
 和
和 溶液,
溶液,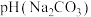
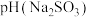 (填“>”、“<”或“=”),请依据电离平衡常数分析原因:
(填“>”、“<”或“=”),请依据电离平衡常数分析原因:2.过程I中,
 溶液吸收
溶液吸收 时,随着
时,随着 的通入,会得到不同溶质组成的溶液。
的通入,会得到不同溶质组成的溶液。 时,
时, 的物质的量分数
的物质的量分数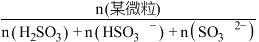 与pH的关系如图所示。
与pH的关系如图所示。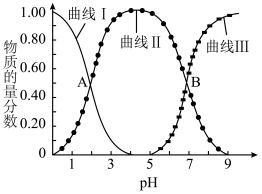
②等浓度
 和
和 的混合溶液中,下列关系正确的是
的混合溶液中,下列关系正确的是A.

B.
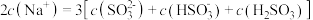
C.

D.
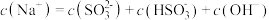
3.生成的
 沉淀会被空气中氧气氧化,写出
沉淀会被空气中氧气氧化,写出 被氧化过程的化学方程式为:
被氧化过程的化学方程式为:4.工业上也可以用氨水吸收尾气中的
 。氨水吸收
。氨水吸收 后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。
后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。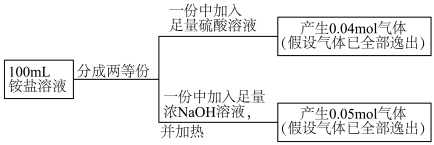
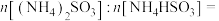
您最近一年使用:0次
2024-04-13更新
|
47次组卷
|
2卷引用:上海市敬业中学2023-2024学年高二下学期月考化学试题
名校
4 . 利用某废矿渣(主要成分为 ,还含有
,还含有 、
、 、
、 等杂质)提取高附加值的铁红(
等杂质)提取高附加值的铁红( )的一种工艺流程如图所示。
)的一种工艺流程如图所示。
(1)“酸浸”前一般需将废矿渣粉碎,其目的是___________ ,“浸渣”的主要成分为___________ (填化学式)。
(2)“还原”过程中发生反应的离子方程式为___________ ,可用___________ 检验是否还原完全。
(3)“净化”时若加入过量氨水,则会使 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为___________ ;“沉镍”过程中,当开始有沉淀析出时,溶液中的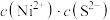 为一定值,数值约为
为一定值,数值约为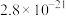 (室温),当溶液中
(室温),当溶液中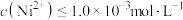 时可认为
时可认为 沉淀完全,试计算此时溶液中的
沉淀完全,试计算此时溶液中的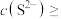
___________ 。
(4)“沉铁”所得“滤渣3”的成分为 ,同时得到二氧化碳气体,则“沉铁”时发生反应的离子方程式为
,同时得到二氧化碳气体,则“沉铁”时发生反应的离子方程式为___________ ;“煅烧”时,每得到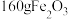 ,理论上消耗氧气(标准状况)的体积为
,理论上消耗氧气(标准状况)的体积为___________ 。
(5)铁红样品的纯度测定:
称取 铁红样品,将样品溶于一定量的硫酸中,得到
铁红样品,将样品溶于一定量的硫酸中,得到 溶液,从中量取
溶液,从中量取 溶液进行如下实验:先加稍过量的
溶液进行如下实验:先加稍过量的 溶液,充分反应后,再向溶液中滴加
溶液,充分反应后,再向溶液中滴加 的
的 溶液,使
溶液,使 恰好转化为
恰好转化为 。三次平行实验所消耗
。三次平行实验所消耗 溶液的体积的平均值为
溶液的体积的平均值为 ,假设杂质始终未参加反应,则铁红样品的纯度为
,假设杂质始终未参加反应,则铁红样品的纯度为___________ %(用含 、
、 、
、 的表达式填写)。
的表达式填写)。
 ,还含有
,还含有 、
、 、
、 等杂质)提取高附加值的铁红(
等杂质)提取高附加值的铁红( )的一种工艺流程如图所示。
)的一种工艺流程如图所示。
(1)“酸浸”前一般需将废矿渣粉碎,其目的是
(2)“还原”过程中发生反应的离子方程式为
(3)“净化”时若加入过量氨水,则会使
 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为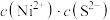 为一定值,数值约为
为一定值,数值约为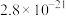 (室温),当溶液中
(室温),当溶液中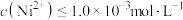 时可认为
时可认为 沉淀完全,试计算此时溶液中的
沉淀完全,试计算此时溶液中的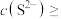
(4)“沉铁”所得“滤渣3”的成分为
 ,同时得到二氧化碳气体,则“沉铁”时发生反应的离子方程式为
,同时得到二氧化碳气体,则“沉铁”时发生反应的离子方程式为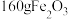 ,理论上消耗氧气(标准状况)的体积为
,理论上消耗氧气(标准状况)的体积为(5)铁红样品的纯度测定:
称取
 铁红样品,将样品溶于一定量的硫酸中,得到
铁红样品,将样品溶于一定量的硫酸中,得到 溶液,从中量取
溶液,从中量取 溶液进行如下实验:先加稍过量的
溶液进行如下实验:先加稍过量的 溶液,充分反应后,再向溶液中滴加
溶液,充分反应后,再向溶液中滴加 的
的 溶液,使
溶液,使 恰好转化为
恰好转化为 。三次平行实验所消耗
。三次平行实验所消耗 溶液的体积的平均值为
溶液的体积的平均值为 ,假设杂质始终未参加反应,则铁红样品的纯度为
,假设杂质始终未参加反应,则铁红样品的纯度为 、
、 、
、 的表达式填写)。
的表达式填写)。
您最近一年使用:0次
2024-03-28更新
|
130次组卷
|
3卷引用:河南省商丘市青桐鸣2023-2024学年高一下学期3月月考化学试题
5 . 从废旧磷酸铁锂电极材料(LiFePO4、导电石墨、铝箔)中回收锂的工艺流程如图,下列说法错误的是
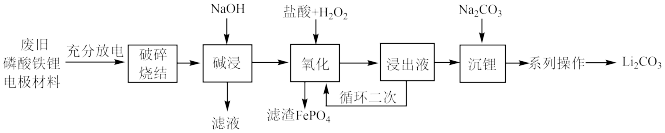
| A.旧电池拆解前进行充分放电是因为放电可使Li+在负极富集 |
| B.“氧化”时,H2O2可用KClO3代替 |
| C.“氧化”时发生的化学反应方程式为:2LiFePO4+H2O2+2HCl=2LiCl+2FePO4+2H2O |
| D.“系列操作”具体包括水浴加热、趁热过滤、洗涤、干燥 |
您最近一年使用:0次
2024-03-21更新
|
393次组卷
|
3卷引用:山东省青岛39中(海大附中)2023-2024学年高一下学期6月阶段性检测化学试题
名校
解题方法
6 . 电池有铅蓄电池、燃料电池(如NO2NH3电池)、锂离子电池、Mg—次氯酸盐电池等,它们可以将化学能转化为电能。NH3、CH4、NaBH4都可用作燃料电池的燃料。CH4的燃烧热为890.3kJ•mol-1。电解则可以将电能转化为化学能,电解饱和NaCl溶液可以得到Cl2,用电解法可制备消毒剂高铁酸钠(Na2FeO4)。下列化学反应表示正确的是
A.铅蓄电池的正极反应:Pb-2e-+SO =PbSO4 =PbSO4 |
B.电解饱和NaCl溶液:2Na++2Cl- 2Na+Cl2↑ 2Na+Cl2↑ |
| C.CH4燃烧:CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=-890.3kJ•mol-1 |
D.一定条件下NO2与NH3的反应:6NO2+8NH3 7N2+12H2O 7N2+12H2O |
您最近一年使用:0次
2024-03-21更新
|
92次组卷
|
2卷引用:江苏省常州市联盟校2023-2024学年高二下学期3月阶段调研化学试题
名校
7 . 大连理工大学课题组通过CuO/ 催化,使NO-CO-
催化,使NO-CO- 反应体系在温和条件下产生
反应体系在温和条件下产生 ,为NO和CO的烟气处理提供了新的途径,其相关的反应为:
,为NO和CO的烟气处理提供了新的途径,其相关的反应为: (未配平),
(未配平), 是阿伏加德罗常数的值,下列有关说法正确的是
是阿伏加德罗常数的值,下列有关说法正确的是
 催化,使NO-CO-
催化,使NO-CO- 反应体系在温和条件下产生
反应体系在温和条件下产生 ,为NO和CO的烟气处理提供了新的途径,其相关的反应为:
,为NO和CO的烟气处理提供了新的途径,其相关的反应为: (未配平),
(未配平), 是阿伏加德罗常数的值,下列有关说法正确的是
是阿伏加德罗常数的值,下列有关说法正确的是A.标准状况下,1.12L NO中含有电子数为1.5 |
B.将 个 个 溶于100mL水中,所得溶液的质量分数约为29.9% 溶于100mL水中,所得溶液的质量分数约为29.9% |
C.生成22g  能消除NO的数目为0.2 能消除NO的数目为0.2 |
D.若NO和CO混合气体的平均相对分子质量为29,则含有CO的数目为0.5 |
您最近一年使用:0次
2024-03-13更新
|
307次组卷
|
4卷引用:山东省青岛第二中学2023-2024学年高一上学期第二次月考化学试卷
8 . 低碳经济已成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。回答下列问题:
(1)工业上用 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:
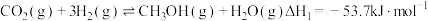
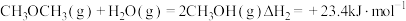
则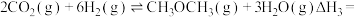
_______ kJ∙mol-1。
(2)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由 制取
制取 的太阳能工艺如图:
的太阳能工艺如图: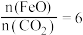 ,则
,则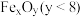 的化学式为
的化学式为_______ ,“热分解系统”中每转移 电子,需消耗
电子,需消耗
_______  。
。
(3)催化时还可以使用一种无机固体电解质作催化剂,其由正离子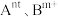 和负离子
和负离子 组成,该物质
组成,该物质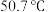 以上形成无序结构(高温相),
以上形成无序结构(高温相),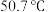 以下变为有序结构(低温相),二者晶体晶胞结构如图所示:
以下变为有序结构(低温相),二者晶体晶胞结构如图所示:_______ 。
ii.“高温相”具有良好的离子导电性,其主要原因是_______ 。
(4)铜基催化剂 (
( 为
为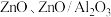 等)是
等)是 加氢制甲醇常用的催化剂,部分合成路线如图所示。
加氢制甲醇常用的催化剂,部分合成路线如图所示。 上发生反应的总化学方程式
上发生反应的总化学方程式_______ 。
(5)利用电解法在碱性或酸性条件下将 还原为
还原为 和
和 的原理如下图所示:
的原理如下图所示: 和法拉第效率(
和法拉第效率(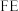 )的定义(X代表
)的定义(X代表 或
或 )如下:
)如下:
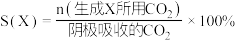

①实验测得,碱性条件生成 总的选择性小于酸性条件,原因是
总的选择性小于酸性条件,原因是_______ 。
②实验测得,酸性条件生成 总的法拉第效率小于碱性条件,原因是
总的法拉第效率小于碱性条件,原因是_______ 。
(1)工业上用
 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知: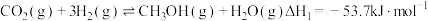
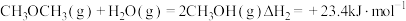
则
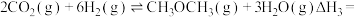
(2)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由
 制取
制取 的太阳能工艺如图:
的太阳能工艺如图: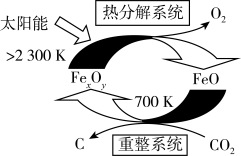
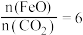 ,则
,则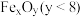 的化学式为
的化学式为 电子,需消耗
电子,需消耗
 。
。(3)催化时还可以使用一种无机固体电解质作催化剂,其由正离子
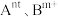 和负离子
和负离子 组成,该物质
组成,该物质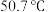 以上形成无序结构(高温相),
以上形成无序结构(高温相),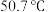 以下变为有序结构(低温相),二者晶体晶胞结构如图所示:
以下变为有序结构(低温相),二者晶体晶胞结构如图所示: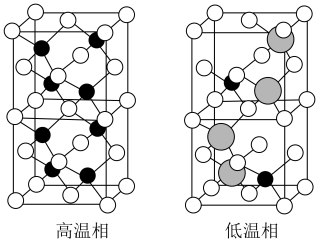
说明:图中,○球为负离子;高温相中的●深色球为正离子或空位;低温相中的 球为
球为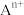 离子,●球为
离子,●球为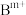 离子。
离子。
ii.“高温相”具有良好的离子导电性,其主要原因是
(4)铜基催化剂
 (
( 为
为 等)是
等)是 加氢制甲醇常用的催化剂,部分合成路线如图所示。
加氢制甲醇常用的催化剂,部分合成路线如图所示。 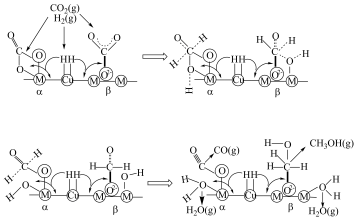
 上发生反应的总化学方程式
上发生反应的总化学方程式(5)利用电解法在碱性或酸性条件下将
 还原为
还原为 和
和 的原理如下图所示:
的原理如下图所示: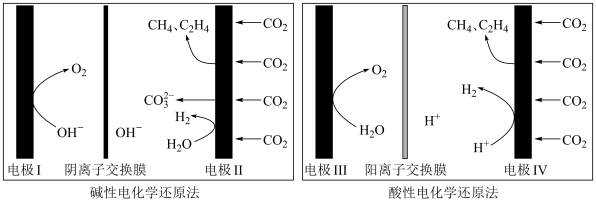
 和法拉第效率(
和法拉第效率(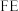 )的定义(X代表
)的定义(X代表 或
或 )如下:
)如下: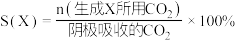

①实验测得,碱性条件生成
 总的选择性小于酸性条件,原因是
总的选择性小于酸性条件,原因是②实验测得,酸性条件生成
 总的法拉第效率小于碱性条件,原因是
总的法拉第效率小于碱性条件,原因是
您最近一年使用:0次
2024-03-11更新
|
428次组卷
|
4卷引用:江苏省常州市第一中2023-2024学年高二下学期5月月考化学试题
江苏省常州市第一中2023-2024学年高二下学期5月月考化学试题江苏省常州市第一中学2023-2024学年高三下学期期初检测化学试卷(已下线)大题预测卷(江西专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)江苏省扬州中学2024届高三下学期考前模拟化学试题
9 . 回答下列问题。
I.智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O。
(1)反应中___________ 元素被氧化,___________ (填化学式)是氧化剂。
(2)用单线桥标出电子转移方向和数目___________ 。
(3)反应产物中,所得氧化产物与还原产物微粒个数之比为___________ 。
Ⅱ.有一种“地康法”制取氯气的反应原理如图所示:
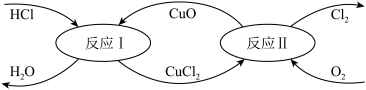
(4)反应Ⅱ的化学方程式为___________ 。
(5)在肉制品加工中,使用发色剂-亚硝酸钠时必须严格控制用量,确保使用安全。某一反应体系中反应物和生成物共有六种:NaNO2、H2O、NO、I2、NaI、HI。已知该反应中NaNO2只发生了如下过程:NaNO2→NO;写出该反应的化学方程式___________ 。
(6)ClO2是一种黄绿色的气体。铬(Cr)的一种固体氧化物Cr2O3与KClO3固体在高温条件下反应,只生成ClO2、Cl2和铬酸钾(K2CrO4)固体三种产物。若该反应中转移24mol电子,生成气体共___________ mol。
I.智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O。
(1)反应中
(2)用单线桥标出电子转移方向和数目
(3)反应产物中,所得氧化产物与还原产物微粒个数之比为
Ⅱ.有一种“地康法”制取氯气的反应原理如图所示:

(4)反应Ⅱ的化学方程式为
(5)在肉制品加工中,使用发色剂-亚硝酸钠时必须严格控制用量,确保使用安全。某一反应体系中反应物和生成物共有六种:NaNO2、H2O、NO、I2、NaI、HI。已知该反应中NaNO2只发生了如下过程:NaNO2→NO;写出该反应的化学方程式
(6)ClO2是一种黄绿色的气体。铬(Cr)的一种固体氧化物Cr2O3与KClO3固体在高温条件下反应,只生成ClO2、Cl2和铬酸钾(K2CrO4)固体三种产物。若该反应中转移24mol电子,生成气体共
您最近一年使用:0次
名校
解题方法
10 . 含氯消毒剂会与水中有机物发生氯代反应,生成物会在人体内积留产生慢性累积中毒,诱发癌症,而 ClO2 是国际上公认的最理想的更换替代产品,我国从2000年起就逐渐用它取代了其它含氯消毒剂。市面上销售的二氧化氯消毒片都是二氧化氯的前体:亚氯酸钠,亚氯酸钠溶液与酸、有机物、还原剂或者氯供体接触,将会发生反应生成二氧化氯气体。
(1)亚氯酸钠溶液和盐酸反应产生ClO2的化学方程式为___________ 。
(2)此反应中氧化剂与还原剂的物质的量之比为____ ,反应中盐酸的作用是____ (填编号)。
A.只有还原性 B.还原性和酸性 C.只有酸性 D.氧化性和酸性
(3)将二氧化氯通入含 CN-的废水中,产生两种对环境友好的气体,氯被还原成最低价离子,发生反应的离子方程式为______ 。
(4)(CN)2、(OCN)2、(SCN)2 等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:F2>(OCN)2>Cl2>(CN)2>(SCN)2>I2,下列方程式中错误的是____(填编号)。
(5)在ClO2的制备方法中,有下列两种制备方法:
方法 1:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法 2:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O:
①分析方法1的化学反应方程式,用双线桥标出电子转移方向和数目______ ,2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
②方法2在实际制备过程中,NaClO3与H2O2的物质的量之比小于2,可能的原因是______ 。
③用方法2制备的ClO2更适合用于饮用水的消毒,其主要原因是_______ 。
(6)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的 ,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的
,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的 ,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式
,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式_________ 。
(7)饮用水中的ClO2、 含量可用连续碘量法进行测定。ClO2被I-还原为
含量可用连续碘量法进行测定。ClO2被I-还原为 、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时, 也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
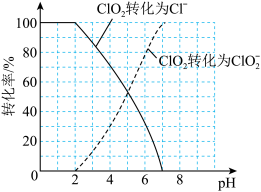
①请写出pH≤2.0时 与I-反应的离子方程式:
与I-反应的离子方程式:_________ 。
②请完成相应的实验步骤:
步骤 1:准确量取V mL水样加入到锥形瓶中;
步骤 2:调节水样的pH为7.0~8.0;
步骤 3:加入足量的KI晶体,充分反应后,滴入少量淀粉溶液,溶液显蓝色;
步骤 4:当加入的c mol/LNa2S2O3溶液体积为V1 mL,恰好完全反应,溶液蓝色恰好褪去;
步骤 5:_____ ,溶液再次显蓝色;
步骤 6:当加入的 c mol/L Na2S2O3 溶液体积达到 V2 mL,溶液蓝色恰好再次褪去。
③根据上述分析数据,测得该饮用水中 的浓度为
的浓度为_______ mol/L(用含字母的代数式表示)。
(1)亚氯酸钠溶液和盐酸反应产生ClO2的化学方程式为
(2)此反应中氧化剂与还原剂的物质的量之比为
A.只有还原性 B.还原性和酸性 C.只有酸性 D.氧化性和酸性
(3)将二氧化氯通入含 CN-的废水中,产生两种对环境友好的气体,氯被还原成最低价离子,发生反应的离子方程式为
(4)(CN)2、(OCN)2、(SCN)2 等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:F2>(OCN)2>Cl2>(CN)2>(SCN)2>I2,下列方程式中错误的是____(填编号)。
| A.2NaSCN+MnO2+2H2SO4=Na2SO4+(SCN)2↑+MnSO4+2H2O |
| B.(CN)2+2KI=2KCN+I2 |
| C.Cl2+2NaOCN= (OCN)2+2NaCl |
| D.2AgCN=2Ag+(CN)2 |
(5)在ClO2的制备方法中,有下列两种制备方法:
方法 1:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法 2:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O:
①分析方法1的化学反应方程式,用双线桥标出电子转移方向和数目
②方法2在实际制备过程中,NaClO3与H2O2的物质的量之比小于2,可能的原因是
③用方法2制备的ClO2更适合用于饮用水的消毒,其主要原因是
(6)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的
 ,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的
,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的 ,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式
,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式(7)饮用水中的ClO2、
 含量可用连续碘量法进行测定。ClO2被I-还原为
含量可用连续碘量法进行测定。ClO2被I-还原为 、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时, 也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
①请写出pH≤2.0时
 与I-反应的离子方程式:
与I-反应的离子方程式:②请完成相应的实验步骤:
步骤 1:准确量取V mL水样加入到锥形瓶中;
步骤 2:调节水样的pH为7.0~8.0;
步骤 3:加入足量的KI晶体,充分反应后,滴入少量淀粉溶液,溶液显蓝色;
步骤 4:当加入的c mol/LNa2S2O3溶液体积为V1 mL,恰好完全反应,溶液蓝色恰好褪去;
步骤 5:
步骤 6:当加入的 c mol/L Na2S2O3 溶液体积达到 V2 mL,溶液蓝色恰好再次褪去。
③根据上述分析数据,测得该饮用水中
 的浓度为
的浓度为
您最近一年使用:0次



