1 . 含氯物质在日常生活中具有许多重要用途,回答下列问题:
(1)亚氯酸钠( )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
(2)我国从2000年起逐步用 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为___________ 。
(3)工业上可利用 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。
(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为___________ 。
(5)请完成该过程的化学方程式并配平。
______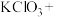 _______
_______ ______
______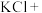 _______
_______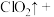 _______
_______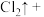 ______(________)
______(________) ___________
若反应生成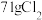 ,被氧化的HCl质量为
,被氧化的HCl质量为___________ 。
(6)已知氧化性: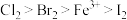 ,则:
,则:
① 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: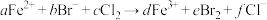 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是___________ 。
A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
② 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为___________ 。
(7)实验室用下列方法均可制取氯气
①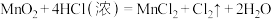
②
③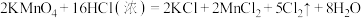
④
若各反应转移的电子数相同,①②③④生成的氯气质量比为___________ 。
(1)亚氯酸钠(
 )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________A.NaCl、 | B.NaCl、NaClO |
C. 、 、 | D.NaCl、 |
 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为(3)工业上可利用
 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、
 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为(5)请完成该过程的化学方程式并配平。
______
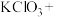 _______
_______ ______
______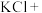 _______
_______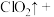 _______
_______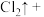 ______(________)
______(________) 若反应生成
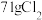 ,被氧化的HCl质量为
,被氧化的HCl质量为(6)已知氧化性:
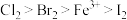 ,则:
,则:①
 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: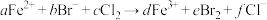 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
②
 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为(7)实验室用下列方法均可制取氯气
①
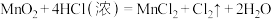
②

③
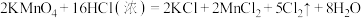
④

若各反应转移的电子数相同,①②③④生成的氯气质量比为
您最近一年使用:0次
2023-10-11更新
|
817次组卷
|
3卷引用:结构与性质
名校
解题方法
2 . 向仅含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知:b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法错误的是
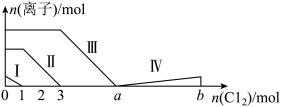
| A.线段Ⅰ、Ⅱ、Ⅲ、Ⅳ分别代表I-、Fe2+、Br-、HIO3的变化情况 |
| B.Fe2+、I-和Br-的物质的量之比为1∶2∶3 |
| C.根据图像可计算b=11 |
| D.线段Ⅳ对应的反应中氧化剂和还原剂的物质的量之比是5∶1 |
您最近一年使用:0次
2023-08-14更新
|
519次组卷
|
4卷引用:第04讲 氧化还原反应的基本概念和规律(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
(已下线)第04讲 氧化还原反应的基本概念和规律(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)河北省迁安市第一中学2022-2023学年高三上学期期中考试化学试题浙江省宁波市鄞州中学(宁波鄞州蓝青高级中学)2023-2024学年高一上学期12月月考化学学科试题 山东省日照市五莲县第一中学2024届高三上学期阶段性测试化学试题
2023高三·全国·专题练习
解题方法
3 . 亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂。
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原NaClO3,可较安全地生成ClO2,反应的离子方程式为_______ 。
(2)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法做如下检测(已知ClO2存在于pH为4~6的溶液中,ClO 存在于中性溶液中):
存在于中性溶液中):
①取0.50 L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:_______ 。
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4 mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00 mL。该水样中ClO2的浓度是_______ mg·L-1。
(3)某学习小组设计如下装置制取亚氯酸钠(NaClO2)。
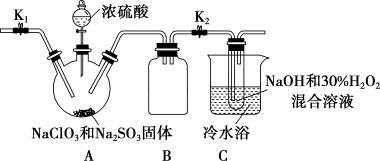
①装置A中产生的ClO2气体,在装置C中反应生成NaClO2,写出生成NaClO2的化学方程式:_______ 。
②将NaClO2溶液在一定条件下处理即可得到NaClO2晶体。装置B的作用是_______ 。
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原NaClO3,可较安全地生成ClO2,反应的离子方程式为
(2)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法做如下检测(已知ClO2存在于pH为4~6的溶液中,ClO
 存在于中性溶液中):
存在于中性溶液中):①取0.50 L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4 mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00 mL。该水样中ClO2的浓度是
(3)某学习小组设计如下装置制取亚氯酸钠(NaClO2)。

①装置A中产生的ClO2气体,在装置C中反应生成NaClO2,写出生成NaClO2的化学方程式:
②将NaClO2溶液在一定条件下处理即可得到NaClO2晶体。装置B的作用是
您最近一年使用:0次
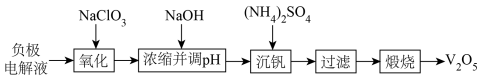
4 . 以废钒电池负极电解液(主要化学成分是V3+、V2+、H2SO4) 为原料,回收其中的钒制备V2O5的工艺流程如图所示:
回答下列问题:
(1)在“氧化”中低价态钒都转化为 ,其中V3+转化反应的离子方程式为
,其中V3+转化反应的离子方程式为___________ ,实际生产中的氧化剂不选择HClO3的原因是___________ 。
(2)“浓缩”至钒溶液质量浓度(折合V2O5质量浓度)为27.3 g·L-1'时,则溶液中c( )=
)=___________ mol·L-1。(结果保留1位小数)
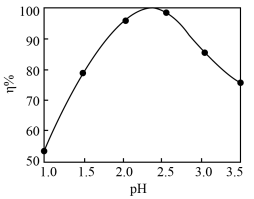
(3)pH对沉钒率(η)的影响如图所示,则沉钒时控制钒液合适的pH范围是___________ ,沉淀产物为2NH4V3O8·H2O,则加(NH4)2SO4沉钒的化学方程式是___________ 。___________ 。检验沉淀已洗涤干净的操作是___________ 。
(5)“煅烧”需要在通风或氧化气氛下进行,其目的是___________ 。
回答下列问题:
(1)在“氧化”中低价态钒都转化为
 ,其中V3+转化反应的离子方程式为
,其中V3+转化反应的离子方程式为(2)“浓缩”至钒溶液质量浓度(折合V2O5质量浓度)为27.3 g·L-1'时,则溶液中c(
 )=
)=(3)pH对沉钒率(η)的影响如图所示,则沉钒时控制钒液合适的pH范围是
(5)“煅烧”需要在通风或氧化气氛下进行,其目的是
您最近一年使用:0次
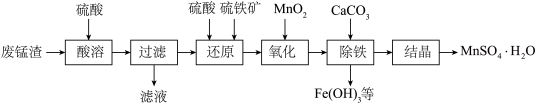
5 . 用废锰渣(主要成分为MnO2、MgO和Fe2O3)和硫铁矿(主要成分FeS2)制取MnSO4·H2O的工艺流程如下:___________ 。
(2)已知:室温下Ksp[Fe(OH)2]=4.9×10-17,Ksp[Fe(OH)3]=1×10-37.4,Ksp[Mn(OH)2]=2×10-13,“氧化”后溶液中c(Mn2+)=0.2mol·L-1。
①欲使溶液中c(Fe3+)<10-5mol·L-1,“除铁”过程需控制溶液pH的范围是___________ 。
②写出“除铁”过程中生成Fe(OH)3反应的化学方程式:___________ 。
(3)氧化后溶液的Fe3+还可用P204(一种有机萃取剂,密度比水小)萃取除去,实验装置如图所示,从图示装置中得到Mn2+水溶液的实验操作方法是___________ 。 ,过滤,洗涤,洗涤液并入滤液,加入0.4690gNa2C2O4固体,充分反应后,用0.0200mol·L-1KMnO4标准溶液滴定,用去标准溶液20.00mL,计算样品中MnSO4·H2O的质量分数
,过滤,洗涤,洗涤液并入滤液,加入0.4690gNa2C2O4固体,充分反应后,用0.0200mol·L-1KMnO4标准溶液滴定,用去标准溶液20.00mL,计算样品中MnSO4·H2O的质量分数___________ 。(写出详细计算过程)。
C2O 发生的反应为
发生的反应为 (未配平)。
(未配平)。
②若实验测定MnSO4·H2O样品的纯度大于100%,可能的原因是___________ (忽略操作过程中的误差)。
(2)已知:室温下Ksp[Fe(OH)2]=4.9×10-17,Ksp[Fe(OH)3]=1×10-37.4,Ksp[Mn(OH)2]=2×10-13,“氧化”后溶液中c(Mn2+)=0.2mol·L-1。
①欲使溶液中c(Fe3+)<10-5mol·L-1,“除铁”过程需控制溶液pH的范围是
②写出“除铁”过程中生成Fe(OH)3反应的化学方程式:
(3)氧化后溶液的Fe3+还可用P204(一种有机萃取剂,密度比水小)萃取除去,实验装置如图所示,从图示装置中得到Mn2+水溶液的实验操作方法是
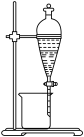
 ,过滤,洗涤,洗涤液并入滤液,加入0.4690gNa2C2O4固体,充分反应后,用0.0200mol·L-1KMnO4标准溶液滴定,用去标准溶液20.00mL,计算样品中MnSO4·H2O的质量分数
,过滤,洗涤,洗涤液并入滤液,加入0.4690gNa2C2O4固体,充分反应后,用0.0200mol·L-1KMnO4标准溶液滴定,用去标准溶液20.00mL,计算样品中MnSO4·H2O的质量分数C2O
 发生的反应为
发生的反应为 (未配平)。
(未配平)。②若实验测定MnSO4·H2O样品的纯度大于100%,可能的原因是
您最近一年使用:0次
2023-06-05更新
|
432次组卷
|
3卷引用:实验综合题
解题方法
6 . 氨氮已成为环境的主要污染物并引起了社会各界的关注,氨氮在水体中以 (pH>11)和
(pH>11)和 (pH<7)两种形式存在,开发经济、高效的除氛技术成为水污染治理的重点和热点。回答下列问题:
(pH<7)两种形式存在,开发经济、高效的除氛技术成为水污染治理的重点和热点。回答下列问题:
(1)生物脱氮法
通常包括生物硝化和生物反硝化两个阶段,反应流程如下:_______ 。
②反硝化阶段,在缺氧条件下,反硝化菌与有机碳源(醇、有机酸等)使 转化为
转化为 ,从而消除污染,则有机碳源的作用是
,从而消除污染,则有机碳源的作用是_______ 。
(2)汽提法
当废水中pH较高时(氨氮以 分子存在),利用水蒸气将其从水中吹出,消除污染。该操作一般在吹脱塔中进行,废水从吹脱塔的塔顶往下流,水蒸气从下面鼓入。用水蒸气吹出
分子存在),利用水蒸气将其从水中吹出,消除污染。该操作一般在吹脱塔中进行,废水从吹脱塔的塔顶往下流,水蒸气从下面鼓入。用水蒸气吹出 的原理是
的原理是_______ ;吹脱塔中进料方式的优点为_______ 。
(3)光催化降解法(最先进的方法)
该方法是指利用 作催化剂,在其获得能量后,释放出光电子(
作催化剂,在其获得能量后,释放出光电子(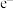 )和形成空穴(
)和形成空穴( ),空穴(
),空穴( )与
)与 产生活性很强的羟基自由基(·OH),将
产生活性很强的羟基自由基(·OH),将 转化为
转化为 ,光电子(
,光电子(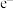 )再将
)再将 转化为
转化为 。反应机理用方程式简单表示如下:
。反应机理用方程式简单表示如下:
Ⅰ.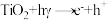
Ⅱ. _______
_______
Ⅲ.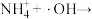
Ⅳ.
①反应机理“Ⅱ”空格中物质的化学式为_______ 。
②反应机理“Ⅲ、Ⅳ”中的离子方程式分别为_______ 、_______ 。
 (pH>11)和
(pH>11)和 (pH<7)两种形式存在,开发经济、高效的除氛技术成为水污染治理的重点和热点。回答下列问题:
(pH<7)两种形式存在,开发经济、高效的除氛技术成为水污染治理的重点和热点。回答下列问题:(1)生物脱氮法
通常包括生物硝化和生物反硝化两个阶段,反应流程如下:

②反硝化阶段,在缺氧条件下,反硝化菌与有机碳源(醇、有机酸等)使
 转化为
转化为 ,从而消除污染,则有机碳源的作用是
,从而消除污染,则有机碳源的作用是(2)汽提法
当废水中pH较高时(氨氮以
 分子存在),利用水蒸气将其从水中吹出,消除污染。该操作一般在吹脱塔中进行,废水从吹脱塔的塔顶往下流,水蒸气从下面鼓入。用水蒸气吹出
分子存在),利用水蒸气将其从水中吹出,消除污染。该操作一般在吹脱塔中进行,废水从吹脱塔的塔顶往下流,水蒸气从下面鼓入。用水蒸气吹出 的原理是
的原理是(3)光催化降解法(最先进的方法)
该方法是指利用
 作催化剂,在其获得能量后,释放出光电子(
作催化剂,在其获得能量后,释放出光电子(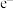 )和形成空穴(
)和形成空穴( ),空穴(
),空穴( )与
)与 产生活性很强的羟基自由基(·OH),将
产生活性很强的羟基自由基(·OH),将 转化为
转化为 ,光电子(
,光电子(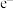 )再将
)再将 转化为
转化为 。反应机理用方程式简单表示如下:
。反应机理用方程式简单表示如下:Ⅰ.
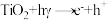
Ⅱ.
 _______
_______Ⅲ.
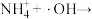
Ⅳ.

①反应机理“Ⅱ”空格中物质的化学式为
②反应机理“Ⅲ、Ⅳ”中的离子方程式分别为
您最近一年使用:0次
2022-09-29更新
|
530次组卷
|
6卷引用:江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(原理综合题)
(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(原理综合题)(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(反应原理-氧化还原反应)(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(原理综合题)河南省豫北名校普高联考2022-2023学年上学期高三测评(一)化学试题河南省重点高中2023届高三上学期9月联合考试化学试题江苏省徐州市睢宁县第一中学2023-2024学年高一下学期5月月考化学试卷
7 . 以废锌电池预处理物(主要成分为ZnO,另含少量 、CuO、
、CuO、 、MnO等)为原料可生产草酸锌晶体(
、MnO等)为原料可生产草酸锌晶体(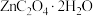 )、生产流程如下图所示。
)、生产流程如下图所示。 分别为
分别为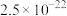 、
、 。
。
回答下列问题:
(1)“酸浸”后所得“滤渣A”的主要成分为_______ 。
(2)“除锰”时,反应的离子方程式为_______ 。
(3)“除铁”时,加入ZnO的目的是_______ 。
(4)“除铜”后要求溶液中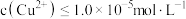 ,若溶液中
,若溶液中 浓度为
浓度为 ,试计算说明溶液能否达到要求:
,试计算说明溶液能否达到要求:_______ (要求写出计算过程)。
(5)“沉淀”后,需经过滤、洗涤、干燥系列操作分离出草酸锌晶体,检验沉淀是否洗净的操作为_______ 。
(6)在通风橱中,将草酸锌晶体置于陶瓷仪器_______ (填仪器名称)中加热分解可制得ZnO。已知一种ZnO晶体晶胞结构如下图所示,晶体密度为 ,NA表示阿伏加德罗常数的值,则该晶体中与
,NA表示阿伏加德罗常数的值,则该晶体中与 等距离且最近的
等距离且最近的 共有
共有_______ 个,相邻两个 之间的距离为
之间的距离为_______ nm。
 、CuO、
、CuO、 、MnO等)为原料可生产草酸锌晶体(
、MnO等)为原料可生产草酸锌晶体(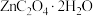 )、生产流程如下图所示。
)、生产流程如下图所示。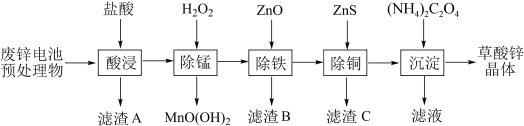
 分别为
分别为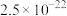 、
、 。
。回答下列问题:
(1)“酸浸”后所得“滤渣A”的主要成分为
(2)“除锰”时,反应的离子方程式为
(3)“除铁”时,加入ZnO的目的是
(4)“除铜”后要求溶液中
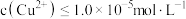 ,若溶液中
,若溶液中 浓度为
浓度为 ,试计算说明溶液能否达到要求:
,试计算说明溶液能否达到要求:(5)“沉淀”后,需经过滤、洗涤、干燥系列操作分离出草酸锌晶体,检验沉淀是否洗净的操作为
(6)在通风橱中,将草酸锌晶体置于陶瓷仪器
 ,NA表示阿伏加德罗常数的值,则该晶体中与
,NA表示阿伏加德罗常数的值,则该晶体中与 等距离且最近的
等距离且最近的 共有
共有 之间的距离为
之间的距离为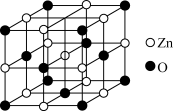
您最近一年使用:0次
2022-04-29更新
|
482次组卷
|
4卷引用:T16-工业流程题
名校
解题方法
8 . 零价铁还原性强、活性高,对很多重金属离子及含磷、砷离子都有较好的去除和富集作用。
Ⅰ.零价铁的制备。
(1)富铁矿石经破碎、筛分到微米级后,在氢气氛围下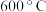 高温还原
高温还原 可以制备微米级零价铁。请写出磁铁矿与氢气反应制备零价铁的化学方程式
可以制备微米级零价铁。请写出磁铁矿与氢气反应制备零价铁的化学方程式_______ 。
(2)采用 还原铁盐,可以制备出纳米级的零价铁。
还原铁盐,可以制备出纳米级的零价铁。
已知: 的电负性是2.0,
的电负性是2.0, 的电负性是2.1
的电负性是2.1
①请写出 的电子式
的电子式_______ 。
②请写出 与硫酸反应的离子方程式
与硫酸反应的离子方程式_______ 。
③补充完整下列化学方程式_______ 。

每生成 零价铁
零价铁 ,转移电子的物质的量是
,转移电子的物质的量是_______  。
。
Ⅱ.零价铁的结构和作用机理。
研究发现,纳米级和微米级的零价铁,均具有“核-壳”结构。
已知:①壳层可以导电;
②当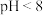 时,铁的氧化物质子化,壳层表面带正电;当
时,铁的氧化物质子化,壳层表面带正电;当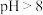 时,铁的氧化物去质子化,壳层表面带负电;
时,铁的氧化物去质子化,壳层表面带负电;
③磷酸盐溶解度一般较小。
(3)去离子水中加入零价铁, 从6上升到9.5左右。检测壳层物质,发现有
从6上升到9.5左右。检测壳层物质,发现有 、
、 、
、 、
、 等。导致产生壳层微粒的氧化剂是
等。导致产生壳层微粒的氧化剂是 、
、_______ 。
(4)部分金属阳离子去除机理如图所示。纳米零铁去除污水中 、
、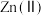 主要机理不同,请简述两者的区别并解释原因
主要机理不同,请简述两者的区别并解释原因_______ 。 )微粒:
)微粒:
①控制
_______ 8,原因是_______ 。
②通过形成_______ (填化学式)进一步去除 。
。
(6)综上所述,零价铁去除重金属离子及含磷微粒的主要机理有_______ 。
Ⅰ.零价铁的制备。
(1)富铁矿石经破碎、筛分到微米级后,在氢气氛围下
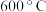 高温还原
高温还原 可以制备微米级零价铁。请写出磁铁矿与氢气反应制备零价铁的化学方程式
可以制备微米级零价铁。请写出磁铁矿与氢气反应制备零价铁的化学方程式(2)采用
 还原铁盐,可以制备出纳米级的零价铁。
还原铁盐,可以制备出纳米级的零价铁。已知:
 的电负性是2.0,
的电负性是2.0, 的电负性是2.1
的电负性是2.1①请写出
 的电子式
的电子式②请写出
 与硫酸反应的离子方程式
与硫酸反应的离子方程式③补充完整下列化学方程式

每生成
 零价铁
零价铁 ,转移电子的物质的量是
,转移电子的物质的量是 。
。Ⅱ.零价铁的结构和作用机理。
研究发现,纳米级和微米级的零价铁,均具有“核-壳”结构。
已知:①壳层可以导电;
②当
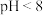 时,铁的氧化物质子化,壳层表面带正电;当
时,铁的氧化物质子化,壳层表面带正电;当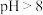 时,铁的氧化物去质子化,壳层表面带负电;
时,铁的氧化物去质子化,壳层表面带负电;③磷酸盐溶解度一般较小。
(3)去离子水中加入零价铁,
 从6上升到9.5左右。检测壳层物质,发现有
从6上升到9.5左右。检测壳层物质,发现有 、
、 、
、 、
、 等。导致产生壳层微粒的氧化剂是
等。导致产生壳层微粒的氧化剂是 、
、(4)部分金属阳离子去除机理如图所示。纳米零铁去除污水中
 、
、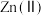 主要机理不同,请简述两者的区别并解释原因
主要机理不同,请简述两者的区别并解释原因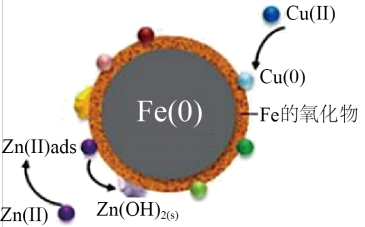
 )微粒:
)微粒:①控制

②通过形成
 。
。(6)综上所述,零价铁去除重金属离子及含磷微粒的主要机理有
您最近一年使用:0次
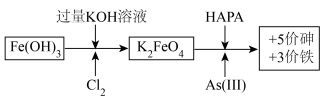
9 . 制备高铁酸钾[K2FeO4]并用其除去土壤和废水中的有机砷(HAPA)与无机砷[+3价砷表示As(Ⅲ)]的流程如图所示:
已知:酸性越强,K2FeO4越容易发生反应生成O2。
回答下列问题:
(1)生成K2FeO4的化学方程式为___ 。
(2)K2FeO4去除砷污染时作__ (填“氧化剂”或“还原剂”)。若污染物中的砷全部以Na3AsO3计,则去除全部污染时Na3AsO3与K2FeO4的物质的量之比为__ 。
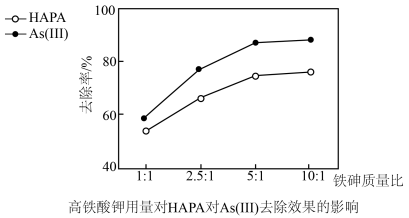
(3)氢离子浓度、高铁酸钾的用量对HAPA和As(Ⅲ)去除效果的影响如图所示。
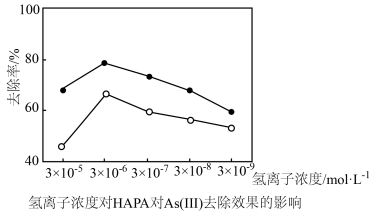
①氢离子浓度为3×10-5mol•L-1时去除率低,原因是(用离子方程式表示)__ 。
②最佳铁砷质量比为___ ,理由是__ 。

已知:酸性越强,K2FeO4越容易发生反应生成O2。
回答下列问题:
(1)生成K2FeO4的化学方程式为
(2)K2FeO4去除砷污染时作
(3)氢离子浓度、高铁酸钾的用量对HAPA和As(Ⅲ)去除效果的影响如图所示。


①氢离子浓度为3×10-5mol•L-1时去除率低,原因是(用离子方程式表示)
②最佳铁砷质量比为
您最近一年使用:0次
2021-01-28更新
|
723次组卷
|
4卷引用:解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)
(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练山东省潍坊市2020-2021学年高一上学期期末统考化学试题山东省高密市第一中学2023-2024学年高一上学期1月冬学竞赛化学试题
名校
10 . 据所学知识完成以下题目:
(1)在下列反应中,HCl做还原剂的是_______ ,HCl做氧化剂的是_______ 。
①CaCO3+2HCl=CaCl2+CO2↑+H2O
②Fe+2HCl=FeCl2+H2↑
③PbO2+4HCl(浓) PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
④KClO3+6HCl(浓) KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
⑤CuO+2HCl=CuCl2+H2O
(2)在横线上补充所需的离子或分子,并配平方程式,。
①KMnO4+HCl=KCl+MnCl2+Cl2↑+H2O,_______ 。
②Mn2++ +H2O=MnO2↓+Cl2↑+___ ,
+H2O=MnO2↓+Cl2↑+___ ,_______ 。
(3)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,_______ 。
(4)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C2O4+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是____ ;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂_____ mol,有_____ mol电子发生转移,相当于测出含钙元素的质量是_____ g。
(5)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:_____ 。
(1)在下列反应中,HCl做还原剂的是
①CaCO3+2HCl=CaCl2+CO2↑+H2O
②Fe+2HCl=FeCl2+H2↑
③PbO2+4HCl(浓)
 PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O④KClO3+6HCl(浓)
 KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O⑤CuO+2HCl=CuCl2+H2O
(2)在横线上补充所需的离子或分子,并配平方程式,。
①KMnO4+HCl=KCl+MnCl2+Cl2↑+H2O,
②Mn2++
 +H2O=MnO2↓+Cl2↑+___ ,
+H2O=MnO2↓+Cl2↑+___ ,(3)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,
(4)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C2O4+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是
(5)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
您最近一年使用:0次
2020-12-24更新
|
1712次组卷
|
5卷引用:解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)专题05 氧化还原反应(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练 福建省连城县第一中学2020-2021学年高一上学期第二次月考化学试题(已下线)第一章《物质及其变化》能力提升单元检测-【帮课堂】2022-2023学年高一化学必修第一册精品讲义(人教版2019)



