解题方法
1 . 硫代硫酸钠 是重要的化工原料,易溶于水。实验室中探究
是重要的化工原料,易溶于水。实验室中探究 与某些金属阳离子的氧化还原反应情况。
与某些金属阳离子的氧化还原反应情况。
资料:i.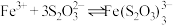 (紫黑色)
(紫黑色)  ;
;
ii. 为白色沉淀,
为白色沉淀,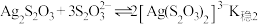 ;
;
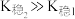 。
。
回答下列问题:
探究一
(1)根据实验①的现象,初步判断最终 被
被 还原为
还原为 ,通过
,通过_____ (填操作、试剂和现象),进一步证实生成了 。进一步实验证明
。进一步实验证明 最终被氧化为
最终被氧化为 ,该过程总反应的化学方程式为
,该过程总反应的化学方程式为_____ 。
(2)氧化性: (同浓度)。但实验②中
(同浓度)。但实验②中 未发生氧化还原反应的原因是
未发生氧化还原反应的原因是_____ 。
探究二
(3)实验③中黑色沉淀可能为 或
或 。通过
。通过_____ (填操作、试剂和现象),进一步证实生成了 。白色絮状沉淀变为黑色沉淀的化学方程式为
。白色絮状沉淀变为黑色沉淀的化学方程式为_____ 。
(4)将 溶液逐滴滴入
溶液逐滴滴入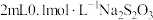 溶液中至过量,该过程可观察到的实验现象为
溶液中至过量,该过程可观察到的实验现象为_____ 。
 是重要的化工原料,易溶于水。实验室中探究
是重要的化工原料,易溶于水。实验室中探究 与某些金属阳离子的氧化还原反应情况。
与某些金属阳离子的氧化还原反应情况。资料:i.
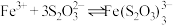 (紫黑色)
(紫黑色) 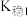 ;
;ii.
 为白色沉淀,
为白色沉淀,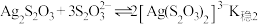 ;
;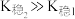 。
。回答下列问题:
探究一
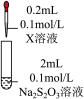
| 装置 | 编号 | 试剂X | 实验现象 |
| ① | 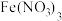 溶液 溶液 | 混合后溶液先变成紫黑色, 后溶液几乎变为无色 后溶液几乎变为无色 |
| ② |  溶液 溶液 | 一段时间后,生成白色沉淀,振荡后,沉淀溶解,得到无色溶液 |
 被
被 还原为
还原为 ,通过
,通过 。进一步实验证明
。进一步实验证明 最终被氧化为
最终被氧化为 ,该过程总反应的化学方程式为
,该过程总反应的化学方程式为(2)氧化性:
 (同浓度)。但实验②中
(同浓度)。但实验②中 未发生氧化还原反应的原因是
未发生氧化还原反应的原因是探究二
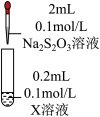
| 装置 | 编号 | 试剂X | 实验现象 |
| ③ |  溶液 溶液 | 立即生成白色絮状沉淀,沉淀很快变为黑色沉淀。 |
 或
或 。通过
。通过 。白色絮状沉淀变为黑色沉淀的化学方程式为
。白色絮状沉淀变为黑色沉淀的化学方程式为(4)将
 溶液逐滴滴入
溶液逐滴滴入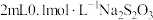 溶液中至过量,该过程可观察到的实验现象为
溶液中至过量,该过程可观察到的实验现象为
您最近一年使用:0次
2023-07-13更新
|
269次组卷
|
2卷引用:山东省潍坊市2022-2023学年高二下学期7月期末考试化学试题
名校
解题方法
2 . Ⅰ.为比较 和
和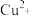 对
对 分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:___________ 的快慢,定性比较得出结论;
(2)定量分析。如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。
实验中需要测量的数据是___________ 。
(3)查阅资料得知:将作为催化剂的 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从
均参加了反应,试从催化剂的角度 分析,这两个氧化还原反应的离子方程式分别是: 和
和___________ 。
Ⅱ.某化学实验小组利用酸性 溶液与
溶液与 溶液反应研究影响反应速率的因素。实验过程中通过测定
溶液反应研究影响反应速率的因素。实验过程中通过测定 溶液褪色所需的时间来比较化学反应速率的大小。实验数据如下:
溶液褪色所需的时间来比较化学反应速率的大小。实验数据如下:
(4)实验中反应的离子方程式为___________ 。
(5)
___________ ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是___________ 。
(6)2号实验中,用 表示的反应速率为
表示的反应速率为___________ (反应后溶液的总体积变化忽略不计)。
 和
和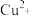 对
对 分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(2)定量分析。如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。
实验中需要测量的数据是
(3)查阅资料得知:将作为催化剂的
 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从
均参加了反应,试从 和
和Ⅱ.某化学实验小组利用酸性
 溶液与
溶液与 溶液反应研究影响反应速率的因素。实验过程中通过测定
溶液反应研究影响反应速率的因素。实验过程中通过测定 溶液褪色所需的时间来比较化学反应速率的大小。实验数据如下:
溶液褪色所需的时间来比较化学反应速率的大小。实验数据如下:| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | x |
  溶液/mL 溶液/mL | 5 | 10 | 10 | 5 |
  溶液/mL 溶液/mL | 5 | 5 | 10 | 10 |
| 时间/s | 20 | 10 | 5 | ― |
(5)

(6)2号实验中,用
 表示的反应速率为
表示的反应速率为
您最近一年使用:0次
2024-01-01更新
|
93次组卷
|
3卷引用:浙江省台州市路桥中学2023-2024学年高二上学期11月期中考试化学试题
3 . Ⅰ.已知下列物质均由短周期元素组成,X无论是盐酸还是氢氧化钠,转化均能进行,又已知C的相对分子质量比D少16,A、B、C、D、E中均含有同一元素。_______ 。
(2)当X是氢氧化钠溶液时,C的化学式_______ 。
(3)写出A和足量氢氧化钠在加热条件下反应的化学方程式_______ 。
Ⅱ.金属及其化合物用途广泛,研究金属的提取、冶炼意义重大。
(4)下列各组金属,冶炼方法一定不同的是_______ (填字母)。
a.Hg、Ag b.Na、Mg c.Al、Fe d.Na、Ca
(5)以铬铁矿(主要成分为FeO和 ,含有少量
,含有少量 、
、 等杂质)为主要原料生产化工原料重铬酸钠
等杂质)为主要原料生产化工原料重铬酸钠 并制取铬,其主要工艺流程如下:
并制取铬,其主要工艺流程如下: 氧化为
氧化为 。
。
①“操作②”是_______ 。
②工业上可用固体A制取粗硅,写出反应的化学方程式:_______ 。
③写出溶液D转化为溶液E过程中反应的离子方程式:_______ 。
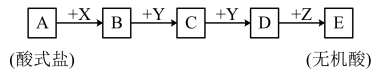
(2)当X是氢氧化钠溶液时,C的化学式
(3)写出A和足量氢氧化钠在加热条件下反应的化学方程式
Ⅱ.金属及其化合物用途广泛,研究金属的提取、冶炼意义重大。
(4)下列各组金属,冶炼方法一定不同的是
a.Hg、Ag b.Na、Mg c.Al、Fe d.Na、Ca
(5)以铬铁矿(主要成分为FeO和
 ,含有少量
,含有少量 、
、 等杂质)为主要原料生产化工原料重铬酸钠
等杂质)为主要原料生产化工原料重铬酸钠 并制取铬,其主要工艺流程如下:
并制取铬,其主要工艺流程如下: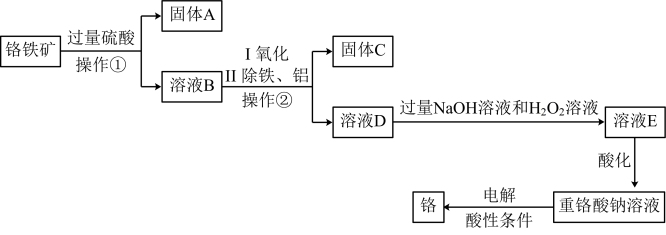
 氧化为
氧化为 。
。①“操作②”是
②工业上可用固体A制取粗硅,写出反应的化学方程式:
③写出溶液D转化为溶液E过程中反应的离子方程式:
您最近一年使用:0次
2022-07-19更新
|
483次组卷
|
4卷引用:河南省开封市杞县新世纪中学2022—2023学年高二上学期开学联考化学试题
河南省开封市杞县新世纪中学2022—2023学年高二上学期开学联考化学试题辽宁省协作校2021-2022学年高一下学期期末考试化学试题(已下线)专题06 化学与可持续发展-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)(已下线)暑假作业07 无机综合题、工艺流程题-【暑假分层作业】2024年高一化学暑假培优练(人教版2019必修第二册)
名校
4 . ⅤA族元素及其化合物应用广泛。  催化氧化生成
催化氧化生成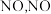 继续被氧化为
继续被氧化为 ,将
,将 通入水中制取
通入水中制取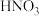 。工业上用白磷
。工业上用白磷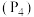 与
与 反应生成
反应生成 和一种盐,该盐可与
和一种盐,该盐可与 反应制备一元弱酸
反应制备一元弱酸 。雌黄
。雌黄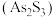 和
和 在盐酸中反应转化为雄黄
在盐酸中反应转化为雄黄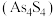 和
和 (沸点
(沸点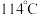 )并放出
)并放出 气体。砷化镓
气体。砷化镓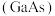 是第三代半导体材料,熔点高,硬度大。请回答下列小题。
是第三代半导体材料,熔点高,硬度大。请回答下列小题。
1.氨硼烷 是最具潜力的储氢材料之一,与乙烷的相对分子质量相近,但沸点却比乙烷高得多。下列说法
是最具潜力的储氢材料之一,与乙烷的相对分子质量相近,但沸点却比乙烷高得多。下列说法不正确 的是
2.下列化学反应表示不正确 的是
3.下列氮及其化合物的性质与用途具有对应关系的是
 催化氧化生成
催化氧化生成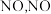 继续被氧化为
继续被氧化为 ,将
,将 通入水中制取
通入水中制取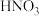 。工业上用白磷
。工业上用白磷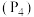 与
与 反应生成
反应生成 和一种盐,该盐可与
和一种盐,该盐可与 反应制备一元弱酸
反应制备一元弱酸 。雌黄
。雌黄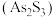 和
和 在盐酸中反应转化为雄黄
在盐酸中反应转化为雄黄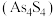 和
和 (沸点
(沸点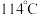 )并放出
)并放出 气体。砷化镓
气体。砷化镓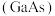 是第三代半导体材料,熔点高,硬度大。请回答下列小题。
是第三代半导体材料,熔点高,硬度大。请回答下列小题。1.氨硼烷
 是最具潜力的储氢材料之一,与乙烷的相对分子质量相近,但沸点却比乙烷高得多。下列说法
是最具潜力的储氢材料之一,与乙烷的相对分子质量相近,但沸点却比乙烷高得多。下列说法A.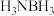 分子内存在配位键 分子内存在配位键 |
B. 是由极性键构成的极性分子 是由极性键构成的极性分子 |
C. 中含有 中含有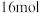 共价键 共价键 |
D.固态 和砷化镓晶体都是分子晶体 和砷化镓晶体都是分子晶体 |
A. 制 制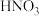 的离子方程式: 的离子方程式: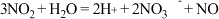 |
B.白磷与 溶液反应: 溶液反应: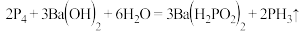 |
C. 与足量的 与足量的 溶液反应的离子方程式: 溶液反应的离子方程式: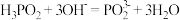 |
D.雌黄制备雄黄的方程式: |
A. 难溶于水,可用作瓜果保护气 难溶于水,可用作瓜果保护气 |
B. 具有还原性,可用作制冷剂 具有还原性,可用作制冷剂 |
C.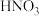 具有强氧化性,可用于制硝酸铵 具有强氧化性,可用于制硝酸铵 |
D. 溶液呈酸性,可用于除铁锈 溶液呈酸性,可用于除铁锈 |
您最近一年使用:0次
2024-08-17更新
|
57次组卷
|
2卷引用:江苏省南京市六校联合体2023-2024学年化学高二下学期期中考试试卷
名校
5 . 卤族元素单质及其化合物应用广泛。 能与大多数的金属单质、水或碱等很多物质反应,工业上常用
能与大多数的金属单质、水或碱等很多物质反应,工业上常用 制备
制备 :将足量的
:将足量的 与
与 加入到
加入到 中,生成
中,生成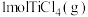 和
和 时放出
时放出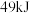 的热量。
的热量。 通入
通入 酸性溶液中可制得黄绿色气体
酸性溶液中可制得黄绿色气体 ,其与碱反应能生成
,其与碱反应能生成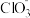 和
和 等。
等。 在常温下能与
在常温下能与 反应生成致密的氟化物薄膜,还能与熔融的
反应生成致密的氟化物薄膜,还能与熔融的 反应生成硫酰氟(
反应生成硫酰氟( )。
)。 与浓硫酸反应可制得氟化氢,常温下,测得氟化氢的相对分子质量约为37。请完成下列小题。
与浓硫酸反应可制得氟化氢,常温下,测得氟化氢的相对分子质量约为37。请完成下列小题。
1.下列说法不正确的是
2.下列化学反应表示不正确的是
3.下列物质性质与用途具有对应关系的是
 能与大多数的金属单质、水或碱等很多物质反应,工业上常用
能与大多数的金属单质、水或碱等很多物质反应,工业上常用 制备
制备 :将足量的
:将足量的 与
与 加入到
加入到 中,生成
中,生成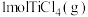 和
和 时放出
时放出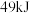 的热量。
的热量。 通入
通入 酸性溶液中可制得黄绿色气体
酸性溶液中可制得黄绿色气体 ,其与碱反应能生成
,其与碱反应能生成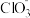 和
和 等。
等。 在常温下能与
在常温下能与 反应生成致密的氟化物薄膜,还能与熔融的
反应生成致密的氟化物薄膜,还能与熔融的 反应生成硫酰氟(
反应生成硫酰氟( )。
)。 与浓硫酸反应可制得氟化氢,常温下,测得氟化氢的相对分子质量约为37。请完成下列小题。
与浓硫酸反应可制得氟化氢,常温下,测得氟化氢的相对分子质量约为37。请完成下列小题。1.下列说法不正确的是
A.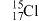 、 、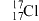 都属于氯元素 都属于氯元素 |
B.若有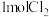 完全反应后得到的电子数一定为 完全反应后得到的电子数一定为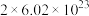 |
C. 与熔融 与熔融 反应时一定有氧元素化合价升高 反应时一定有氧元素化合价升高 |
D.常温下,氟化氢可能以 分子的形式存在 分子的形式存在 |
A.工业制备 : :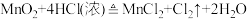 |
B.用 制备 制备 : :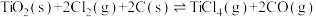 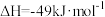 |
C.将 通入 通入 酸性溶液中制备 酸性溶液中制备 : :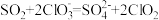 |
D. 与溶液反应生成 与溶液反应生成 和 和 : : |
A.铜单质化学性质不活泼,可用于制作储存 的容器 的容器 |
B. 呈黄绿色,可用于自来水消毒 呈黄绿色,可用于自来水消毒 |
C. 具有还原性,可用于与 具有还原性,可用于与 反应制 反应制 |
D.浓硫酸具有强氧化性,可用于与 反应制 反应制 |
您最近一年使用:0次
名校
解题方法
6 . 以红土镍镉矿(NiS、CdO,含 、CuO、PbO、
、CuO、PbO、 等杂质)为原料回收贵重金属Ni、Cd和Cu,其工艺流程如图所示:
等杂质)为原料回收贵重金属Ni、Cd和Cu,其工艺流程如图所示:
(1)“浆化”的目的是___________ 。
(2)滤渣Ⅰ中含有硫单质,写出“酸浸”时NiS反应的离子方程式___________ ;滤渣Ⅰ中还含有___________ 。(填化学式)
(3)溶液中金属离子开始沉淀和完全沉淀时(浓度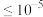 mol/L)的pH如下表,则物质X不可能是
mol/L)的pH如下表,则物质X不可能是___________ ;所调pH范围___________ 。
a. b.CuO c.
b.CuO c.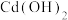 d.NaOH
d.NaOH
 、CuO、PbO、
、CuO、PbO、 等杂质)为原料回收贵重金属Ni、Cd和Cu,其工艺流程如图所示:
等杂质)为原料回收贵重金属Ni、Cd和Cu,其工艺流程如图所示: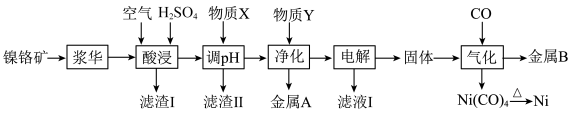
| 物质 | 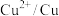 | 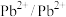 | 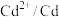 | 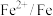 | 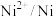 |
| E/V | +0.34 | -0.13 | -0.40 | -0.44 | -0.26 |
(1)“浆化”的目的是
(2)滤渣Ⅰ中含有硫单质,写出“酸浸”时NiS反应的离子方程式
(3)溶液中金属离子开始沉淀和完全沉淀时(浓度
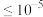 mol/L)的pH如下表,则物质X不可能是
mol/L)的pH如下表,则物质X不可能是a.
 b.CuO c.
b.CuO c.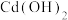 d.NaOH
d.NaOH| 离子 |  |  |  |  |  |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 | 4.7 | 6.8 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 | 6.7 | 9.2 |
您最近一年使用:0次
名校
7 . 磷的单质和化合物都是重要的化工产品。查阅资料可知:亚磷酸(H3PO3)、次磷酸(H3PO2)以及它们的盐都有较强的还原性,可用于化学镀银或镀镍。亚磷酸是中强酸,它与足量的NaOH溶液反应生成 Na2HPO3。试回答下列问题:
(1)Na2HPO3中P的化合价为____ 。
(2)Na2HPO3是____ (填“正盐”或“酸式盐”),其溶液的pH____ (填“>”、“=”或“<”)7。
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。镀镍溶液中含Ni2+和H2PO2-,在酸性条件下发生下述反应: Ni2++ H2PO2-+ = Ni+ H2PO3-+_____。
①请配平化学方程式___ 。
②依据化学方程式,反应消耗6 mol H2PO2-时,转移电子数为_____ 。
(1)Na2HPO3中P的化合价为
(2)Na2HPO3是
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。镀镍溶液中含Ni2+和H2PO2-,在酸性条件下发生下述反应: Ni2++ H2PO2-+ = Ni+ H2PO3-+_____。
①请配平化学方程式
②依据化学方程式,反应消耗6 mol H2PO2-时,转移电子数为
您最近一年使用:0次
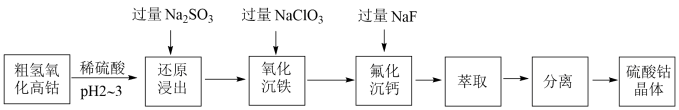
8 . 我国科学家用粗氢氧化高钴[主要含Co(OH)3]制备硫酸钴晶体(CoSO4•7H2O),其工艺流程如下。
ii.部分物质的溶度积常数如下(25℃)
iii. CoSO4·7H2O溶解度随温度升高而明显增大
(1)氢氧化高钴溶于硫酸的化学方程式是_______ 。
(2)还原浸出Co2+时,理论上氧化性离子和还原性离子物质的量之比为_______ 。
(3)氧化沉铁后,浊液中铁离子浓度为_______ mol/L(此时25℃,溶液pH为4)。
(4)结合平衡移动原理解释“氟化沉钙”步骤加入过量NaF的原因_______ 。
(5)萃取后,经反萃取得到硫酸钴溶液。将硫酸钴溶液经_______ 操作,分离后得到硫酸钴晶体。
(6)用滴定法测定硫酸钴晶体中钴的含量,其原理和操作如下。
在溶液中,用铁氰化钾将Co(Ⅱ)氧化为Co(Ⅲ),过量的铁氰化钾以Co(Ⅱ)标准液返滴定。反应的方程式为:Co2+ + [Fe(CN)6]3− = Co3+ + [Fe(CN)6]4−。
已知:铁氰化钾标准液浓度为c mol/L,Co(Ⅱ)标准液质量浓度为ρg/L。
取m g硫酸钴晶体,加水配成200 mL溶液,取20 mL待测液进行滴定,消耗V1 mL铁氰化钾标准液、V2 mL Co(Ⅱ)标准液。(Co的相对原子质量为59)
计算样品中钴含量ω=_______ (以钴的质量分数ω计)。
ii.部分物质的溶度积常数如下(25℃)
| 物质 | Ksp |
| CaF2 | 4.0×10−11 |
| Fe(OH)3 | 2.8×10−39 |
(1)氢氧化高钴溶于硫酸的化学方程式是
(2)还原浸出Co2+时,理论上氧化性离子和还原性离子物质的量之比为
(3)氧化沉铁后,浊液中铁离子浓度为
(4)结合平衡移动原理解释“氟化沉钙”步骤加入过量NaF的原因
(5)萃取后,经反萃取得到硫酸钴溶液。将硫酸钴溶液经
(6)用滴定法测定硫酸钴晶体中钴的含量,其原理和操作如下。
在溶液中,用铁氰化钾将Co(Ⅱ)氧化为Co(Ⅲ),过量的铁氰化钾以Co(Ⅱ)标准液返滴定。反应的方程式为:Co2+ + [Fe(CN)6]3− = Co3+ + [Fe(CN)6]4−。
已知:铁氰化钾标准液浓度为c mol/L,Co(Ⅱ)标准液质量浓度为ρg/L。
取m g硫酸钴晶体,加水配成200 mL溶液,取20 mL待测液进行滴定,消耗V1 mL铁氰化钾标准液、V2 mL Co(Ⅱ)标准液。(Co的相对原子质量为59)
计算样品中钴含量ω=
您最近一年使用:0次
名校
9 . 碳酸锰( )俗称“锰白”,在工业上广泛用作脱硫催化剂,瓷釉颜料。实验室以
)俗称“锰白”,在工业上广泛用作脱硫催化剂,瓷釉颜料。实验室以 为原料制备少量
为原料制备少量 并研究其性质,由
并研究其性质,由 制备
制备 的实验流程:
的实验流程:
已知: 难溶于水、乙醇,潮湿的
难溶于水、乙醇,潮湿的 易被空气氧化。
易被空气氧化。
请回答下列问题:________ 。
(2)在烧瓶中加入一定量的 固体,滴加硫酸酸化的
固体,滴加硫酸酸化的 溶液,其反应的离子方程式
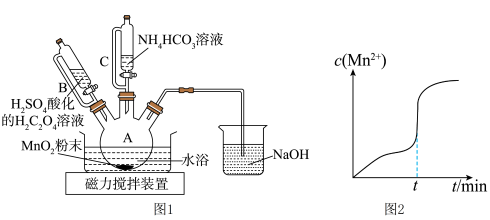
溶液,其反应的离子方程式________ ,反应过程中 随时间的变化曲线如图2所示,则tmin时,
随时间的变化曲线如图2所示,则tmin时, 迅速增大的原因是
迅速增大的原因是________ 。
(3)反应一段时间后,当装置A中的黑色固体消失时,再滴加较浓的 溶液充分反应生成
溶液充分反应生成 。生成
。生成 的化学方程式为
的化学方程式为________ 。
(4)实验结束后,将装置A中的混合物过滤,用________ 洗涤滤渣,再低温烘干,即得到干燥的 固体。
固体。
(5)已知 既具有氧化性也具有还原性,某同学用
既具有氧化性也具有还原性,某同学用 (一般用30%)溶液代替草酸,请问是否可行?原因是:
(一般用30%)溶液代替草酸,请问是否可行?原因是:________ 。
(6)EDTA与锰络合形成1:1的螫合物。称取mg样品,加入适量水,滴加盐酸溶液使样品溶解,加水定容至100ml。量取VmL,cmol/LEDTA标准溶液于锥形瓶中,加入3-4滴铬黑T指示剂以及10ml氨-氯化铵缓冲溶液,使体系的pH呈9-10。在酸式滴定管中加入50ml样品溶液,开始滴定,滴定终点为溶液由纯蓝色转变为紫红色,记录消耗的样品溶液体积19ml,计算出样品中锰的含量________ (写出表达式)
 )俗称“锰白”,在工业上广泛用作脱硫催化剂,瓷釉颜料。实验室以
)俗称“锰白”,在工业上广泛用作脱硫催化剂,瓷釉颜料。实验室以 为原料制备少量
为原料制备少量 并研究其性质,由
并研究其性质,由 制备
制备 的实验流程:
的实验流程: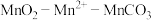
已知:
 难溶于水、乙醇,潮湿的
难溶于水、乙醇,潮湿的 易被空气氧化。
易被空气氧化。请回答下列问题:
(2)在烧瓶中加入一定量的
 固体,滴加硫酸酸化的
固体,滴加硫酸酸化的 溶液,其反应的离子方程式
溶液,其反应的离子方程式 随时间的变化曲线如图2所示,则tmin时,
随时间的变化曲线如图2所示,则tmin时, 迅速增大的原因是
迅速增大的原因是(3)反应一段时间后,当装置A中的黑色固体消失时,再滴加较浓的
 溶液充分反应生成
溶液充分反应生成 。生成
。生成 的化学方程式为
的化学方程式为(4)实验结束后,将装置A中的混合物过滤,用
 固体。
固体。(5)已知
 既具有氧化性也具有还原性,某同学用
既具有氧化性也具有还原性,某同学用 (一般用30%)溶液代替草酸,请问是否可行?原因是:
(一般用30%)溶液代替草酸,请问是否可行?原因是:(6)EDTA与锰络合形成1:1的螫合物。称取mg样品,加入适量水,滴加盐酸溶液使样品溶解,加水定容至100ml。量取VmL,cmol/LEDTA标准溶液于锥形瓶中,加入3-4滴铬黑T指示剂以及10ml氨-氯化铵缓冲溶液,使体系的pH呈9-10。在酸式滴定管中加入50ml样品溶液,开始滴定,滴定终点为溶液由纯蓝色转变为紫红色,记录消耗的样品溶液体积19ml,计算出样品中锰的含量
您最近一年使用:0次
2024-01-31更新
|
106次组卷
|
2卷引用:广西壮族自治区玉林市五校2022-2023学年高二下学期5月联考化学试题
名校
解题方法
10 . 活性氧化锌(ZnO)常用于医药、涂料、陶瓷等。某科研小组以锌废料(主要成分是ZnSO4和ZnO,含少量的Fe、Cu、Pb、As等元素以及油污)为原料制备活性氧化锌及回收其他金属元素,流程如图。 如下表:
如下表:
回答下列问题:
(1) 的原子结构示意图为
的原子结构示意图为 。
。 中铁的化合价为
中铁的化合价为_______ 。
(2)“浸取”中,适当加热能提高浸取速率,但是温度过高,浸取速率反而降低,其主要原因是_______ 。
(3)a的范围为_______ 。“除铁”的离子方程式为_______ 。
(4)金属M的化学式为_______ 。
(5)①“活性炭”表现的性质是_______ (填字母)。
A.氧化性 B.还原性 C.吸附性
②“沉锌”的滤液采用_______ 、_______ ,过滤、洗涤、干燥等一系列操作,得到铵态氮肥。
(6)“高温焙烧”过程中发生反应的化学方程式为_______ 。

 如下表:
如下表:| 金属离子 | 开始沉淀的 | 完全沉淀的 |
 | 1.5 | 3.7 |
 | 7.9 | 10.0 |
 | 6.3 | 9.7 |
 | 7.4 | 9.4 |
(1)
 的原子结构示意图为
的原子结构示意图为 。
。 中铁的化合价为
中铁的化合价为(2)“浸取”中,适当加热能提高浸取速率,但是温度过高,浸取速率反而降低,其主要原因是
(3)a的范围为
(4)金属M的化学式为
(5)①“活性炭”表现的性质是
A.氧化性 B.还原性 C.吸附性
②“沉锌”的滤液采用
(6)“高温焙烧”过程中发生反应的化学方程式为
您最近一年使用:0次
2023-09-06更新
|
87次组卷
|
3卷引用:江西省赣州中学2023-2024学年高二上学期开学考试化学试题