1 . 三氧化砷,俗称砒霜,分子式As2O3,是最具商业价值的砷化合物及主要的砷化学开始物料。它也是最古老的毒物之一,无臭无味,外观为白色霜状粉末,故称砒霜。
(1)完成并配平下列化学方程式:___ As2O3+___ Zn+___ H2SO4→___ AsH3+___ ZnSO4+___
(2)As2O3在上述反应中显示出来的性质是___ 。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.2molAsH3,则转移电子的物质的量为___ mol。
(4)砷化氢AsH3是一种很强的还原性,在室温下它能在空气中自然,其氧化产物是砒霜,写出该反应的化学方程式___ 。
(1)完成并配平下列化学方程式:
(2)As2O3在上述反应中显示出来的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.2molAsH3,则转移电子的物质的量为
(4)砷化氢AsH3是一种很强的还原性,在室温下它能在空气中自然,其氧化产物是砒霜,写出该反应的化学方程式
您最近一年使用:0次
2020-03-21更新
|
335次组卷
|
4卷引用:沪科版化学拓展性课程4《离子互换反应和氧化还原反应》测试题
沪科版化学拓展性课程4《离子互换反应和氧化还原反应》测试题2015届陕西省渭南市高三教学质量检测(一模)化学试卷上海市六校联考2015-2016学年高三上学期期中考试化学试题(已下线)专题35 磷、砷及其化合物-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
2022·北京·高考真题
2 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。
ⅱ、浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO 。
。
ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
(1)B中试剂是_____ 。
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_____ 。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_____ 。
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO 氧化为MnO
氧化为MnO 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_____ ,但通过实验测定溶液的碱性变化很小。
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填化学式)氧化,可证明实验Ⅲ的悬浊液中氧化剂过量。
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是_____ 。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_____ 。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO
 (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。ⅱ、浓碱条件下,MnO
 可被OH-还原为MnO
可被OH-还原为MnO 。
。ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
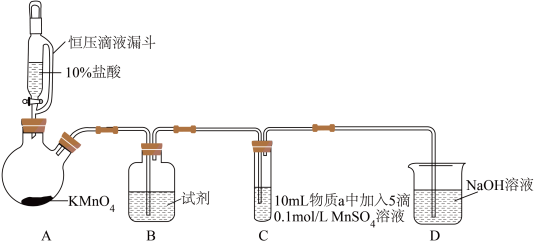
| 实验 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO
 氧化为MnO
氧化为MnO 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
2023-11-29更新
|
696次组卷
|
29卷引用:第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)
(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)2022年北京市高考真题化学试题(部分试题)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题2022年北京市高考真题化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)2022年北京高考真题变式题1-14(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)专题三 离子反应-实战高考·二轮复习核心突破突破超重点 高效突破综合实验 实验4 创新探究实验角度1控制变量法探究(已下线)2022年北京高考真题化学试题变式题(实验探究题)(已下线)题型46 实验原理探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)北京一零一中学2023-2024学年高三上学期11月统练五化学试题(已下线)微专题 物质性质综合实验探究北京市日坛中学2023-2024学年高三上学期10月检测化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题
3 . 向2 mL 1 mol/L淀粉KI溶液中通入SO2再加入1 mL 1mol/L盐酸,溶液迅速变黄,塞紧胶塞静置一段时间,溶液变成乳黄色。
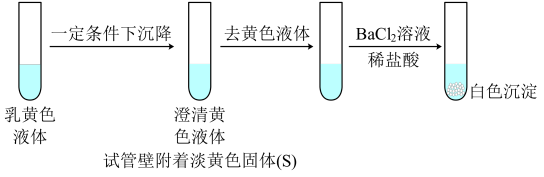
下列说法中不正确 的是
资料:SO2+4I-+4H+=S↓+2I2+2H2O

下列说法中
资料:SO2+4I-+4H+=S↓+2I2+2H2O
| A.整个反应过程中,KI可能起到了催化剂的作用 |
| B.该反应能够证明SO2既有氧化性又有还原性。 |
| C.改变c(H+)对反应速率没有影响 |
| D.结合实验现象可以证明SO2与I-的反应速率小于SO2与I2的反应 |
您最近一年使用:0次
2021-04-04更新
|
247次组卷
|
3卷引用:山西省天镇县实验中学2021-2022学年高二上学期期中考试化学试题
4 . Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色环保水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,应用广泛。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应氧化产物是_____ (填化学式)。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO−、OH−、FeO42-、Cl−、H2O。
①写出并配平碱性条件下湿法制高铁酸钾的离子反应方程式:________________________________ 。
②每生成1molFeO42-转移________ mol电子;若反应过程中转移了0.3mol电子,则还原产物的物质的量为________ mol。
Ⅱ.氧化还原反应在生产生活中应用广泛,思考回答以下问题
已知:2Fe3++2I−===2Fe2++I2,2Fe2++Br2===2Fe3++2Br−,2Fe2++Cl2===2Fe3++2Cl−
(1)含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是________ 。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,当Br−被氧化一半时,c为_______________ (用含a、b的代数式表示)。
(3)已知:S2O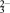 具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I−+S4O62-,S2O82-+2I−→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:
具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I−+S4O62-,S2O82-+2I−→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:____________ 。
(4)已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-;向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示。
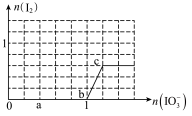
写出a点处还原产物是_______________ ;b点到c点反应的离子方程式________________
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应氧化产物是
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO−、OH−、FeO42-、Cl−、H2O。
①写出并配平碱性条件下湿法制高铁酸钾的离子反应方程式:
②每生成1molFeO42-转移
Ⅱ.氧化还原反应在生产生活中应用广泛,思考回答以下问题
已知:2Fe3++2I−===2Fe2++I2,2Fe2++Br2===2Fe3++2Br−,2Fe2++Cl2===2Fe3++2Cl−
(1)含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,当Br−被氧化一半时,c为
(3)已知:S2O
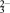 具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I−+S4O62-,S2O82-+2I−→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:
具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I−+S4O62-,S2O82-+2I−→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:(4)已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-;向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示。

写出a点处还原产物是
您最近一年使用:0次
2019-03-27更新
|
315次组卷
|
2卷引用:沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题2
名校
解题方法
5 . MnO2是重要化工原料,由软锰矿制备MnO2的一种工艺流程如下:

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
③该工艺条件下,MnO2与H2SO4不反应。
(1)溶出
①溶出前,软锰矿需研磨,目的是___________ 。
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:
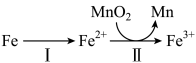
i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是___________ 。
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是___________ 。
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:___________ 。
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为___________ 。
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为___________ (用质量分数表示)。[已知:MnO2及 均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
| Fe3+ | A13+ | Mn2+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
(1)溶出
①溶出前,软锰矿需研磨,目的是
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:

i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为
 均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
您最近一年使用:0次
2023-12-15更新
|
175次组卷
|
3卷引用:江西省上饶市广丰一中2023-2024学年高二上学期12月考试化学试卷
名校
6 . 水中的溶解氧是水生生物生存不可缺少的条件。某课外小组设计如图所示的实验装置(夹持装置略),采用碘量法测定学校周边河水中的溶解氧的含量。
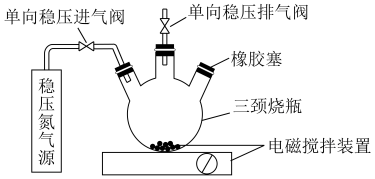
实验步骤及测定原理如下:
I.取样、氧的固定
a.用溶解氧瓶采集水样,记录大气压及水体温度。
b.向烧瓶中加入200mL水样。
c.向烧瓶中依次迅速加入1mL 无氧溶液(过量)和2mL碱性KI无氧溶液(过量)开启搅拌器,反应生成
无氧溶液(过量)和2mL碱性KI无氧溶液(过量)开启搅拌器,反应生成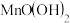 ,实现氧的固定。
,实现氧的固定。
II.酸化、滴定
d.搅拌,并向烧瓶中加入2mL硫酸无氧溶液至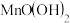 被
被 还原为
还原为 ,溶液为中性或弱酸性。
,溶液为中性或弱酸性。
e.在暗处静置5min后,取一定量溶液,用 标准溶液滴定生成的
标准溶液滴定生成的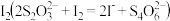 ,记录数据。
,记录数据。
f.重复e中滴定操作2~3次。
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)配制以上无氧溶液时,除去所用溶剂水中的氧气的简单操作为___________ 。
(2)取水样时应尽量避免扰动水体表面,这样操作的主要目的是___________ 。
(3)“氧的固定”中发生主要反应的化学方程式为___________ 。
(4)“步骤e”中,用a
 标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为
标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为______________ ;若200mL水样经处理后,共消耗 标准溶液的体积为b mL,则水样中溶解氧的含量为
标准溶液的体积为b mL,则水样中溶解氧的含量为___________ (用含字母的式子表示) 。
。

实验步骤及测定原理如下:
I.取样、氧的固定
a.用溶解氧瓶采集水样,记录大气压及水体温度。
b.向烧瓶中加入200mL水样。
c.向烧瓶中依次迅速加入1mL
 无氧溶液(过量)和2mL碱性KI无氧溶液(过量)开启搅拌器,反应生成
无氧溶液(过量)和2mL碱性KI无氧溶液(过量)开启搅拌器,反应生成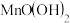 ,实现氧的固定。
,实现氧的固定。II.酸化、滴定
d.搅拌,并向烧瓶中加入2mL硫酸无氧溶液至
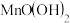 被
被 还原为
还原为 ,溶液为中性或弱酸性。
,溶液为中性或弱酸性。e.在暗处静置5min后,取一定量溶液,用
 标准溶液滴定生成的
标准溶液滴定生成的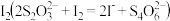 ,记录数据。
,记录数据。f.重复e中滴定操作2~3次。
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)配制以上无氧溶液时,除去所用溶剂水中的氧气的简单操作为
(2)取水样时应尽量避免扰动水体表面,这样操作的主要目的是
(3)“氧的固定”中发生主要反应的化学方程式为
(4)“步骤e”中,用a

 标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为
标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为 标准溶液的体积为b mL,则水样中溶解氧的含量为
标准溶液的体积为b mL,则水样中溶解氧的含量为 。
。
您最近一年使用:0次
名校
7 . 向红色CrO3固体表面喷洒酒精,会剧烈反应,生成绿色固体Cr2O3,同时闻到有刺激性气味乙醛生成。下列判断错误的是( )
| A.该反应说明乙醛既有氧化性又有还原性 |
| B.若有1 mol乙醇参加反应,转移电子的物质的量为2 mol |
| C.由此反应可知,酒精严禁与强氧化性试剂混合存放 |
| D.上述反应的化学方程式为2CrO3+3C2H5OH=Cr2O3+3CH3CHO+3H2O |
您最近一年使用:0次
2019-03-26更新
|
428次组卷
|
4卷引用:湖南省邵东县第一中学2019-2020学年高二下学期第三次月考化学试题
湖南省邵东县第一中学2019-2020学年高二下学期第三次月考化学试题【市级联考】河南省郑州市2019届高三下学期一模化学试题(已下线)专题04 氧化还原反应——2019年高考真题和模拟题化学分项汇编(已下线)第二章 元素与物质世界(能力提升)-2020-2021学年高一化学必修第一册单元测试定心卷 (鲁科版2019)
名校
8 . 亚硝酸钠( )外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量有严格要求。已知:亚硝酸钠易被氧化成硝酸钠。欲测定某样品中
)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量有严格要求。已知:亚硝酸钠易被氧化成硝酸钠。欲测定某样品中 的含量,某同学设计了如下实验。
的含量,某同学设计了如下实验。
①称取样品10.00g,加水溶解,配制成100mL溶液。
②取25.00mL溶液于锥形瓶中,用 标准溶液(酸性)进行滴定,记录滴定结束后消耗
标准溶液(酸性)进行滴定,记录滴定结束后消耗 溶液的体积,重复滴定3次。实验记录的数据如表:
溶液的体积,重复滴定3次。实验记录的数据如表:
(1)上述实验①所需玻璃仪器除烧杯、玻璃棒、胶头滴管之外还有___________ 。
(2)在进行滴定操作时, 溶液应盛装在
溶液应盛装在___________ (填“酸式”或“碱式”)滴定管中。当滴入最后半滴 溶液时,
溶液时,___________ ,说明达到滴定终点。
(3)酸性高锰酸钾溶液与亚硝酸钠反应的离子方程式:___________ 。实验测得该样品中 的质量分数为
的质量分数为___________ (精确到小数点后两位)。
(4)以下操作会造成测定结果偏低的是___________ (填字母)。
a.滴定管未用 标准溶液润洗
标准溶液润洗
b.锥形瓶未用待测液润洗
c.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
d. 标准溶液滴定前仰视读数,滴定终点时俯视读数
标准溶液滴定前仰视读数,滴定终点时俯视读数
e.滴定过程中刚出现颜色变化就立即停止滴定
 )外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量有严格要求。已知:亚硝酸钠易被氧化成硝酸钠。欲测定某样品中
)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量有严格要求。已知:亚硝酸钠易被氧化成硝酸钠。欲测定某样品中 的含量,某同学设计了如下实验。
的含量,某同学设计了如下实验。①称取样品10.00g,加水溶解,配制成100mL溶液。
②取25.00mL溶液于锥形瓶中,用
 标准溶液(酸性)进行滴定,记录滴定结束后消耗
标准溶液(酸性)进行滴定,记录滴定结束后消耗 溶液的体积,重复滴定3次。实验记录的数据如表:
溶液的体积,重复滴定3次。实验记录的数据如表:| 滴定次数 | 1 | 2 | 3 |
| 开始读数(mL) | 0.10 | 1.85 | 0.00 |
| 结束读数(mL) | 19.95 | 22.00 | 22.00 |
(2)在进行滴定操作时,
 溶液应盛装在
溶液应盛装在 溶液时,
溶液时,(3)酸性高锰酸钾溶液与亚硝酸钠反应的离子方程式:
 的质量分数为
的质量分数为(4)以下操作会造成测定结果偏低的是
a.滴定管未用
 标准溶液润洗
标准溶液润洗b.锥形瓶未用待测液润洗
c.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
d.
 标准溶液滴定前仰视读数,滴定终点时俯视读数
标准溶液滴定前仰视读数,滴定终点时俯视读数e.滴定过程中刚出现颜色变化就立即停止滴定
您最近一年使用:0次
19-20高三·江苏苏州·期末
名校
9 . 铁及其化合物在处理工业废水、废气过程中发挥着重要作用。
(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为_______ ;电解过程中阴极区溶液的pH_______ (填“变大”、 “变小”或“不变")。
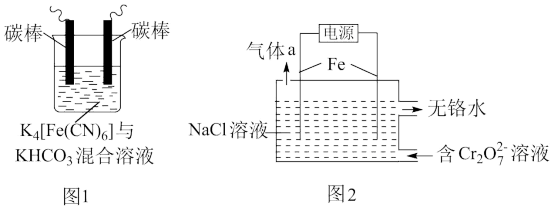
(2)以铁为电极电解除铬,如图2
已知: + H2O=2
+ H2O=2 +2H+
+2H+
氧化性: >
>
①电解过程中主要反应之一: +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是_______ 。
②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是_______ 。
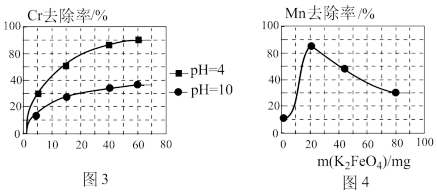
(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式_______ 。
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是_______ 。

(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2
 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为(2)以铁为电极电解除铬,如图2
已知:
 + H2O=2
+ H2O=2 +2H+
+2H+氧化性:
 >
>
①电解过程中主要反应之一:
 +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是

(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是
您最近一年使用:0次
2021-03-25更新
|
449次组卷
|
5卷引用:2.3.1 浓度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)
(已下线)2.3.1 浓度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)湖北省武汉市蔡甸区汉阳一中2021-2022学年高二上学期12月月考化学试题湖北省武汉市部分重点中学2021-2022学年高二上学期12月联考化学试题江苏省常州市第一中学2023-2024学年高二上学期11月期中考试化学试题(已下线)【苏州新东方】化学试卷
解题方法
10 . 稀土是一种重要的战略资源。氟碳铈矿的主要化学成分为 ,它是提取铈(
,它是提取铈( )等稀土元素的重要矿物原料。常温下,氟碳铈矿的冶炼工艺流程如下:
)等稀土元素的重要矿物原料。常温下,氟碳铈矿的冶炼工艺流程如下:
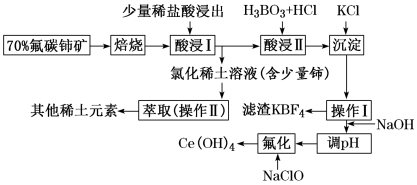
已知:ⅰ. 元素的常见化合价为
元素的常见化合价为 、
、 。焙烧后
。焙烧后 元素转化成
元素转化成 和
和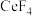 。
。 价的
价的 元素不易进入溶液,而
元素不易进入溶液,而 价稀土元素易进入溶液。
价稀土元素易进入溶液。
ⅱ.酸浸Ⅱ中发生反应: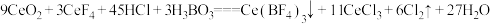 。
。
请回答下列问题:
(1)①焙烧氟碳铈矿的目的是____________ 。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生反应CeO2 CeO2(1-x)+xO2↑(0≤x≤0.25)。写出CeO2消除CO尾气的化学方程式:
CeO2(1-x)+xO2↑(0≤x≤0.25)。写出CeO2消除CO尾气的化学方程式:______________ 。
(2)在酸浸Ⅰ中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体,该反应的离子方程式是______ 。
(3)操作Ⅰ的名称为________ ,在实验室中进行操作Ⅱ时所需要的玻璃仪器有__________ 。
(4)操作Ⅰ后,向溶液中加入 溶液来调节溶液的pH,以获得
溶液来调节溶液的pH,以获得 沉淀,常温下加入
沉淀,常温下加入 溶液调节溶液的
溶液调节溶液的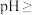
________ 即可认为 已完全沉淀。(已知:常温下,
已完全沉淀。(已知:常温下,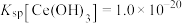 )
)
(5)取上述流程中得到的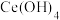 产品
产品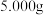 ,加酸溶解后,向其中加入含
,加酸溶解后,向其中加入含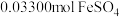 的
的 溶液使
溶液使 全部被还原成
全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点时,消耗
标准溶液滴定至终点时,消耗 标准溶液。则该产品中
标准溶液。则该产品中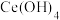 的质量分数为
的质量分数为______ [已知氧化性: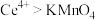 ;
;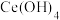 的相对分子质量为208]。
的相对分子质量为208]。
 ,它是提取铈(
,它是提取铈( )等稀土元素的重要矿物原料。常温下,氟碳铈矿的冶炼工艺流程如下:
)等稀土元素的重要矿物原料。常温下,氟碳铈矿的冶炼工艺流程如下:
已知:ⅰ.
 元素的常见化合价为
元素的常见化合价为 、
、 。焙烧后
。焙烧后 元素转化成
元素转化成 和
和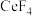 。
。 价的
价的 元素不易进入溶液,而
元素不易进入溶液,而 价稀土元素易进入溶液。
价稀土元素易进入溶液。ⅱ.酸浸Ⅱ中发生反应:
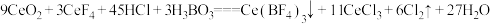 。
。请回答下列问题:
(1)①焙烧氟碳铈矿的目的是
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生反应CeO2
 CeO2(1-x)+xO2↑(0≤x≤0.25)。写出CeO2消除CO尾气的化学方程式:
CeO2(1-x)+xO2↑(0≤x≤0.25)。写出CeO2消除CO尾气的化学方程式:(2)在酸浸Ⅰ中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体,该反应的离子方程式是
(3)操作Ⅰ的名称为
(4)操作Ⅰ后,向溶液中加入
 溶液来调节溶液的pH,以获得
溶液来调节溶液的pH,以获得 沉淀,常温下加入
沉淀,常温下加入 溶液调节溶液的
溶液调节溶液的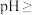
 已完全沉淀。(已知:常温下,
已完全沉淀。(已知:常温下,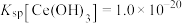 )
)(5)取上述流程中得到的
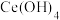 产品
产品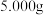 ,加酸溶解后,向其中加入含
,加酸溶解后,向其中加入含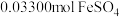 的
的 溶液使
溶液使 全部被还原成
全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点时,消耗
标准溶液滴定至终点时,消耗 标准溶液。则该产品中
标准溶液。则该产品中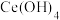 的质量分数为
的质量分数为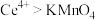 ;
;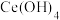 的相对分子质量为208]。
的相对分子质量为208]。
您最近一年使用:0次
2020-10-13更新
|
405次组卷
|
2卷引用:人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 过模拟 2年模拟精编精练



