解题方法
1 . I、焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛,回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得,写出该过程的化学方程式______________________________ 。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:

①pH=4.1时,Ⅰ中为__________ 溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是__________ 。
(3)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000 mol·L-1的碘标准液滴定至终点,消耗10.00 mL,滴定反应的离子方程式为_____________ ,该样品中Na2S2O5的残留量为____________ g·L-1(以SO2计)。
(4)II、高铁酸钾是一种新型、高效、多功能水处理剂。某学习小组设计如下方案制备高铁酸钾:

(4)①高铁酸钾中铁元素的化合价为________ 。
②其中第一步操作是:在NaClO溶液中加入烧碱固体形成强碱性环境,将研磨过的硝酸铁少量多次地加入上述溶液中,冰水浴中反应1 h,发生的离子反应如下:________________________________________________________________ ,完成并配平上述反应的化学方程式。
(5)高铁酸钾和水发生反应,生成物能吸附杂质净水,同时还产生气体,写出反应的离子方程式:_________________ 。
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得,写出该过程的化学方程式
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:

①pH=4.1时,Ⅰ中为
②工艺中加入Na2CO3固体、并再次充入SO2的目的是
(3)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000 mol·L-1的碘标准液滴定至终点,消耗10.00 mL,滴定反应的离子方程式为
(4)II、高铁酸钾是一种新型、高效、多功能水处理剂。某学习小组设计如下方案制备高铁酸钾:

(4)①高铁酸钾中铁元素的化合价为
②其中第一步操作是:在NaClO溶液中加入烧碱固体形成强碱性环境,将研磨过的硝酸铁少量多次地加入上述溶液中,冰水浴中反应1 h,发生的离子反应如下:
(5)高铁酸钾和水发生反应,生成物能吸附杂质净水,同时还产生气体,写出反应的离子方程式:
您最近一年使用:0次
名校
2 . 已知:还原性HSO3—>I—,氧化性IO3—>I2。在含3molNaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如下图所示。下列说法不正确的是


| A.0~a间发生反应:3HSO3—+IO3—=3SO42-+I—+3H+ |
| B.a~b间共消耗NaHSO3的物质的量为1.8mol |
| C.b~c间反应:I2仅是氧化产物 |
| D.当溶液中I-与I2的物质的量之比为5∶3时,加入的KIO3为1.1mol |
您最近一年使用:0次
2018-09-04更新
|
195次组卷
|
2卷引用:【全国百强校】黑龙江省哈尔滨师范大学附属中学2019届高三上学期开学考试化学试题
名校
3 . 某同学为探究酸性KMnO4溶液和H2C2O4(草酸,二元弱酸)溶液的反应过程,进行如下实验。请完成以下问题。
(1)写出酸性KMnO4溶液和H2C2O4的离子方程式____________________________ 。
(2)配制100mL0.0400mol·L-1的H2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是__________________ 。
(3)将KMnO4溶液逐滴滴入一定体积的酸性H2C2O4溶液中(温度相同,并振荡),记录的现象如下:
请分析KMnO4溶液褪色时间变化的可能原因_________________ 。
(1)写出酸性KMnO4溶液和H2C2O4的离子方程式
(2)配制100mL0.0400mol·L-1的H2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是
(3)将KMnO4溶液逐滴滴入一定体积的酸性H2C2O4溶液中(温度相同,并振荡),记录的现象如下:
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60s |
| 褪色后,再滴入第2滴 | 15s |
| 褪色后,再滴入第3滴 | 3s |
| 褪色后,再滴入第4滴 | 1s |
您最近一年使用:0次
2018-07-13更新
|
204次组卷
|
2卷引用:【全国百强校】黑龙江省鹤岗市第一中学2018-2019学年高二上学期开学考试(8月月考)化学试题
名校
解题方法
4 . 某课题组以硫铁矿烧渣(含 Fe2O3、 Fe3O4、 Al2O3、 CaO、 SiO2 等)为原料制取软磁用 Fe2O3(要求纯度>99.2%, CaO 含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):

已知:生成氢氧化物的 pH 如下表所示

(1)滤渣 A 的主要成分是__________ 。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________ 。
(3)在过程Ⅱ中,课题组对滤液 A 稀释不同倍数后,加入等质量的过量铁粉,得出 Fe3+浓度、还原率和反应时间的关系如图所示:结合上述实验结果说明:课题组选择稀释后c(Fe3+)为 1.60mol/L 左右的理由是______ 。

(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:(已知:滤液 B 中钙的含量以 CaO 计为 290—310mg/L)
根据实验结果, 选择适宜的沉钙剂,得到滤渣 C 的主要成分有__________ 。
(5)在过程Ⅳ中,反应温度需要控制在 35℃以下,不宜过高,其可能的原因是__________ 。
(6)在过程Ⅴ中,反应的化学方程式是__________ 。

已知:生成氢氧化物的 pH 如下表所示

(1)滤渣 A 的主要成分是
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有
(3)在过程Ⅱ中,课题组对滤液 A 稀释不同倍数后,加入等质量的过量铁粉,得出 Fe3+浓度、还原率和反应时间的关系如图所示:结合上述实验结果说明:课题组选择稀释后c(Fe3+)为 1.60mol/L 左右的理由是

(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:(已知:滤液 B 中钙的含量以 CaO 计为 290—310mg/L)
| 沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
| 用量/g | 2 | 2 | 2 | 5 | 2 |
| 剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果, 选择适宜的沉钙剂,得到滤渣 C 的主要成分有
(5)在过程Ⅳ中,反应温度需要控制在 35℃以下,不宜过高,其可能的原因是
(6)在过程Ⅴ中,反应的化学方程式是
您最近一年使用:0次
2018-05-17更新
|
803次组卷
|
4卷引用:【全国百强校】黑龙江省牡丹江市第一高级中学2019届高三上学期开学摸底考试化学试题1
名校
5 . 根据要求完成下列问题
(1)单质铝和氢氧化钠溶液反应的化学方程式_________________ ,本反应中的氧化剂是______
(2)实验室用二氧化锰和浓盐酸制取氯气的离子方程式___________________________________ ,本反应中的氧化剂和还原剂的物质的量比为____________
(3)二氧化硫和氯气按等物质的量通入足量水中的化学方程式_______________ ,本反应中若有1mol氧化剂参加反应则转移电子数为_________
(4)硫氰化钾溶液检验三价铁离子的离子方程式:______________ ,本反应的现象__________
(1)单质铝和氢氧化钠溶液反应的化学方程式
(2)实验室用二氧化锰和浓盐酸制取氯气的离子方程式
(3)二氧化硫和氯气按等物质的量通入足量水中的化学方程式
(4)硫氰化钾溶液检验三价铁离子的离子方程式:
您最近一年使用:0次
名校
6 . 中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如下图所示。

(1)根据上图信息可以看出,下列哪种气体污染物不是 由机动车行驶造成的_______________ 。
a.SO2 b.NOx c.VOCs d. NH3
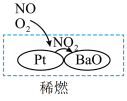
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式_______________ 。
(3)科学家经过研究发现中国霾呈中性,其主要原因如下图所示:

请判断A的化学式并说明判断理由:_____________________________________________ 。
(4)煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如下(其他离子忽略不计):
①SO2和NaClO2溶液反应的离子方程式是________________________________________ 。
②表中y =_______________ 。

(1)根据上图信息可以看出,下列哪种气体污染物
a.SO2 b.NOx c.VOCs d. NH3
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式

(3)科学家经过研究发现中国霾呈中性,其主要原因如下图所示:

请判断A的化学式并说明判断理由:
(4)煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如下(其他离子忽略不计):
| 离子 | Na+ | SO42− | NO3− | H+ | Cl− |
| 浓度/(mol·L−1) | 5.5×10−3 | 8.5×10−4 | y | 2.0×10−4 | 3.4×10−3 |
②表中y =
您最近一年使用:0次
2018-03-13更新
|
227次组卷
|
2卷引用:黑龙江省大庆实验中学2017-2018学年高一下学期开学考试化学试题
名校
7 . ClO2是一种常用的气体消毒剂,能净化有毒废水中的NaCN (已知NaCN中N的化合价为-3),发生的反应为:2ClO2+2NaCN=2NaCl+2CO2+N2,下列说法正确的是
| A.反应中氯元素被氧化 |
| B.NaCN既是氧化剂又是还原剂 |
| C.生成0.1 mol N2,转移1mol电子 |
| D.氧化产物与还原产物的物质的量之比为1:1 |
您最近一年使用:0次
2018-01-13更新
|
428次组卷
|
8卷引用:黑龙江省哈尔滨市哈尔滨师范大学附属中学2021-2022学年高一下学期开学考试化学试题
名校
8 . 利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;
②沉淀I中只含有两种沉淀;
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中Co2O3发生反应的离子反应方程式为___________ 。
(2)NaClO3在浸出液中发生的离子反应方程式为_________________ 。
(3)加入Na2CO3调PH至5.2,目的是__________________________ ;萃取剂层含锰元素,则沉淀II的主要成分为_____________ 。
(4)操作I包括:将水层加入浓盐酸调整PH为2-3,___________ 、____________ 、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是____________________ (回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表.
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为__ 。
[已知: CoC2O4·2H2O的摩尔质量为183g·mol-1]

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;
②沉淀I中只含有两种沉淀;
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为
(2)NaClO3在浸出液中发生的离子反应方程式为
(3)加入Na2CO3调PH至5.2,目的是
(4)操作I包括:将水层加入浓盐酸调整PH为2-3,
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表.
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为
[已知: CoC2O4·2H2O的摩尔质量为183g·mol-1]
您最近一年使用:0次
2017-09-06更新
|
321次组卷
|
3卷引用:黑龙江省牡丹江市第一高级中学2020届高三上学期开学检测化学试题
名校
解题方法
9 . 某兴趣活动小组通过实验研究Na2O2与水的反应。
(1)Na2O2与水反应的化学方程式:_______________________________ 。
(2)ii中溶液褪色可能是溶液a中存在较多的H2O2与酚酞发生了反应。
I.甲同学通过实验证实了H2O2的存在:取少量溶液a,加入试剂___________ (填化学式),有气体产生。
II.乙同学查阅资料获悉:用KMnO4可以测定H2O2的含量:取15.mL溶液a,用稀H2SO4酸化,逐滴加入0.003 mol/L KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗20.00mLKMnO4溶液。
①请配平:_ MnO4-+_ H2O2+_ ____ ===_ Mn2++_ O2↑+_ H2O
②溶液a中 c(H2O2)=_____ mol·L-1。
③溶液褪色速率开始较慢后变快的原因可能是__________________________ 。
(3)为探究现象ii产生的原因,同学们继续进行了如下实验:
iii.向H2O2溶液中滴入两滴酚酞,振荡,加入5滴0.1 mol·L-1NaOH溶液,溶液变红又迅速变无色且产生气体,10分钟后溶液变无色。
IV.向0.l mol·L-1NaOH溶液中滴入两滴酚酞,振荡,溶液变红,10分钟后溶液颜色无明显变化;向该溶液中通入O2,溶液颜色无明显变化。
①从实验III和IV中,可得出的结论是_________________________ 。
| 操作 | 现象 |
| 向盛有4g Na2O2的烧杯中加入50mL蒸馏水得到溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
| 取5mL溶液a于试管中,滴入两滴酚酞 | i.溶液变红 ii.10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
(2)ii中溶液褪色可能是溶液a中存在较多的H2O2与酚酞发生了反应。
I.甲同学通过实验证实了H2O2的存在:取少量溶液a,加入试剂
II.乙同学查阅资料获悉:用KMnO4可以测定H2O2的含量:取15.mL溶液a,用稀H2SO4酸化,逐滴加入0.003 mol/L KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗20.00mLKMnO4溶液。
①请配平:
②溶液a中 c(H2O2)=
③溶液褪色速率开始较慢后变快的原因可能是
(3)为探究现象ii产生的原因,同学们继续进行了如下实验:
iii.向H2O2溶液中滴入两滴酚酞,振荡,加入5滴0.1 mol·L-1NaOH溶液,溶液变红又迅速变无色且产生气体,10分钟后溶液变无色。
IV.向0.l mol·L-1NaOH溶液中滴入两滴酚酞,振荡,溶液变红,10分钟后溶液颜色无明显变化;向该溶液中通入O2,溶液颜色无明显变化。
①从实验III和IV中,可得出的结论是
您最近一年使用:0次
名校
10 . 制备新型高效水处理剂高铁酸钠(Na2FeO4)的主要反应为:2FeSO4+aNa2O2=2Na2FeO4+2Na2O+2Na2SO4+bX。下列说法中正确的是
| A.该反应中X物质为O2 |
| B.反应物Na2O2只作氧化剂 |
| C.该反应中发生氧化反应的过程只有FeSO4→Na2FeO4 |
| D.每生成l molNa2FeO4,反应过程中转移4 mol e- |
您最近一年使用:0次
2017-08-30更新
|
294次组卷
|
4卷引用:黑龙江省大庆中学2018届高三上学期开学考试化学试题



