名校
1 . 滴定是分析化学中重要的分析方法之一,根据其原理回答下列问题:
Ⅰ.酸碱中和滴定是最基本的滴定方法:
(1)滴定管是酸碱中和滴定中重要的仪器,向25 mL碱式滴定管中加入氢氧化钠溶液,开始时滴定管的读数为10.00 mL,将滴定管中的液体全部放出,放出氢氧化钠溶液的体积为___________ (填“大于”“小于”或“等于”)15.00 mL。
(2)向碱式滴定管中注入标准的氢氧化钠溶液之前的一步操作:___________ 。
Ⅱ.氧化还原滴定也是分析化学中常用的分析手段,用氧化还原滴定方法测定粗品中 的质量分数。
的质量分数。
实验步骤:称取6 g粗品配制250 mL溶液待用。用酸式滴定管取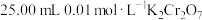 溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的
溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的 溶液滴定至终点(反应为
溶液滴定至终点(反应为 ),消耗
),消耗 溶液25.00 mL。回答下列问题:
溶液25.00 mL。回答下列问题:
(3)向 溶液中加入过量的KI溶液并酸化,
溶液中加入过量的KI溶液并酸化, 被还原成
被还原成 ,写出该反应的离子方程式
,写出该反应的离子方程式___________ 。
(4) 溶液滴定至终点的现象为
溶液滴定至终点的现象为___________ 。
(5)粗品中 的质量分数为
的质量分数为___________ 。
(6)若在取 溶液时有部分溶液滴到了锥形瓶外,则测定结果偏
溶液时有部分溶液滴到了锥形瓶外,则测定结果偏___________ (填“高”“低”或“不变”)。
Ⅰ.酸碱中和滴定是最基本的滴定方法:
(1)滴定管是酸碱中和滴定中重要的仪器,向25 mL碱式滴定管中加入氢氧化钠溶液,开始时滴定管的读数为10.00 mL,将滴定管中的液体全部放出,放出氢氧化钠溶液的体积为
(2)向碱式滴定管中注入标准的氢氧化钠溶液之前的一步操作:
Ⅱ.氧化还原滴定也是分析化学中常用的分析手段,用氧化还原滴定方法测定粗品中
 的质量分数。
的质量分数。实验步骤:称取6 g粗品配制250 mL溶液待用。用酸式滴定管取
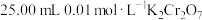 溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的
溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的 溶液滴定至终点(反应为
溶液滴定至终点(反应为 ),消耗
),消耗 溶液25.00 mL。回答下列问题:
溶液25.00 mL。回答下列问题:(3)向
 溶液中加入过量的KI溶液并酸化,
溶液中加入过量的KI溶液并酸化, 被还原成
被还原成 ,写出该反应的离子方程式
,写出该反应的离子方程式(4)
 溶液滴定至终点的现象为
溶液滴定至终点的现象为(5)粗品中
 的质量分数为
的质量分数为(6)若在取
 溶液时有部分溶液滴到了锥形瓶外,则测定结果偏
溶液时有部分溶液滴到了锥形瓶外,则测定结果偏
您最近一年使用:0次
2021-12-07更新
|
274次组卷
|
3卷引用:黑龙江省大庆市东风中学2021-2022学年高二下学期开学考试化学试题
2 . 过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。Ca(OH)2+H2O2+6H2O=CaO2·8H2O;反应时通常加入过量Ca(OH)2,其目的_______ ,
(2)向池塘水中加入一定量CaO2·8H2O后,池塘水中浓度增加的离子有_______(填序号)。
(3)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系为:
O2 MnO(OH)2
MnO(OH)2 I2
I2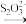 S4O
S4O
写出O2将Mn2+氧化成MnO(OH)2的离子方程式:_______
(4)利用电解后的溶液制备重铬酸钠晶体(Na2Cr2O7·2H2O)的流程如图。已知:重铬酸钠晶体(Na2Cr2O7·2H2O)俗称红矾钠,桔红色晶体,略有吸湿性,易溶于水,不溶于乙醇;Na2Cr2O7·2H2O的式量为298。
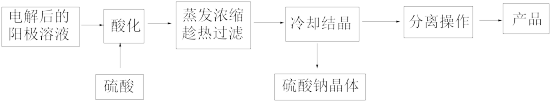
①流程中分离操作包括_______ 、洗涤、干燥,其中洗涤时最好选用_______ (填试剂名称)。
②准确称取上述流程中的产品3.1700 g配成250 mL溶液,取出25.00 mL放于锥形瓶中,加入10 mL 2 mol·L-1 H2SO4溶液和足量碘化钾溶液,放于暗处5 min;然后加入100 mL水和2-3滴淀粉指示剂;最后根据I2+2S2O =2I—+S4O
=2I—+S4O 用0.1000 mol·L-1 Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:
用0.1000 mol·L-1 Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:_______ 。若实验中平均用去Na2S2O3标准溶液60.00 mL,则所得产品中的重铬酸钠晶体的纯度为_______ 。
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。Ca(OH)2+H2O2+6H2O=CaO2·8H2O;反应时通常加入过量Ca(OH)2,其目的
(2)向池塘水中加入一定量CaO2·8H2O后,池塘水中浓度增加的离子有_______(填序号)。
| A.Ca2+ | B.H+ | C.CO | D.OH— |
O2
 MnO(OH)2
MnO(OH)2 I2
I2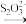 S4O
S4O
写出O2将Mn2+氧化成MnO(OH)2的离子方程式:
(4)利用电解后的溶液制备重铬酸钠晶体(Na2Cr2O7·2H2O)的流程如图。已知:重铬酸钠晶体(Na2Cr2O7·2H2O)俗称红矾钠,桔红色晶体,略有吸湿性,易溶于水,不溶于乙醇;Na2Cr2O7·2H2O的式量为298。

①流程中分离操作包括
②准确称取上述流程中的产品3.1700 g配成250 mL溶液,取出25.00 mL放于锥形瓶中,加入10 mL 2 mol·L-1 H2SO4溶液和足量碘化钾溶液,放于暗处5 min;然后加入100 mL水和2-3滴淀粉指示剂;最后根据I2+2S2O
 =2I—+S4O
=2I—+S4O 用0.1000 mol·L-1 Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:
用0.1000 mol·L-1 Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:
您最近一年使用:0次
2010·江西·二模
名校
解题方法
3 . 已知NH4CuSO3与足量的10mol·L-1硫酸混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
| A.反应中硫酸作氧化剂 |
| B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是氨气 |
| D.1molNH4CuSO3完全反应转移0.5mol电子 |
您最近一年使用:0次
2021-09-14更新
|
413次组卷
|
93卷引用:黑龙江省大庆实验中学2017-2018学年高二上学期开学考试化学试题
黑龙江省大庆实验中学2017-2018学年高二上学期开学考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期开学阶段性考试(8月)化学试题(已下线)2012届黑龙江省牡丹江一中高三上学期期中考试化学试卷(已下线)2014届黑龙江省佳木斯市第一中学高三第三次调研化学试卷2016届黑龙江省双鸭山一中高三上学期12月月考化学试卷2015-2016学年河南省信阳高级中学高一下开学测化学试卷2016-2017学年河北正定中学高二上开学考试化学卷江西省上饶市横峰中学2018-2019学年高一下学期开学考试化学试题吉林省长春外国语学校2020-2021学年高三上学期期初考试化学试题河南省郑州市第一中学2021届高三上学期开学测试化学试题吉林省大安市第一中学校2021-2022学年高二上学期期初考试化学试题(已下线)江西省重点中学协作体2010届高三第二次联考(化学)(已下线)2011届河南省豫南九校高三上学期第二次联考化学试卷(已下线)2012届山东省济宁市邹城二中高三第二次质量检测化学试卷2014届河北衡水中学高三上学期期中考试化学试卷(已下线)2014届河北冀州中学高三上学期期中考试往届化学试卷(已下线)2014高考名师推荐化学氧化还原反应的概念2015届辽宁省抚顺市二中高三上学期期中考试化学试卷2016届河北省衡水中学高三上学期二调化学试卷2016届重庆市万州二中高三上学期9月月考化学试卷2016届山东省潍坊第一中学高三上学期10月月考化学试卷2016届甘肃省天水市第一中学高三上学期期中测试化学试卷2016届山东省青岛市高三上学期期中测试化学试卷2016届江苏省淮安市四星级高中高三上学期10月阶段测化学试卷2015-2016学年湖北省枣阳市第七中学高一上学期期中考试化学试卷2015-2016学年浙江省杭州市五校联盟高三12月月考化学试卷2016届吉林省东北师大附属中学高三上四次模拟化学卷2016届内蒙古赤峰市宁城县高三下学期第三次统一模拟考试化学试卷2016届内蒙古赤峰二中高三第四次模拟理综化学试卷2017届吉林省松原油田高中高三上第一次阶段测化学卷2017届福建省仙游一中高三上第一次月考化学试卷2017届江西省南昌二中高三上第二次考试化学试卷2017届河北省石家庄辛集中学高三上期中化学试卷2017届河南省周口市淮阳中学高三上10月月考化学试卷2017届内蒙古赤峰市宁城县高三上统一考试化学试卷2017届江西省兴国中学、兴国三中等四校高三上第一次联考化学卷2016-2017学年河北省冀州中学高一上11月月考化学卷2017届辽宁省沈阳东北育才学校高三上期中模拟化学卷2017届江西省兴国中学等四校高三上联考一化学试卷2017届吉林省长春实验中学高三第五次模拟化学卷2016-2017学年湖北省鄂东南省级示范高中高一下学期期中联考化学试卷陕西省西藏民族学院附属中学2017届高三考前冲刺(一)理科综合化学试题辽宁省瓦房店市高级中学2016-2017学年高二下学期期末考试化学试题2018届高三一轮复习化学:微考点11-氧化还原反应的概念江西省临川区第二中学2018届高三上学期第三次月考化学试题湖南省永州市祁阳县第一中学2018届高三10月月考化学试题陕西省西安市长安区第一中学2017-2018学年高一下学期第一次教学质量检测化学试题广西陆川县中学2017-2018学年高一下学期3月月考化学试题【全国百强校】山东师范大学附属中学2017-2018学年高二下学期第八次学分认定(期末)考试化学试题湖南省湖南师范大学附属中学2019届高三上学期月考(一)化学试题【全国百强校】陕西省陕西师大附属中学2019届高三上学期月考化学试题【全国百强校】湖南省师范大学附属中学2019届高三上学期月考化学试题江西省赣州市会昌中学2019届高三上学期第一次月考(10月)化学试题河北省承德市第一中学2019届高三上学期第三次月考理科综合化学试题山东省商河市第一中学2019届高三上学期11月月考理科综合化学试题山东省滨州市北镇中学2019届高三上学期12月份质量检测化学试题江西省九江市同文中学2019届高三上学期期中考试化学试题山东省济宁市微山县亚马逊中学2019届高三上学期11月月考化学试题吉林省东辽五中2020届高三上学期9月月考化学试题江西省临川第二中学2020届高三10月月考化学试题吉林省白城市通榆县第一中学2020届高三上学期第二次月考化学试题山东省济宁市2020届高三10月月考化学试卷山东省济宁市邹城第一中学2020届高三10月月考化学试题甘肃省兰州市第一中学2020届高三上学期9月月考化学试题山东省莱阳市第一中学2020届高三10月月考化学试题吉林省长春市东北师范大学附中2020届高三上学期第一次摸底考试化学试题山东省肥城市泰西中学2019-2020学年高三上学期第一次月考化学试题新疆乌鲁木齐县柴窝堡林场中学2019届高三第三次模拟考试理科综合化学试题陕西省汉中市龙岗学校2019-2020学年高一上学期期中考试化学试题福建省厦门市湖滨中学2020届高三上学期期中考试化学试题四川省宜宾市叙州区第二中学校2019-2020学年高一下学期第一次在线月考化学试题(已下线)【南昌新东方】2018-2019莲塘一中 高三12月 014山东省济宁市汶上圣泽中学2019-2020学年高二下学期第二次检测化学试题(已下线)专题3.4 金属材料及金属矿物的开发利用(练)——2020年高考化学一轮复习讲练测安徽省安庆市2019-2020学年高一下学期期末测试化学试卷福建省永安市第三中学2021届高三9月月考化学试题吉林省大安市第一中学校2021届高三上学期第二次月考化学试题(已下线)第二章 元素与物质世界(能力提升)-2020-2021学年高一化学必修第一册单元测试定心卷 (鲁科版2019)四川省乐山沫若中学2021届高三上学期第二次理综化学试题江西省高安中学2020-2021学年高一上学期期中考试化学试题四川省射洪中学2019-2020学年高一上期期末英才班能力素质监测化学试题广东省中山纪念中学2021届高三上学期第一次月考化学试题湖南省/(常德市芷兰实验中学2020-2021学年高一上学期第二次月考化学试题河南省信阳高级中学2020-2021学年高一上学期1月月考化学试题福建省莆田第十五中学2020届高三9月月考化学试题(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练云南省昭通市昭阳区第一中学2020-2021学年高一上学期第三次月考化学试题(已下线)【一飞冲天】名家原创卷1河北省廊坊市河北省三河市第一中学2020-2021学年高一下学期第二次阶段考化学试题吉林省辉南县第六中学2022届高三上学期第一次月考化学试题 山东省济南市章丘区第四中2022-2023学年高一上学期1月期末线上测试化学试题内蒙古自治区科尔沁左翼中旗实验高级中学2023-2024学年高三上学期11月月考化学试题
名校
4 . 某容器中发生一个化学反应,反应过程中存在Fe2+、 、Fe3+、
、Fe3+、 、H+和H2O六种粒子,在反应过程中测得Fe3+、
、H+和H2O六种粒子,在反应过程中测得Fe3+、 的质量分数(w)随时间变化的曲线如图所示,下列有关判断中错误的是
的质量分数(w)随时间变化的曲线如图所示,下列有关判断中错误的是

 、Fe3+、
、Fe3+、 、H+和H2O六种粒子,在反应过程中测得Fe3+、
、H+和H2O六种粒子,在反应过程中测得Fe3+、 的质量分数(w)随时间变化的曲线如图所示,下列有关判断中错误的是
的质量分数(w)随时间变化的曲线如图所示,下列有关判断中错误的是
A.在反应中 被还原,发生还原反应 被还原,发生还原反应 |
B.还原性:Fe2+> |
| C.该反应中Fe2+被还原为Fe3+ |
| D.在反应中参加反应的还原剂与氧化剂的个数之比为8:1 |
您最近一年使用:0次
2021-09-12更新
|
600次组卷
|
9卷引用:黑龙江省七台河市勃利县高级中学2022-2023学年高三上学期开学考试化学试题
黑龙江省七台河市勃利县高级中学2022-2023学年高三上学期开学考试化学试题云南省富宁县第一中学2021-2022学年高一下学期开学考试化学试题河北省石家庄市第二十三中学2020-2021学年高一上学期期中考试化学试题河北省衡水市武强中学2021-2022学年高一上学期第一次月考化学试题辽宁省葫芦岛市第八高级中学2022届高三上学期10月月考化学试题浙江省北斗联盟2022-2023学年高一上学期期中考试化学试题微专题(四) 氧化还原反应的简单规律及应用新疆乌鲁木齐市第101中学2023-2024学年高三上学期8月月考化学试题陕西省西安市碑林区教育局2023-2024学年高一上学期期中教育质量监测化学试题
名校
解题方法
5 . 钒钢具有高强度、弹性优良、抗磨损、抗冲击等性能,可用于汽车和飞机制造。一种从石煤(含SiO2、V2O3、V2O5和少量Fe2O3)中提取V2O5的流程如图:

已知:
请回答下列问题:
(1)“酸浸”时,为提高浸出速率,除适当增加硫酸浓度、减小石煤矿粉粒径外,还可采取的措施有___ (任写一个);生成VO2+的离子方程式为____ 。
(2)从整体流程来看,“还原”的目的为____ 。
(3)实验室模拟“萃取”时,需用到的玻璃仪器有___ 。
(4)“氧化”时发生反应的离子方程式为___ 。
(5)上述流程中可以循环利用的物质有___ 。
(6)全钒液流储能电池的工作原理为:VO2++V3++H2O VO
VO +V2++2H+。
+V2++2H+。
①充电时,阳极的电极反应式为___ 。
②两极区被质子交换膜隔开,放电时,若外电路转移2mole-,则正极区溶液△n(H+)=___ mol。

已知:
| 离子 | VO2+ | VO | Fe2+ | Fe3+ |
| P2O4+TBP+煤油中的溶解度 | 很大 | 较小 | 0 | 很大 |
请回答下列问题:
(1)“酸浸”时,为提高浸出速率,除适当增加硫酸浓度、减小石煤矿粉粒径外,还可采取的措施有
(2)从整体流程来看,“还原”的目的为
(3)实验室模拟“萃取”时,需用到的玻璃仪器有
(4)“氧化”时发生反应的离子方程式为
(5)上述流程中可以循环利用的物质有
(6)全钒液流储能电池的工作原理为:VO2++V3++H2O
 VO
VO +V2++2H+。
+V2++2H+。①充电时,阳极的电极反应式为
②两极区被质子交换膜隔开,放电时,若外电路转移2mole-,则正极区溶液△n(H+)=
您最近一年使用:0次
名校
解题方法
6 . 按要求书写方程式
(1) 使酸性
使酸性 溶液褪色(离子方程式)
溶液褪色(离子方程式)_______ ;
(2)硝酸保存在棕色试剂瓶的原因(化学方程式)_______ ;
(3) 溶液与稀硫酸的反应(离子方程式)
溶液与稀硫酸的反应(离子方程式)_______ ;
(4)已知 的燃烧热是
的燃烧热是 ,表示
,表示 燃烧热的热化学方程式
燃烧热的热化学方程式_______ ;
(5)铅酸蓄电池充电时的阴极反应式_______ 。
(1)
 使酸性
使酸性 溶液褪色(离子方程式)
溶液褪色(离子方程式)(2)硝酸保存在棕色试剂瓶的原因(化学方程式)
(3)
 溶液与稀硫酸的反应(离子方程式)
溶液与稀硫酸的反应(离子方程式)(4)已知
 的燃烧热是
的燃烧热是 ,表示
,表示 燃烧热的热化学方程式
燃烧热的热化学方程式(5)铅酸蓄电池充电时的阴极反应式
您最近一年使用:0次
名校
7 . 碳酸锂广泛应用于陶瓷和医药等领域。以 -锂辉石(主要成分为
-锂辉石(主要成分为 )为原料制备
)为原料制备 的工艺流程如下:
的工艺流程如下:

已知: 、
、 、
、 和
和 以氢氧化物形式完全沉淀时,溶液的
以氢氧化物形式完全沉淀时,溶液的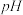 分别为3.2、5.2、9.7和12.4;
分别为3.2、5.2、9.7和12.4; 、
、 和
和 在
在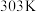 下的溶解度分别为
下的溶解度分别为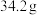 、
、 和
和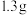 。
。
(1)步骤Ⅰ前, -锂辉石要粉碎成细颗粒的目的是
-锂辉石要粉碎成细颗粒的目的是___________ 。
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有 、
、 ,另含有
,另含有 、
、 、
、 、
、 、
、 、
、 等杂质,需在搅拌下加入
等杂质,需在搅拌下加入___________ (填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的 到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的 溶液、石灰乳和
溶液、石灰乳和 溶液依次加入浸出液中,可除去的杂质金属离子有
溶液依次加入浸出液中,可除去的杂质金属离子有___________ ,过氧化氢发生反应的离子方程式为___________ 。
(4)步骤Ⅲ中,生成沉淀的离子方程式为___________ 。
(5)从母液中可回收的主要物质是___________ 。
 -锂辉石(主要成分为
-锂辉石(主要成分为 )为原料制备
)为原料制备 的工艺流程如下:
的工艺流程如下:
已知:
 、
、 、
、 和
和 以氢氧化物形式完全沉淀时,溶液的
以氢氧化物形式完全沉淀时,溶液的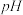 分别为3.2、5.2、9.7和12.4;
分别为3.2、5.2、9.7和12.4; 、
、 和
和 在
在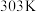 下的溶解度分别为
下的溶解度分别为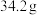 、
、 和
和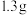 。
。(1)步骤Ⅰ前,
 -锂辉石要粉碎成细颗粒的目的是
-锂辉石要粉碎成细颗粒的目的是(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有
 、
、 ,另含有
,另含有 、
、 、
、 、
、 、
、 、
、 等杂质,需在搅拌下加入
等杂质,需在搅拌下加入 到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。(3)步骤Ⅱ中,将适量的
 溶液、石灰乳和
溶液、石灰乳和 溶液依次加入浸出液中,可除去的杂质金属离子有
溶液依次加入浸出液中,可除去的杂质金属离子有(4)步骤Ⅲ中,生成沉淀的离子方程式为
(5)从母液中可回收的主要物质是
您最近一年使用:0次
名校
8 . 过氧化钙( )是一种白色、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
)是一种白色、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在 溶液中加入
溶液中加入 ;
;
②不断搅拌的同时加入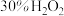 ,反应生成
,反应生成 沉淀;
沉淀;
③经过陈化、过滤,水洗得到 ,再脱水干燥得到
,再脱水干燥得到 。
。
已知 在350℃迅速分解生成
在350℃迅速分解生成 和
和 。下图是实验室测定产品中
。下图是实验室测定产品中 含量的装置(夹持装置省略)。
含量的装置(夹持装置省略)。
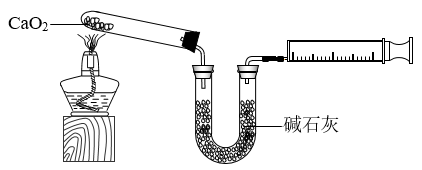
(1)第②步反应的化学方程式为___________ 。
(2) 加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是
加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是___________ 、___________ 。
(3)若所取产品质量是 ,测得气体体积为
,测得气体体积为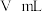 (已换算成标准状况),则产品中
(已换算成标准状况),则产品中 的质量分数为
的质量分数为___________ (用字母表示)。
(4)过氧化钙的含量也可用氧化还原滴定法测定,过程如下。准确称取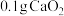 产品于锥形瓶中,加入
产品于锥形瓶中,加入 蒸馏水和
蒸馏水和 ,完全溶解后加入几滴
,完全溶解后加入几滴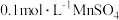 溶液,用
溶液,用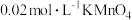 标准溶液滴定至终点。平行三次,所得实验数据如下表所示:
标准溶液滴定至终点。平行三次,所得实验数据如下表所示:
①反应加入 溶液的作用是
溶液的作用是___________ ,滴定的终点现象是___________ 。
②滴定过程中加入标准溶液发生反应的离子方程式为___________ ,过氧化钙的质量分数为___________ (保留两位有效数字)。
 )是一种白色、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
)是一种白色、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:①在
 溶液中加入
溶液中加入 ;
;②不断搅拌的同时加入
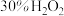 ,反应生成
,反应生成 沉淀;
沉淀;③经过陈化、过滤,水洗得到
 ,再脱水干燥得到
,再脱水干燥得到 。
。已知
 在350℃迅速分解生成
在350℃迅速分解生成 和
和 。下图是实验室测定产品中
。下图是实验室测定产品中 含量的装置(夹持装置省略)。
含量的装置(夹持装置省略)。
(1)第②步反应的化学方程式为
(2)
 加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是
加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是(3)若所取产品质量是
 ,测得气体体积为
,测得气体体积为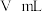 (已换算成标准状况),则产品中
(已换算成标准状况),则产品中 的质量分数为
的质量分数为(4)过氧化钙的含量也可用氧化还原滴定法测定,过程如下。准确称取
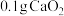 产品于锥形瓶中,加入
产品于锥形瓶中,加入 蒸馏水和
蒸馏水和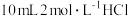 ,完全溶解后加入几滴
,完全溶解后加入几滴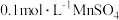 溶液,用
溶液,用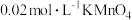 标准溶液滴定至终点。平行三次,所得实验数据如下表所示:
标准溶液滴定至终点。平行三次,所得实验数据如下表所示:| 试验次数 | 一 | 二 | 三 |
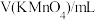 | 23.02 | 23.05 | 23.04 |
 溶液的作用是
溶液的作用是②滴定过程中加入标准溶液发生反应的离子方程式为
您最近一年使用:0次
9 . 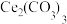 可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以
可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以 形式存在,还含有
形式存在,还含有 、
、 、
、 、
、 等物质。以独居石为原料制备
等物质。以独居石为原料制备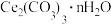 的工艺流程如下:
的工艺流程如下:
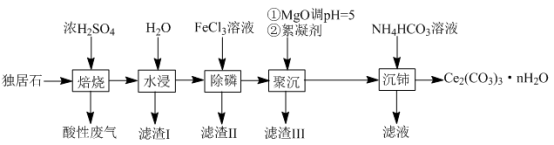
回答下列问题:
(1)铈的某种核素含有58个质子和80个中子,该核素的符号为_______ ;
(2)为提高“水浸”效率,可采取的措施有_______ (至少写两条);
(3)滤渣Ⅲ的主要成分是_______ (填化学式);
(4)加入絮凝剂的目的是_______ ;
(5)“沉铈”过程中,生成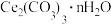 的离子方程式为
的离子方程式为_______ ,常温下加入的 溶液呈
溶液呈_______ (填“酸性”“碱性”或“中性”)(已知: 的
的 ,
, 的
的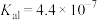 ,
, );
);
(6)滤渣Ⅱ的主要成分为 ,在高温条件下,
,在高温条件下, 、葡萄糖(
、葡萄糖( )和
)和 可制备电极材料
可制备电极材料 ,同时生成
,同时生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_______
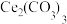 可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以
可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以 形式存在,还含有
形式存在,还含有 、
、 、
、 、
、 等物质。以独居石为原料制备
等物质。以独居石为原料制备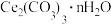 的工艺流程如下:
的工艺流程如下:
回答下列问题:
(1)铈的某种核素含有58个质子和80个中子,该核素的符号为
(2)为提高“水浸”效率,可采取的措施有
(3)滤渣Ⅲ的主要成分是
(4)加入絮凝剂的目的是
(5)“沉铈”过程中,生成
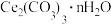 的离子方程式为
的离子方程式为 溶液呈
溶液呈 的
的 ,
, 的
的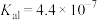 ,
, );
);(6)滤渣Ⅱ的主要成分为
 ,在高温条件下,
,在高温条件下, 、葡萄糖(
、葡萄糖( )和
)和 可制备电极材料
可制备电极材料 ,同时生成
,同时生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为
您最近一年使用:0次
2021-06-09更新
|
11105次组卷
|
32卷引用:黑龙江省齐齐哈尔市讷河市第一中学2023-2024学年高二下学期开学考试化学试题
黑龙江省齐齐哈尔市讷河市第一中学2023-2024学年高二下学期开学考试化学试题2021年新高考湖南化学高考真题(已下线)微专题32 化学工艺流程题——核心反应与条件控制-备战2022年高考化学考点微专题(已下线)微专题31 化学工艺流程题——原料的预处理-备战2022年高考化学考点微专题(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点31 化学实验与工艺流程-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考向09 工艺流程初探-备战2022年高考化学一轮复习考点微专题(已下线)专题讲座(六)化工流程的解题策略(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)2021年湖南省高考化学试卷变式题11-19(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题27 无机化工流程-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)专题15 工艺流程综合题-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)专题16 工艺流程题-三年(2020-2022)高考真题分项汇编(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)微专题28 有关工艺流程和实验探究方程式的书写-备战2023年高考化学一轮复习考点微专题(已下线)第09讲 无机非金属材料(讲)-2023年高考化学一轮复习讲练测(新教材新高考)湖南省常德市汉寿县第一中学2022-2023学年高三上学期第一次月考化学试题山东省滨州市沾化区实验高级中学2022-2023学年高三上学期第二次月考化学试题第二部分 热点专项突破——解题能力稳提升 专项1 物质制备类的工艺流程 热点1 以矿物为载体的工艺流程(已下线)第八章 水溶液中的离子反应与平衡 第55讲 无机化工流程题的解题策略(已下线)第二部分 工业生产流程 综合提能训练(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题福建省永春第一中学2022-2023学年高二下学期6月月考化学试题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)微专题 无机化工流程题的解题策略
名校
解题方法
10 . 下列离子方程式书写正确的是
| A.向硫酸铜溶液中加入少量过氧化钠:2Na2O2 +2Cu2+ +2H2O=4Na+ +2Cu(OH)2↓+O2↑ |
| B.将氯气通入氢氧化钠溶液中:Cl2+OH-=Cl-+ClO- +H2O |
| C.等物质的量的CaCl2、Ba(OH)2和HCl溶液混合:Ca2++2OH-=Ca(OH)2 ↓ |
| D.氧化亚铁溶于稀硝酸:FeO+2H+=Fe2+ +H2O |
您最近一年使用:0次
2021-05-13更新
|
573次组卷
|
4卷引用:黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高三上学期开学考试化学试题
黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高三上学期开学考试化学试题福建省莆田市2021届高三第三次质量检测化学试题山东省泰安市与济南章丘区2021届高三5月联合模拟考试化学试题(已下线)专题04 离子反应(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练



