1 . 把碎纸片b、c、d、e补充到a中,可得到一个完整的离子方程式(未配平)。下列说法不正确的是


| A.纸条排列的顺序可能是:c、d、a、b、e |
B.通过该反应可知氧化性:ClO >SO >SO |
| C.氧化剂与还原剂的物质的量之比为2∶1 |
| D.每生成1molClO2,反应转移的电子数为2NA |
您最近一年使用:0次
2023-02-18更新
|
115次组卷
|
3卷引用:黑龙江省齐齐哈尔市讷河市第二中学等3校2022-2023学年高一下学期开学考试化学试题
名校
2 . 已知电对的标准电极电势(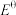 )越高,其中氧化剂的氧化性越强。现有4组电对的标准电极电势:①
)越高,其中氧化剂的氧化性越强。现有4组电对的标准电极电势:①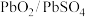 ,
,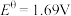 ;②
;②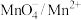 ,
,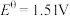 ;③
;③ ,
,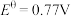 ;④
;④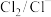 ,
,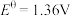 。下列有关说法正确的是
。下列有关说法正确的是
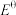 )越高,其中氧化剂的氧化性越强。现有4组电对的标准电极电势:①
)越高,其中氧化剂的氧化性越强。现有4组电对的标准电极电势:①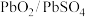 ,
,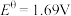 ;②
;②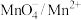 ,
,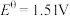 ;③
;③ ,
,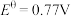 ;④
;④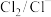 ,
,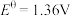 。下列有关说法正确的是
。下列有关说法正确的是A. 可与 可与 发生反应: 发生反应: |
| B.酸化高锰酸钾时既可以用硫酸也可以用盐酸 |
C.向含2  的溶液中加1 的溶液中加1  可观察到黄绿色气体 可观察到黄绿色气体 |
D. 与酸性 与酸性 反应的离子方程式: 反应的离子方程式: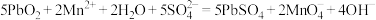 |
您最近一年使用:0次
2023-02-08更新
|
439次组卷
|
3卷引用:黑龙江省哈尔滨市第三中学校2023-2024学年高三上学期第一次验收(开学测试)化学试题
3 . 二氧化氯( )是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。回答下列问题:
)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。回答下列问题:
(1) 的制备:制备
的制备:制备 的常用方法有两种,分别为
的常用方法有两种,分别为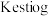 法、
法、 与
与 反应法。
反应法。
①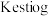 法制备
法制备 的原理为
的原理为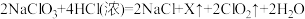 ,X的化学式为
,X的化学式为___________ ,将 通入
通入 溶液中,有红褐色沉淀生成,溶液中的主要阴离子为
溶液中,有红褐色沉淀生成,溶液中的主要阴离子为 、
、 ,若消耗
,若消耗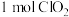 ,则被氧化的
,则被氧化的 为
为___________  。
。
② 与
与 反应法制备
反应法制备 ,生成物只有两种,参加反应的
,生成物只有两种,参加反应的 与
与 物质的量之比为
物质的量之比为___________ ,与 法相比,
法相比, 与
与 反应法的优点是
反应法的优点是___________ (填一条)。
(2) 的用途:除毒、除异味。
的用途:除毒、除异味。
① 可以将剧毒的氰化物氧化成
可以将剧毒的氰化物氧化成 和
和 ,离子方程式为
,离子方程式为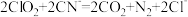 ,
, 属于
属于___________ (填“酸”“碱”或“两”)性氧化物,每转移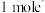 ,生成
,生成___________ L(标准状况下) 。
。
② 能把水溶液中有异味的
能把水溶液中有异味的 氧化成四价锰,使之形成不溶于水的
氧化成四价锰,使之形成不溶于水的 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
 )是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。回答下列问题:
)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。回答下列问题:(1)
 的制备:制备
的制备:制备 的常用方法有两种,分别为
的常用方法有两种,分别为 法、
法、 与
与 反应法。
反应法。①
 法制备
法制备 的原理为
的原理为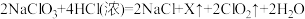 ,X的化学式为
,X的化学式为 通入
通入 溶液中,有红褐色沉淀生成,溶液中的主要阴离子为
溶液中,有红褐色沉淀生成,溶液中的主要阴离子为 、
、 ,若消耗
,若消耗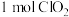 ,则被氧化的
,则被氧化的 为
为 。
。②
 与
与 反应法制备
反应法制备 ,生成物只有两种,参加反应的
,生成物只有两种,参加反应的 与
与 物质的量之比为
物质的量之比为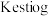 法相比,
法相比, 与
与 反应法的优点是
反应法的优点是(2)
 的用途:除毒、除异味。
的用途:除毒、除异味。①
 可以将剧毒的氰化物氧化成
可以将剧毒的氰化物氧化成 和
和 ,离子方程式为
,离子方程式为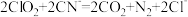 ,
, 属于
属于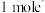 ,生成
,生成 。
。②
 能把水溶液中有异味的
能把水溶液中有异味的 氧化成四价锰,使之形成不溶于水的
氧化成四价锰,使之形成不溶于水的 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
2023-02-07更新
|
369次组卷
|
2卷引用:黑龙江省黑河市第九中学2023-2024学年高三上学期摸底考试化学试题
4 . 某工厂的工业废水中含有大量的 和
和 ,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收
,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收 和金属
和金属 。请根据以下流程图,回答相关问题:
。请根据以下流程图,回答相关问题:

(1)操作Ⅰ和操作Ⅱ的方法是_______ 。
(2)步骤①加入的铁粉应_______ (选填“过量”或“少量”),写出该步骤中发生的所有氧化还原反应的离子方程式_______ 。
(3)固体A的成分是_______ (填名称)。
(4)操作Ⅱ加入试剂B的稀溶液,B的化学式为_______ ,该物质在该反应中作_______ 剂(选填“氧化”或“还原”)。
(5)取 溶液于试管中,滴加几滴
溶液于试管中,滴加几滴 溶液,生成的白色沉淀迅速变为灰绿色,最后变成红褐色,写出该反应中沉淀转化的化学反应方程式
溶液,生成的白色沉淀迅速变为灰绿色,最后变成红褐色,写出该反应中沉淀转化的化学反应方程式_______ 。
(6)如何检验所得 中不含有
中不含有
_______ 。
 和
和 ,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收
,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收 和金属
和金属 。请根据以下流程图,回答相关问题:
。请根据以下流程图,回答相关问题:
(1)操作Ⅰ和操作Ⅱ的方法是
(2)步骤①加入的铁粉应
(3)固体A的成分是
(4)操作Ⅱ加入试剂B的稀溶液,B的化学式为
(5)取
 溶液于试管中,滴加几滴
溶液于试管中,滴加几滴 溶液,生成的白色沉淀迅速变为灰绿色,最后变成红褐色,写出该反应中沉淀转化的化学反应方程式
溶液,生成的白色沉淀迅速变为灰绿色,最后变成红褐色,写出该反应中沉淀转化的化学反应方程式(6)如何检验所得
 中不含有
中不含有
您最近一年使用:0次
2023-01-01更新
|
187次组卷
|
3卷引用:黑龙江省鹤岗市第一中学2022-2023学年高一下学期开学考试化学试题
5 . 依据物质类别和元素价态,可以对物质的性质进行解释和预测。
Ⅰ、有二种物质: 、
、 、
、
(1)其中氧元素的化合价均为_______ 价。
(2)从氧化剂和还原剂的角度,分析反应中的 作用。请完成下表内容。
作用。请完成下表内容。
(3)由 、
、 的名称可推知
的名称可推知 的名称为
的名称为_______ 。
(4)已知 可与
可与 反应产生
反应产生 ,请写出
,请写出 与水反应的化学方程式
与水反应的化学方程式_______ ,由此可推测 也可做供氧剂。
也可做供氧剂。
Ⅱ、亚硝酸钠( )外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食
)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食 会导致血红蛋白中的
会导致血红蛋白中的 转化为
转化为 而中毒。
而中毒。
(5)误食 后可服用维生素C解毒。下列分析错误的是_______(填序号)
后可服用维生素C解毒。下列分析错误的是_______(填序号)
(6)亚硝酸钠在320℃时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式_______ 。
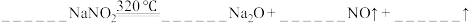
Ⅰ、有二种物质:
 、
、 、
、
(1)其中氧元素的化合价均为
(2)从氧化剂和还原剂的角度,分析反应中的
 作用。请完成下表内容。
作用。请完成下表内容。| 序号 | 化学反应方程式 | 作用 |
| ① | 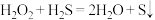 | |
| ② |  | |
| ③ | 既作氧化剂,又作还原剂 |
 、
、 的名称可推知
的名称可推知 的名称为
的名称为(4)已知
 可与
可与 反应产生
反应产生 ,请写出
,请写出 与水反应的化学方程式
与水反应的化学方程式 也可做供氧剂。
也可做供氧剂。Ⅱ、亚硝酸钠(
 )外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食
)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食 会导致血红蛋白中的
会导致血红蛋白中的 转化为
转化为 而中毒。
而中毒。(5)误食
 后可服用维生素C解毒。下列分析错误的是_______(填序号)
后可服用维生素C解毒。下列分析错误的是_______(填序号)A. 被还原 被还原 | B.维生素C具有还原性 |
C.还原性:维生素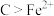 | D. 是还原剂 是还原剂 |
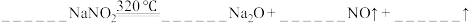
您最近一年使用:0次
2022-11-24更新
|
161次组卷
|
2卷引用:黑龙江省大庆市大庆中学2023-2024学年高一下学期开学化学试题
名校
解题方法
6 . 某学习小组按如下实验流程从海带中提取碘单质。
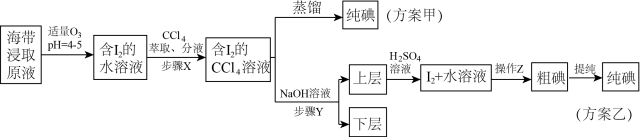
| A.步骤X“分液”时,应打开旋塞,先将水层放出 |
| B.方案甲采用蒸馏法时,碘蒸气先汽化冷凝,在锥形瓶中先得到I2 |
| C.步骤Y中应加入过量的稀NaOH溶液 |
D.加入H2SO4溶液后发生反应的离子方程式为: 5I-+IO +6H+=3I2+3H2O +6H+=3I2+3H2O |
您最近一年使用:0次
2022-10-07更新
|
310次组卷
|
5卷引用:黑龙江省大兴安岭实验中学2023-2024学年高二上学期开学考试化学试卷
名校
解题方法
7 . 以硫铁矿(主要成分为FeS2,还有少量CuS、SiO2等杂质)为原料制备绿矾晶体(FeSO4·7H2O)的工艺流程如下:
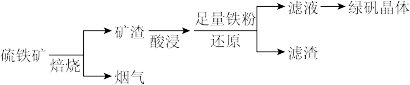
(1)“酸浸”过程,矿渣中的Fe2O3与稀H2SO4反应的离子方程式___________ 。
(2)烟气中的SO2会污染环境,可用足量氨水吸收,写出该反应的离子方程式___________ 。
(3)滤液中金属阳离子的检验方法___________ 。
(4)FeSO4溶液制备绿矾晶体过程中要保持H2SO4过量,理由___________ (结合化学用语说明原因)。
(5)燃料细菌脱硫法是用氧化亚铁硫杆菌(T。f)对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如图所示:
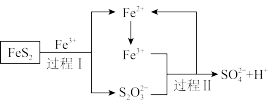
已知总反应为:FeS2+14Fe3++8H2O=2 +15Fe2++16H+
+15Fe2++16H+
将过程I离子方程式补充完整___________ 。
___________FeS2+___________Fe3++___________=7Fe2++___________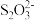 +___________H+
+___________H+
(6)绿矾晶体在空气中易被氧化。取xg样品,加水完全溶解,用酸化的amol·L-1K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液bmL。反应原理:6Fe2++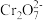 +14H+=6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为
+14H+=6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为___________ 。(FeSO4·7H2O摩尔质量为278g/mol)
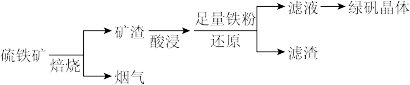
(1)“酸浸”过程,矿渣中的Fe2O3与稀H2SO4反应的离子方程式
(2)烟气中的SO2会污染环境,可用足量氨水吸收,写出该反应的离子方程式
(3)滤液中金属阳离子的检验方法
(4)FeSO4溶液制备绿矾晶体过程中要保持H2SO4过量,理由
(5)燃料细菌脱硫法是用氧化亚铁硫杆菌(T。f)对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如图所示:

已知总反应为:FeS2+14Fe3++8H2O=2
 +15Fe2++16H+
+15Fe2++16H+将过程I离子方程式补充完整
___________FeS2+___________Fe3++___________=7Fe2++___________
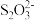 +___________H+
+___________H+(6)绿矾晶体在空气中易被氧化。取xg样品,加水完全溶解,用酸化的amol·L-1K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液bmL。反应原理:6Fe2++
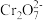 +14H+=6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为
+14H+=6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为
您最近一年使用:0次
8 . 请回答下列问题:
(1)实验室常用KMnO4和浓盐酸反应制取Cl2,反应的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。被还原的元素是_______ ,还原剂是_______ ,氧化产物是_______ 。
(2)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式,并用双线桥标出电子转移的方向和数目_______ 。
□NaIO3+□NaHSO3→□I2+□Na2SO4+□H2SO4+□H2O
(1)实验室常用KMnO4和浓盐酸反应制取Cl2,反应的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。被还原的元素是
(2)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式,并用双线桥标出电子转移的方向和数目
□NaIO3+□NaHSO3→□I2+□Na2SO4+□H2SO4+□H2O
您最近一年使用:0次
名校
解题方法
9 . 室温下,通过下列实验探究0.01000 mo/L  溶液的性质:
溶液的性质:
实验1:实验测得0.01000 mol/L 溶液pH为8.6
溶液pH为8.6
实验2:向溶液中滴加等体积0.01000 mol/L HCl溶液,pH由8.6降为4.8
实验3:向溶液中加入等体积0.0200 mo/L 溶液,出现白色沉淀
溶液,出现白色沉淀
实验4:向稀硫酸酸化的 溶液中滴加
溶液中滴加 溶液至溶液褪色
溶液至溶液褪色
下列说法不正确的是
 溶液的性质:
溶液的性质:实验1:实验测得0.01000 mol/L
 溶液pH为8.6
溶液pH为8.6实验2:向溶液中滴加等体积0.01000 mol/L HCl溶液,pH由8.6降为4.8
实验3:向溶液中加入等体积0.0200 mo/L
 溶液,出现白色沉淀
溶液,出现白色沉淀实验4:向稀硫酸酸化的
 溶液中滴加
溶液中滴加 溶液至溶液褪色
溶液至溶液褪色下列说法不正确的是
A.0.0100   溶液中满足: 溶液中满足: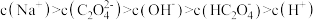 |
B.实验2滴加盐酸过程中存在某一点满足: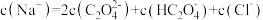 |
C.实验3所得上层清液中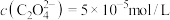 [已知室温时 [已知室温时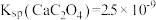 ] ] |
D.实验4发生反应的离子方程式为: |
您最近一年使用:0次
2022-09-02更新
|
601次组卷
|
5卷引用:黑龙江省牡丹江市第一高级中学2023-2024学年高二下学期开学初测试 化学试题
10 . 如图是某化学反应的微观示意图。下列有关说法正确的是
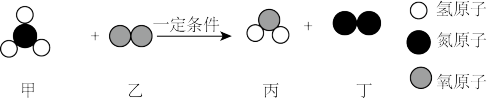

| A.该反应是复分解反应 |
B.反应方程式为 |
| C.生成物丙、丁的质量比为9∶14 |
| D.反应前后只有一种元素的化合价不变 |
您最近一年使用:0次
2022-08-25更新
|
260次组卷
|
3卷引用:黑龙江省哈尔滨师范大学附属中学2022-2023高二上学期开学考试化学试题



