名校
解题方法
1 . 亚氯酸钠( )主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下
)主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下 )受热易分解;
)受热易分解;
②高浓度的 易爆炸。
易爆炸。
(1) 与
与 ,因有强氧化性而用作常用消毒剂,消毒时均被还原为
,因有强氧化性而用作常用消毒剂,消毒时均被还原为 ,则
,则 的消毒能力是等质量的
的消毒能力是等质量的 的
的_____ 倍(保留小数点后一位)。
(2)反应1涉及的反应方程式为: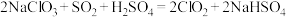 反应中生成的氧化产物与还原产物的个数比为
反应中生成的氧化产物与还原产物的个数比为_____ ;“反应1”需要鼓入空气,空气的作用是_____ 。
(3)“反应2”发生反应的化学方程式:_____ 。“反应2”需要控制反应温度不能过高,温度过高可能导致_____ ;_____ 。
(4)从“母液”中可回收的主要物质是_____ 。
(5)为探究 的氧化性,可以选择下列试剂
的氧化性,可以选择下列试剂_____ 。根据选择的试剂,描述能体现 氧化性的实验现象是
氧化性的实验现象是_____ 。
A.淀粉 溶液 B.酸性高锰酸钾溶液 C.氯水 D.
溶液 B.酸性高锰酸钾溶液 C.氯水 D. 溶液
溶液
(6)针对不同物品的消毒,亚氯酸钠溶液需要稀释到不同的浓度来使用。取含亚氯酸钠18.1g/L的消毒液lmL,加水稀释至100mL,则稀释后的溶液中亚氯酸钠的物质的量浓度为_____  。
。
 )主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下
)主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下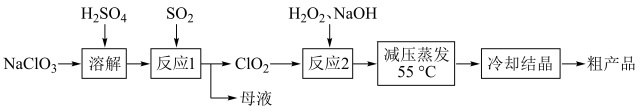
 )受热易分解;
)受热易分解;②高浓度的
 易爆炸。
易爆炸。(1)
 与
与 ,因有强氧化性而用作常用消毒剂,消毒时均被还原为
,因有强氧化性而用作常用消毒剂,消毒时均被还原为 ,则
,则 的消毒能力是等质量的
的消毒能力是等质量的 的
的(2)反应1涉及的反应方程式为:
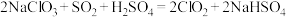 反应中生成的氧化产物与还原产物的个数比为
反应中生成的氧化产物与还原产物的个数比为(3)“反应2”发生反应的化学方程式:
(4)从“母液”中可回收的主要物质是
(5)为探究
 的氧化性,可以选择下列试剂
的氧化性,可以选择下列试剂 氧化性的实验现象是
氧化性的实验现象是A.淀粉
 溶液 B.酸性高锰酸钾溶液 C.氯水 D.
溶液 B.酸性高锰酸钾溶液 C.氯水 D. 溶液
溶液(6)针对不同物品的消毒,亚氯酸钠溶液需要稀释到不同的浓度来使用。取含亚氯酸钠18.1g/L的消毒液lmL,加水稀释至100mL,则稀释后的溶液中亚氯酸钠的物质的量浓度为
 。
。
您最近一年使用:0次
名校
解题方法
2 . 锗是当代高新技术产业配套的重要材料之一,从含锗烟尘中富集提取锗的一种工艺方法如下,其中烟尘中主要成分如表1所示:
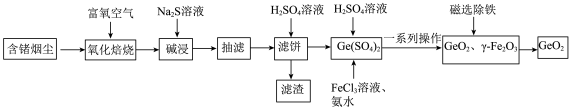
已知:i.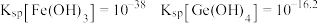
ii.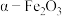 没有磁性,
没有磁性,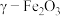 具有磁性。
具有磁性。
表1:含锗烟尘的主要成分
(1) 元素在周期表中的位置为:第
元素在周期表中的位置为:第___________ 周期第___________ 族。
(2)氧化焙烧时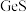 转化成
转化成 和一种污染性气体,该反应的化学方程式为:
和一种污染性气体,该反应的化学方程式为:___________ 。
(3)抽滤的优点___________ 和___________ 。
(4)滤渣成分为 、
、___________ 和___________ 。
(5)碱浸时生成 同时产生具有臭鸡蛋气味的气体,该过程的离子方程式为:
同时产生具有臭鸡蛋气味的气体,该过程的离子方程式为:_______ 。
(6)硫酸锗浸出液在调整酸碱度时发生氨水沉淀锗、铁的反应,则常温下,此过程需调节 的范围为
的范围为___________ 。
(7)多结砷化镓锗太阳能电池(图1)效率优异,工作原理如图2所示。
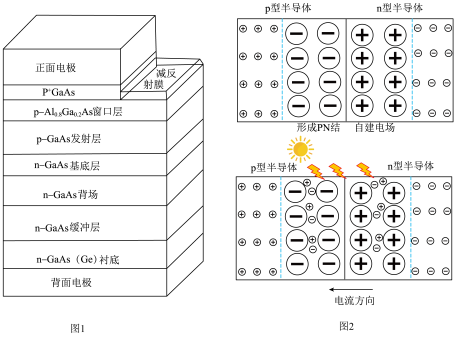
当光照射在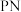 结上,
结上, 原子的电子跃迁,形成自由电子和空穴,在电场力影响下定向移动,外接回路即可形成电流。则外接回路时,空穴定向移动至
原子的电子跃迁,形成自由电子和空穴,在电场力影响下定向移动,外接回路即可形成电流。则外接回路时,空穴定向移动至___________ 方向(填“p型半导体”或“n型半导体”)。

已知:i.
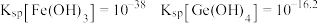
ii.
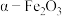 没有磁性,
没有磁性,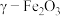 具有磁性。
具有磁性。表1:含锗烟尘的主要成分
| 成分 |  |  |  |  |  |  |  |
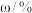 | 0.97 | 49.43 | 13.70 | 11.07 | 8.76 | 2.97 | 1.60 |
(1)
 元素在周期表中的位置为:第
元素在周期表中的位置为:第(2)氧化焙烧时
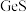 转化成
转化成 和一种污染性气体,该反应的化学方程式为:
和一种污染性气体,该反应的化学方程式为:(3)抽滤的优点
(4)滤渣成分为
 、
、(5)碱浸时生成
 同时产生具有臭鸡蛋气味的气体,该过程的离子方程式为:
同时产生具有臭鸡蛋气味的气体,该过程的离子方程式为:(6)硫酸锗浸出液在调整酸碱度时发生氨水沉淀锗、铁的反应,则常温下,此过程需调节
 的范围为
的范围为(7)多结砷化镓锗太阳能电池(图1)效率优异,工作原理如图2所示。

当光照射在
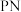 结上,
结上, 原子的电子跃迁,形成自由电子和空穴,在电场力影响下定向移动,外接回路即可形成电流。则外接回路时,空穴定向移动至
原子的电子跃迁,形成自由电子和空穴,在电场力影响下定向移动,外接回路即可形成电流。则外接回路时,空穴定向移动至
您最近一年使用:0次
名校
解题方法
3 . 钼( )及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以
)及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以 和
和 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下:
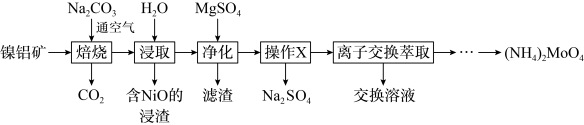
回答下列问题:
(1) 位于元素周期表第
位于元素周期表第_______ 周期第_______ 族。 中钼元素的化合价为
中钼元素的化合价为_______ 。
(2)“焙烧”中生成 的化学方程式为
的化学方程式为_______ 。
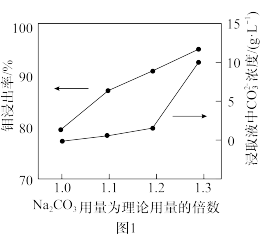
(3) 用量对钼浸出率和浸取液中
用量对钼浸出率和浸取液中 浓度的影响如图1所示,分析实际生产中选择
浓度的影响如图1所示,分析实际生产中选择 用量为理论用量1.2倍的原因:
用量为理论用量1.2倍的原因:_______ 。
(4) 的溶解度曲线如图2所示,为充分分离
的溶解度曲线如图2所示,为充分分离 ,工艺流程中的“操作
,工艺流程中的“操作 ”应为_______(填标号)。
”应为_______(填标号)。

(5)为充分利用资源,“离子交换萃取”步骤产生的交换溶液应返回“_______ ”步骤。
(6) 分解可得
分解可得 。高温下,用铝粉还原
。高温下,用铝粉还原 得到金属钼的化学方程式为
得到金属钼的化学方程式为_______ 。
 )及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以
)及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以 和
和 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下:
回答下列问题:
(1)
 位于元素周期表第
位于元素周期表第 中钼元素的化合价为
中钼元素的化合价为(2)“焙烧”中生成
 的化学方程式为
的化学方程式为(3)
 用量对钼浸出率和浸取液中
用量对钼浸出率和浸取液中 浓度的影响如图1所示,分析实际生产中选择
浓度的影响如图1所示,分析实际生产中选择 用量为理论用量1.2倍的原因:
用量为理论用量1.2倍的原因:
(4)
 的溶解度曲线如图2所示,为充分分离
的溶解度曲线如图2所示,为充分分离 ,工艺流程中的“操作
,工艺流程中的“操作 ”应为_______(填标号)。
”应为_______(填标号)。
| A.蒸发结晶 | B.低温结晶 | C.蒸馏 | D.萃取 |
(5)为充分利用资源,“离子交换萃取”步骤产生的交换溶液应返回“
(6)
 分解可得
分解可得 。高温下,用铝粉还原
。高温下,用铝粉还原 得到金属钼的化学方程式为
得到金属钼的化学方程式为
您最近一年使用:0次
2024-01-22更新
|
1135次组卷
|
7卷引用:黑龙江省大庆市大庆中学2023-2024学年高三下学期开学化学试题
黑龙江省大庆市大庆中学2023-2024学年高三下学期开学化学试题2024年1月安徽普通高等学校招生考试适应性测试化学试题(已下线)T16-工业流程题(已下线)2024年1月“九省联考”安徽真题完全解读与考后提升(已下线)热点23 化学工艺流程综合题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)江西省宜春市丰城市第九中学2023-2024学年高三(复读班)上学期期末考试化学试题
名校
4 . 宏微结合是研究化学的重要方法,从微观的角度了解物质及其变化,有助于更好地认识物质的组成和变化的本质。
I.
(1)下表为部分元素的原子结构示意图:
①表中硫元素的核电荷数x=___________ 。
②R3+离子与氖原子的核外电子排布相同,则R元素为___________ 元素(填元素名称)。
③一个水分子中所含电子总数为___________ 。
④硫元素与氧元素的化学性质相似的原因是___________ 。
(2)甲和乙在一定条件下反应生成丙和丁,反应的微观模型如图所示。

①该反应的生成物中,属于氧化物的是___________ (填化学式)
②每个甲分子是由___________ 构成的。
③参加反应的甲和乙分子个数比为___________ 。
(3)如图是稀硫酸与甲溶液发生复分解反应的微观模型,请写出一种符合图示的a微粒的符号:___________ 。

II.人们在实验研究中总结出常见金属的活动性顺序:

(4)请在表中 内填写对应的元素符号
内填写对应的元素符号___________ 。
(5)Mg、Sn、Pb、Cu、Ag五种金属,能与稀盐酸(或稀硫酸)发生置换反应的金属有___________ 种;写出其中最活泼的金属与稀盐酸反应的化学方程式___________ 。
I.
(1)下表为部分元素的原子结构示意图:
| 元素名称 | 氢 | 氧 | 氟 | 氖 | 钠 | 硫 | 氯 |
| 原子结构示意图 | 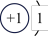 |  | 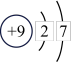 | 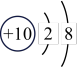 |  | 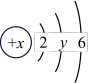 |  |
②R3+离子与氖原子的核外电子排布相同,则R元素为
③一个水分子中所含电子总数为
④硫元素与氧元素的化学性质相似的原因是
(2)甲和乙在一定条件下反应生成丙和丁,反应的微观模型如图所示。

①该反应的生成物中,属于氧化物的是
②每个甲分子是由
③参加反应的甲和乙分子个数比为
(3)如图是稀硫酸与甲溶液发生复分解反应的微观模型,请写出一种符合图示的a微粒的符号:

II.人们在实验研究中总结出常见金属的活动性顺序:

(4)请在表中
 内填写对应的元素符号
内填写对应的元素符号(5)Mg、Sn、Pb、Cu、Ag五种金属,能与稀盐酸(或稀硫酸)发生置换反应的金属有
您最近一年使用:0次
名校
5 . 完成以下离子方程式:
(1)向酸性高锰酸钾溶液中加入草酸溶液_______ 。
(2)向硫酸铝铵溶液中加入过量的氢氧化钡溶液_______ 。
(3)用亚硫酸钠溶液吸收少量氯气_______ 。
(4)泡沫灭火器的工作原理_______ 。
(5)向氯化镁溶液中滴加碳酸钠溶液,生成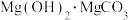
_______ 。
(1)向酸性高锰酸钾溶液中加入草酸溶液
(2)向硫酸铝铵溶液中加入过量的氢氧化钡溶液
(3)用亚硫酸钠溶液吸收少量氯气
(4)泡沫灭火器的工作原理
(5)向氯化镁溶液中滴加碳酸钠溶液,生成
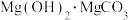
您最近一年使用:0次
2023-09-22更新
|
126次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题
名校
解题方法
6 . 回答下列问题:
Ⅰ.双氧水和“84”消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究 的性质,能证明
的性质,能证明 有还原性的实验是
有还原性的实验是___________ (填序号),可作为证据的实验现象是___________ (填字母序号)。
(2)某届奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是 与
与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO___________  (填“>”或“<”);当有
(填“>”或“<”);当有 生成时,转移电子的物质的量为
生成时,转移电子的物质的量为___________ mol。
Ⅱ.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为,还含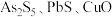 和
和 等;浸出液主要含盐酸和
等;浸出液主要含盐酸和 ,还含
,还含 和
和 等。
等。

(3)“酸浸”过程中 和
和 反应有S生成,该反应的还原产物是
反应有S生成,该反应的还原产物是___________ (填化学式)。
(4)写出“还原”反应的化学方程式___________ 。
Ⅰ.双氧水和“84”消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究
 的性质,能证明
的性质,能证明 有还原性的实验是
有还原性的实验是| 序号 | 实验 | 实验现象 |
| 1 | 向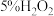 溶液中滴加酸性 溶液中滴加酸性 溶液 溶液 | a.溶液紫色褪去; b.有大量气泡产生 |
| 2 | 向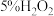 溶液中滴加淀粉—碘化钾溶液 溶液中滴加淀粉—碘化钾溶液 | c.溶液变蓝 |
 与
与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO (填“>”或“<”);当有
(填“>”或“<”);当有 生成时,转移电子的物质的量为
生成时,转移电子的物质的量为Ⅱ.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为,还含
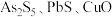 和
和 等;浸出液主要含盐酸和
等;浸出液主要含盐酸和 ,还含
,还含 和
和 等。
等。
(3)“酸浸”过程中
 和
和 反应有S生成,该反应的还原产物是
反应有S生成,该反应的还原产物是(4)写出“还原”反应的化学方程式
您最近一年使用:0次
2023-09-10更新
|
174次组卷
|
2卷引用:黑龙江省鸡西实验学校2023-2024学年高三上学期开学化学试题
名校
解题方法
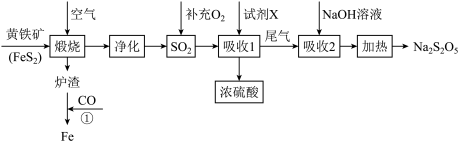
7 . 工业上以黄铁矿(主要成分FeS2)为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如图所示:
已知: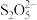 与
与 反应生成沉淀,与盐酸反应生成SO2。
反应生成沉淀,与盐酸反应生成SO2。
回答下列问题:
(1)为了加快黄铁矿煅烧的速率,可采取的措施为___________ (写出1种即可)。
(2)煅烧过程中主要发生的反应为 ,将该反应生成的SO2通入酸性高锰酸钾溶液中,可观察到酸性高锰酸钾溶液褪色,体现了SO2的
,将该反应生成的SO2通入酸性高锰酸钾溶液中,可观察到酸性高锰酸钾溶液褪色,体现了SO2的___________ 性,发生该反应的离子方程式为___________ 。
(3)“吸收1”中试剂X是___________ 。
(4)“吸收2”后得到NaHSO3溶液,加热后得Na2S2O5和水,写出加热反应的化学方程式___________ 。
(5)Na2S2O5在保存过程中易变质生成Na2SO4.欲检验Na2S2O5是否变质的具体实验操作方法为:___________ 。
(6)某企业利用下列流程综合处理工厂排放的含SO2的烟气,以减少其对环境造成的污染。该流程中可循环利用的物质为___________ (填化学式)。图中的氨气来源于工业生产,而实验室制取NH3的方法与其不同,写出实验室制取氨气的化学方程式___________ 。


已知:
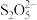 与
与 反应生成沉淀,与盐酸反应生成SO2。
反应生成沉淀,与盐酸反应生成SO2。回答下列问题:
(1)为了加快黄铁矿煅烧的速率,可采取的措施为
(2)煅烧过程中主要发生的反应为
 ,将该反应生成的SO2通入酸性高锰酸钾溶液中,可观察到酸性高锰酸钾溶液褪色,体现了SO2的
,将该反应生成的SO2通入酸性高锰酸钾溶液中,可观察到酸性高锰酸钾溶液褪色,体现了SO2的(3)“吸收1”中试剂X是
(4)“吸收2”后得到NaHSO3溶液,加热后得Na2S2O5和水,写出加热反应的化学方程式
(5)Na2S2O5在保存过程中易变质生成Na2SO4.欲检验Na2S2O5是否变质的具体实验操作方法为:
(6)某企业利用下列流程综合处理工厂排放的含SO2的烟气,以减少其对环境造成的污染。该流程中可循环利用的物质为

您最近一年使用:0次
10-11高三·山东聊城·阶段练习
名校
解题方法
8 . 高铁酸钾(K2FeO4)是一种既能杀菌消毒又能絮凝净水的水处理剂。工业制备高铁酸钾反应的离子方程式为Fe(OH)3+ClO-+OH-→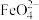 +Cl-+H2O(未配平)。下列有关说法不正确的是
+Cl-+H2O(未配平)。下列有关说法不正确的是
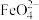 +Cl-+H2O(未配平)。下列有关说法不正确的是
+Cl-+H2O(未配平)。下列有关说法不正确的是| A.上述反应中氧化剂和还原剂的物质的量之比为3:2 |
| B.高铁酸钾中铁显+6价 |
C.由上述反应可知,Fe(OH)3的氧化性强于FeO |
| D.K2FeO4处理水时,不仅能杀菌消毒,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质 |
您最近一年使用:0次
2023-08-23更新
|
431次组卷
|
26卷引用:黑龙江省黑河市第九中学2023-2024学年高三上学期摸底考试化学试题
黑龙江省黑河市第九中学2023-2024学年高三上学期摸底考试化学试题福建省龙海市第二中学2019届高三年级上学期开学考化学试题【全国百强校】黑龙江省哈尔滨市第三中学校2019届高三上学期第二次调研考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高一上学期12月月考化学试题(已下线)2012届山东莘县实验高中高三第三次月考化学试卷2016届北京市通州区潞河中学高三上学期期中测试化学试卷2017届四川省泸州市泸化中学高三上10月月考化学卷新疆生产建设兵团第二中学2017-2018学年高一上学期期中考试化学试题广东省佛山市第一中学2020届高三10月月考化学试题甘肃省武威市第六中学2019-2020学年高一上学期第二次段考化学试题2020届高考化学小题狂练(全国通用版)专练5 氧化还原反应福建省永春第一中学2018-2019学年高二下学期期末考试化学试题内蒙古包钢第一中学2020届高三上学期10月月考化学试题山东省潍坊第四中学2021-2022学年高三上学期10月月考化学试题山东省潍坊市昌乐二中2021-2022学年高三10月月考化学试题(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)辽宁省沈阳市新民市第一高级中学2021-2022学年高三上学期第二次阶段测试化学试题浙江省杭州地区(含周边)重点中学2022-2023学年高一上学期期中考试化学试卷【2022】【高一上】【杭师大附中】【期中考】【高中化学】【徐外兰收集】(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(选择题1-5)(已下线)第二章 单元测试卷河北省衡水市武强中学2023-2024学年高一上学期期中考试化学试题河北省石家庄精英中学2023-2024学年高一上学期期中考试化学试题福建省福州高新区第一中学(闽侯县第三中学)2023-20024学年高三上学期第一次月考化学试题河南省郑州市第四高级中学2023-2024学年高一上学期第二次月考 化学试题陕西省兴平市南郊高级中学2023-2024学年高一上学期第三次化学质量检测题
9 . 铁是人类较早使用的金属之一,运用铁及其化合物的知识,完成下列问题。印刷电路板(PCB)是用腐蚀液(FeCl3溶液)将覆铜板上的部分铜腐蚀掉而制得。一种制作PCB 并将腐蚀后废液(其中金属阳离子主要含 Fe3+、Cu2+、Fe2+ )回收再生的流程如图。
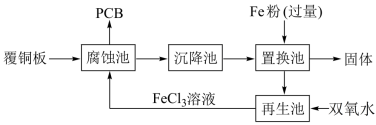
(1)腐蚀池中发生反应的化学方程式是_______ 。
(2)上述各池中,没有发生化学变化的是_______ 池。
(3)由置换池中得到固体的操作名称是_______ 。
(4)向再生池中通入Cl2也可以使废液再生,请写出通入氯气后再生池中发生的离子方程式:_______ 。相比Cl2,用双氧水的优点是_______ 。
(5)若取少量循环使用的氯化铁溶液于烧杯中,同时加入铁粉和铜粉。反应结束后,下列结果不可能出现的是_______。(填写编号)

(1)腐蚀池中发生反应的化学方程式是
(2)上述各池中,没有发生化学变化的是
(3)由置换池中得到固体的操作名称是
(4)向再生池中通入Cl2也可以使废液再生,请写出通入氯气后再生池中发生的离子方程式:
(5)若取少量循环使用的氯化铁溶液于烧杯中,同时加入铁粉和铜粉。反应结束后,下列结果不可能出现的是_______。(填写编号)
| A.有铜无铁 | B.有铁无铜 | C.铁、铜都有 | D.铁、铜都无 |
您最近一年使用:0次
10 . 数形结合思想是化学科的重要思维模式,请结合所学知识和图像作答:
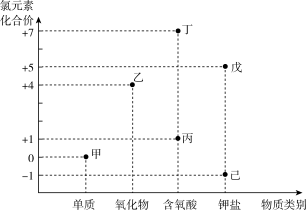
(1)如图为含氯元素物质的“价类二维图”,下列说法正确的是______ 。
(2)某实验小组向100mLFeI2液中通入Cl2,溶液中Fe3+、I2的物质的量随通入的Cl2的物质的量变化如图所示(不考虑与水的反应)。请回答下列问题:
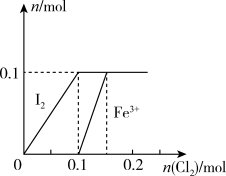
当通入Cl2的物质的量n(Cl2)=0.12mol时,溶液中: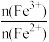 =
=______ ;通入足量氯气反应的化学方程式为______ 。
(3)烟气脱硫一体化技术是大气污染防治研究的热点,ClO2是性能优良的脱硫试剂,在强酸性条件下稳定。
①ClO 也是性能优良的脱硫试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,写出该反应的离子方程式:
也是性能优良的脱硫试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,写出该反应的离子方程式:______ 。
②某研究小组用ClO2进行脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图。
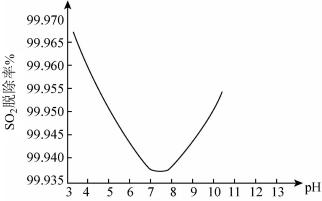
当3<pH<7时,随pH的增大,SO2脱除率逐渐降低,其原因是______ ;在pH约7.8之后,随pH的增大,SO2脱除率又开始升高,其原因是______ 。
(4)某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480mL含NaClO25%,密度为1.19g/cm3的消毒液。下列说法正确的是______ 。
A.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
B.所配得的NaClO消毒液在空气中光照,久置后溶液中NaClO的物质的量浓度减小
C.需要称量的NaClO固体的质量为140g
D.定容时俯视刻度线,会使配制溶液浓度偏高
E.上下颠倒摇匀后发现溶液凹液面低于刻度线,应再加水至刻度线
(1)如图为含氯元素物质的“价类二维图”,下列说法正确的是

| A.乙、丁均属于电解质 |
| B.丙的酸性强于碳酸 |
| C.乙是一种广谱型的消毒剂,可取代甲成为自来水的消毒剂 |
| D.戊→己必须加还原剂才能实现 |

当通入Cl2的物质的量n(Cl2)=0.12mol时,溶液中:
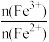 =
=(3)烟气脱硫一体化技术是大气污染防治研究的热点,ClO2是性能优良的脱硫试剂,在强酸性条件下稳定。
①ClO
 也是性能优良的脱硫试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,写出该反应的离子方程式:
也是性能优良的脱硫试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,写出该反应的离子方程式:②某研究小组用ClO2进行脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图。

当3<pH<7时,随pH的增大,SO2脱除率逐渐降低,其原因是
(4)某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480mL含NaClO25%,密度为1.19g/cm3的消毒液。下列说法正确的是
A.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
B.所配得的NaClO消毒液在空气中光照,久置后溶液中NaClO的物质的量浓度减小
C.需要称量的NaClO固体的质量为140g
D.定容时俯视刻度线,会使配制溶液浓度偏高
E.上下颠倒摇匀后发现溶液凹液面低于刻度线,应再加水至刻度线
您最近一年使用:0次
2023-02-18更新
|
114次组卷
|
3卷引用:黑龙江省齐齐哈尔市讷河市第二中学等3校2022-2023学年高一下学期开学考试化学试题



