1 . 钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿制备NH4VO3。
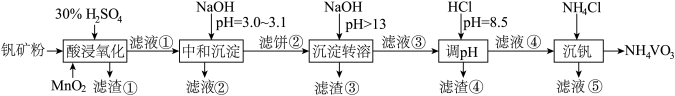
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“酸浸氧化”需要加热,其原因是___________ 。
(2)“酸浸氧化”中,VO+和VO2+被氧化成 ,同时还有
,同时还有___________ 离子被氧化。写出VO+转化为 反应的离子方程式
反应的离子方程式___________ 。
(3)“中和沉淀”中,钒水解并沉淀为 ,随滤液②可除去金属离子K+、Mg2+、Na+、
,随滤液②可除去金属离子K+、Mg2+、Na+、___________ ,以及部分的___________ 。
(4)“沉淀转溶”中,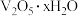 转化为钒酸盐溶解。滤渣③的主要成分是
转化为钒酸盐溶解。滤渣③的主要成分是___________ 。
(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是___________ 。
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是___________ 。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
| 开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 | 10.1 |
(1)“酸浸氧化”需要加热,其原因是
(2)“酸浸氧化”中,VO+和VO2+被氧化成
 ,同时还有
,同时还有 反应的离子方程式
反应的离子方程式(3)“中和沉淀”中,钒水解并沉淀为
 ,随滤液②可除去金属离子K+、Mg2+、Na+、
,随滤液②可除去金属离子K+、Mg2+、Na+、(4)“沉淀转溶”中,
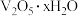 转化为钒酸盐溶解。滤渣③的主要成分是
转化为钒酸盐溶解。滤渣③的主要成分是(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是
您最近一年使用:0次
2020-07-08更新
|
23867次组卷
|
33卷引用:黑龙江省大庆铁人中学2022-2023学年高三上学期开学考试化学试题
黑龙江省大庆铁人中学2022-2023学年高三上学期开学考试化学试题河南省三门峡市第一高级中学2021届高三8月开学考试化学试题福建省福州市第一中学2021届高三上学期开学质检化学试题湖北省名校联盟2021届高三下学期开学考试(新高考)化学试题四川省成都市简阳实验学校2023-2024学年高三下学期开学考试理科综合试题-高中化学2020年全国统一考试化学试题(新课标Ⅰ)(已下线)专题15 工艺流程题-2020年高考真题和模拟题化学分项汇编(已下线)第三单元 金属及其化合物测试题-2021年高考化学一轮复习名师精讲练(已下线)专题14 无机化工流程不丢分-2021年高考化学必做热点专题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)重点8 工艺流程综合题-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)重点4 无机化工流程分析-2021年高考化学专练【热点·重点·难点】(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)(已下线)押山东卷第16题 化工流程综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)专题讲座(六)化工流程的解题策略(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)新疆生产建设兵团第九师龙珍高级中学2021-2022学年高三上学期第一次月考化学试题(已下线)2021年高考全国乙卷化学试题变式题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)2020年全国卷Ⅰ理综化学高考真题变式题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)微专题17 热点金属及其化合物制备流程(V、Cr、Mn、Co、Ni)-备战2023年高考化学一轮复习考点微专题(已下线)微专题28 有关工艺流程和实验探究方程式的书写-备战2023年高考化学一轮复习考点微专题山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题四川省雅安中学2022-2023学年高二下学期3月月考化学试题(已下线)04 无机化工流程题(4) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)微专题 无机化工流程题的解题策略
2 . 某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl- 几种微粒,其中N2、ClO- 的物质的量随时间变化的曲线如图所示。下列说法正确的是


| A.该反应中Cl- 为氧化产物 |
| B.消耗1 mol还原剂,转移3 mol电子 |
| C.反应后溶液的碱性增强 |
| D.该反应氧化剂与还原剂物质的量之比为2:3 |
您最近一年使用:0次
2020-05-19更新
|
193次组卷
|
4卷引用:黑龙江省哈尔滨师范大学附属中学2020-2021学年高三上学期开学考试化学试题
黑龙江省哈尔滨师范大学附属中学2020-2021学年高三上学期开学考试化学试题天津市南开区2020届高三上学期期末考试化学试题(已下线)小题必刷07 氧化还原反应概念及应用——2021年高考化学一轮复习小题必刷(通用版)河北省衡水市武强中学2021届高三上学期第二次月考化学试题
名校
解题方法
3 . 氧化铬绿(Cr2O3)的性质独特,在冶金、颜料等领域有着不可替代的地位。一种利用淀粉水热还原铬酸钠(Na2CrO4)制备氧化铬绿的工艺流程如下:

已知:①向含少量 Na2 CO3的铬酸钠碱性溶液中通入CO 2可制得不同碳化率的铬酸钠碳化母液;
②“还原”反应剧烈放热,可制得 Cr(OH) 3浆料。
(1)铬酸钠(Na2CrO4)中铬元素的价态是________ ,该工艺中“还原”反应最初使用的是蔗糖或甲醛,请写出甲醛的电子式:________________ ,后来改用价格低廉的淀粉。请写出甲醛(HCHO)与铬酸钠(Na2CrO4)溶液反应的离子方程式___________________________ 。
(2)将混合均匀的料液加入反应釜,密闭搅拌,恒温发生“还原”反应,下列有关说法错误的是____________ (填标号)。
A.该反应一定无需加热即可进行 B.必要时可使用冷却水进行温度控制
C.铬酸钠可适当过量,使淀粉充分反应 D.应建造废水回收池,回收含铬废水
(3)测得反应完成后在不同恒温温度、不同碳化率下 Cr(Ⅵ)还原率如下图。实际生产过程中 Cr(Ⅵ)还原率可高达 99.5%以上,“还原”阶段采用的最佳反应条件为________________ 。

(4)滤液中所含溶质为_________________ 。该水热法制备氧化铬绿工艺的优点有________________ 、___ (请写出两条)。
(5)重铬酸钠(Na2Cr2O7·H2O)与硫酸铵热分解法也是一种生产氧化铬绿的方法,生产过程中产生的气体对环境无害,其化学反应方程式为______________________________ 。

已知:①向含少量 Na2 CO3的铬酸钠碱性溶液中通入CO 2可制得不同碳化率的铬酸钠碳化母液;
②“还原”反应剧烈放热,可制得 Cr(OH) 3浆料。
(1)铬酸钠(Na2CrO4)中铬元素的价态是
(2)将混合均匀的料液加入反应釜,密闭搅拌,恒温发生“还原”反应,下列有关说法错误的是
A.该反应一定无需加热即可进行 B.必要时可使用冷却水进行温度控制
C.铬酸钠可适当过量,使淀粉充分反应 D.应建造废水回收池,回收含铬废水
(3)测得反应完成后在不同恒温温度、不同碳化率下 Cr(Ⅵ)还原率如下图。实际生产过程中 Cr(Ⅵ)还原率可高达 99.5%以上,“还原”阶段采用的最佳反应条件为

(4)滤液中所含溶质为
(5)重铬酸钠(Na2Cr2O7·H2O)与硫酸铵热分解法也是一种生产氧化铬绿的方法,生产过程中产生的气体对环境无害,其化学反应方程式为
您最近一年使用:0次
名校
4 . NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:下列有关说法不正确的是


| A.NaClO2中Cl的化合价+3价 |
| B.“反应”步骤中生成ClO2的化学方程式2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4 |
| C.“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为NaOH溶液和Na2CO3溶液 |
| D.“尾气吸收”是吸收“电解”过程排出的少量ClO2,反应中,氧化剂与还原剂的物质的量之比为1:2 |
您最近一年使用:0次
2020-04-01更新
|
480次组卷
|
5卷引用:黑龙江省大庆实验中学2021届高三8月开学考试化学试题
黑龙江省大庆实验中学2021届高三8月开学考试化学试题山西省运城市2020届高三上学期期末调研测试 化学广东省广州市执信中学2021届高三第二次联考化学试题(已下线)第12讲 富集在海水中的元素——卤素(精讲)-2022年一轮复习讲练测湖北省孝感市普通高中2021-2022学年高三上学期期中联考化学试题
5 . 由含碘废水制取碘酸钾的一种工艺如下:

(1)H2O2的结构式为___ 。“制I2”过程中加入的硫酸不能过多的原因是_____ 。
(2)制CuI(s)步骤反应的离子方程式为_________ 。
(3)工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制___ ”。
(4)“制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于________ 。
(5)“制KIO3溶液”反应的离子方程式为______ 。

(6)KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为____ 。

(1)H2O2的结构式为
(2)制CuI(s)步骤反应的离子方程式为
(3)工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制
(4)“制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于
(5)“制KIO3溶液”反应的离子方程式为

(6)KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为
您最近一年使用:0次
2020-03-05更新
|
333次组卷
|
3卷引用:黑龙江省大庆实验中学2020届高三下学期开学考试理综化学试题
黑龙江省大庆实验中学2020届高三下学期开学考试理综化学试题江西省南昌市新建二中2020 届高三第三次线上考试理综 I卷化学试题(已下线)考点17 化工生产诸要素及流程图分析-2020年高考化学命题预测与模拟试题分类精编
6 . NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒.已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.
(1)上述反应中氧化剂是___________ .
(2)根据上述反应,鉴别NaNO2和NaCl.可选用的物质有:①碘化钾淀粉试纸、②淀粉、③白酒、④食醋,你认为必须选用的物质有__________ (填序号).
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________ (填编号).
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平化学方程式:___ Al+___ NaNO3+___ NaOH═___ NaAlO2+___ N2↑+___ H2O.
若反应过程中转移5 mol e-,则生成标准状况下N2的体积为________ .
(1)上述反应中氧化剂是
(2)根据上述反应,鉴别NaNO2和NaCl.可选用的物质有:①碘化钾淀粉试纸、②淀粉、③白酒、④食醋,你认为必须选用的物质有
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平化学方程式:
若反应过程中转移5 mol e-,则生成标准状况下N2的体积为
您最近一年使用:0次
2020-01-12更新
|
138次组卷
|
6卷引用:2016届黑龙江省哈尔滨师大附中高三上开学考试化学试卷
7 . “银针验毒”在我国有上千年历史,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为4Ag+2H2S+O2=2Ag2S+2H2O。当银针变色后,将其置于盛有食盐水的铝制容器中一段时间后便可复原。以下说法不正确的是
| A.当银针变黑时,所检验的物质有毒 |
| B.银针验毒时,Ag被氧化 |
| C.上述验毒反应的氧化产物和还原产物的物质的量之比为1:1 |
| D.银针复原发生的反应可能为3Ag2S+2Al=6Ag+Al2S3 |
您最近一年使用:0次
2019-12-20更新
|
162次组卷
|
7卷引用:【全国百强校】黑龙江省哈尔滨师范大学附属中学2019届高三上学期开学考试化学试题
名校
解题方法
8 . 利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:

(1)“酸溶”时,Fe2O3与硫酸反应的离子方程式为___________________________ 。
(2)滤渣Ⅰ的主要成分是FeS2、S和________ (填化学式);Fe3+被FeS2还原的离子方程式为_______________ 。
(3)“氧化”中,生成FeOOH的离子方程式为________________ 。
(4)滤液Ⅱ中溶质是Al2(SO4)3和________ (填化学式):“洗涤”时,检验铁黄表面已洗涤干净的操作是___ 。

(1)“酸溶”时,Fe2O3与硫酸反应的离子方程式为
(2)滤渣Ⅰ的主要成分是FeS2、S和
(3)“氧化”中,生成FeOOH的离子方程式为
(4)滤液Ⅱ中溶质是Al2(SO4)3和
您最近一年使用:0次
2019-12-12更新
|
451次组卷
|
7卷引用:黑龙江省龙西北八校联合体2022-2023学年高三上学期开学考试化学试题
黑龙江省龙西北八校联合体2022-2023学年高三上学期开学考试化学试题河南省郑州市第一中学2017-2018学年高一下学期入学考试化学试题四川省树德中学2018届高一下学期开学考试化学试题2015届江苏省苏锡常镇四市高三教学情况调研(二)化学试卷(已下线)考点04 离子反应——《备战2020年高考精选考点专项突破题集》2020届高三化学一轮复习 工业流程图(以氧化还原反应离子反应为主)(已下线)第3单元 离子反应(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷
9 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,可用作食品保鲜剂(不直接加入食品中,安全、卫生),还可用于纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇。在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
(1)Na2S2O4用于保鲜剂时能去除O2,先生成Na2SO3并缓慢释放SO2,该反应的化学方程式为________ 。
(2)锌粉法制备Na2S2O4的工艺流程如图所示:

①实验室可用浓硫酸和亚硫酸钠反应制取SO2,并希望能控制反应速度,图中可选用的发生装置是________ (填字母)。

②工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是_______ 。步骤Ⅱ中发生反应的化学方程式为___ 。
③在步骤.中得到的Na2S2O4固体要用乙醇洗涤,其优点是_______ 。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙 醇水溶液液中,然后通入SO2发生反应,有CO2气体放出,总反应的化学方程式是___________ 。
(4)连二亚硫酸钠的分析检测。铁氰化钾法:铁氰化钾K3[Fe(CN)6]是一种比较弱的氧化剂,其具有强氧化剂所没有的选择性氧化性,能将S2O42-氧化为SO32-,[Fe(CN)6]3-还原为[Fe(CN)6]4-。取50.00mLNa2S2O4样品溶液,用0.02mol•L-1的K3[Fe(CN)6]标准液滴定至终点,消耗10.00mL。该样品中Na2S2O4的含量为_______ g•L-1。(以SO2计)
(1)Na2S2O4用于保鲜剂时能去除O2,先生成Na2SO3并缓慢释放SO2,该反应的化学方程式为
(2)锌粉法制备Na2S2O4的工艺流程如图所示:

①实验室可用浓硫酸和亚硫酸钠反应制取SO2,并希望能控制反应速度,图中可选用的发生装置是

②工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是
③在步骤.中得到的Na2S2O4固体要用乙醇洗涤,其优点是
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙 醇水溶液液中,然后通入SO2发生反应,有CO2气体放出,总反应的化学方程式是
(4)连二亚硫酸钠的分析检测。铁氰化钾法:铁氰化钾K3[Fe(CN)6]是一种比较弱的氧化剂,其具有强氧化剂所没有的选择性氧化性,能将S2O42-氧化为SO32-,[Fe(CN)6]3-还原为[Fe(CN)6]4-。取50.00mLNa2S2O4样品溶液,用0.02mol•L-1的K3[Fe(CN)6]标准液滴定至终点,消耗10.00mL。该样品中Na2S2O4的含量为
您最近一年使用:0次
2019-12-01更新
|
318次组卷
|
3卷引用:黑龙江省实验中学2020届高三下学期开学考试理综化学试题
名校
10 . 下列离子方程式的书写及评价均正确的是( )
| 选项 | 离子方程式 | 评价 |
| A | 将1molCl2通入到含1molFeI2溶液中: 2Fe2++2I﹣+2Cl2═2Fe3++4Cl﹣+I2 | 正确;Cl2过量,可将Fe2+、I﹣均氧化 |
| B | 1mol•L﹣1的NaAlO2溶液和2.5 mol•L﹣1的HCl溶液等体积互相均匀混合: 2AlO2﹣+5H+═Al3++Al(OH)3↓+H2O | 正确;AlO2﹣与Al(OH)3消耗的H+的物质的量之比为2:3 |
| C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO﹣═HClO+HSO3﹣ | 正确;说明酸性:H2SO3强于HClO |
| D | Ca(HCO3)2溶液与足量的NaOH溶液反应:Ca2++HCO3﹣+OH﹣═CaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-11-23更新
|
1511次组卷
|
18卷引用:【全国百强校】黑龙江省牡丹江市第一高级中学2019届高三上学期开学摸底考试化学试题1
【全国百强校】黑龙江省牡丹江市第一高级中学2019届高三上学期开学摸底考试化学试题1【全国百强校】黑龙江省牡丹江市第一高级中学2019届高三上学期开学摸底考试化学试题2【全国百强校】黑龙江省哈尔滨市第三中学校2019届高三上学期第二次调研考试化学试题江西省师范大学附属中学2018届高三10月月考化学试题江西省赣州寻乌县二中2018届高三上学期期中考试化学试卷辽宁省丹东市2018届高三一模考试理综-化学试题【全国校级联考】山东省七校联合体2018届高三第二次联考理科综合化学试题广东省惠州市燕岭学校2019届高三8月月考化学试题【全国百强校】河北省武邑中学2019届高三上学期第一次调研考试化学试题辽宁省葫芦岛协作校2019届高三上学期第一次月考化学试题山东省泰安市第一中学2020届高三10月月考化学试题山东省莱州市第一中学2020届高三10月月考化学试题山东省泰安市宁阳县第一中学2020届高三上学期第二次段考化学试题辽宁省大连海湾高级中学2019-2020学年高三上学期期中考试化学试题安徽省宿州市灵璧中学2019-2020学年度高三上学期第三次月考化学试题(已下线)专题2.2 离子反应-巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》(已下线)考点04 离子反应-2020年高考化学命题预测与模拟试题分类精编陕西省西安市长安区第一中学2021届高三上学期第二次月考化学试题



