名校
1 . 钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。
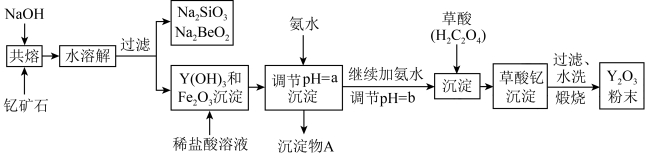
已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)写出Na2SiO3的一种用途________________________ 。
(2)若改用氧化物的形式表示Y2FeBe2Si2O10组成,则化学式为__________ 。
(3)根据元素周期表的知识判断,常温下,氯化锶溶液pH____ 7(填“大于”、“等于”或“小于”);写出氯化锶的电子式:______________________ 。
(4)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和_______ 两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式___________________________ 。
(5)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________ 范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________ ;检验Fe3+是否沉淀完全的操作方法是:___________________________________ 。
(6)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式___________________________________ 。

已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.1 | 3.1 |
| Y3+ | 6.0 | 8.2 |
(1)写出Na2SiO3的一种用途
(2)若改用氧化物的形式表示Y2FeBe2Si2O10组成,则化学式为
(3)根据元素周期表的知识判断,常温下,氯化锶溶液pH
(4)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式
(5)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在
(6)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式
您最近一年使用:0次
名校
2 . 用含有少量SiO2、Fe2O3杂质的辉铜矿(主要成分Cu2S)和软锰矿(主要成分MnO2),制备碱式碳酸铜,可进一步制取有机合成中的催化剂氯化亚铜(CuCl),其主要工艺流程如图:

已知:①MnO2能氧化硫化物生成S;
②部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示:
③CuCl是一种白色粉末,难溶于水,可溶于氯离子浓度较大的体系。
(1)浸出液中含有CuSO4和MnSO4等主要产物,写出生成该主要产物的化学方程式:_______ 。
(2)实验室中用18.4mol/L的浓硫酸配制480mL4.5mol/L的硫酸溶液需要使用的玻璃仪器有烧杯、玻璃棒、量筒、_____ 、____ 。
(3)沉淀物的主要成分是______ 。
(4)结合已知条件,实验室中若选用饱和Na2CO3溶液(pH约为12)和MnSO4溶液作为反应原料制备MnCO3沉淀,采用的加料方式是将_______ 溶液缓慢加入到盛有______ 溶液的反应容器中。
(5)CuCl2溶液中加入Na2SO3溶液的离子反应方程式为______ 。
(6)得到的CuCl晶体需用水洗涤,洗涤CuCl晶体的操作是_____ 。
(7)CuCl晶体在碱性溶液中可以制得氧化亚铜,该反应的离子反应方程式为_______ 。

已知:①MnO2能氧化硫化物生成S;
②部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示:
| 开始沉淀pH | 沉淀完全pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)浸出液中含有CuSO4和MnSO4等主要产物,写出生成该主要产物的化学方程式:
(2)实验室中用18.4mol/L的浓硫酸配制480mL4.5mol/L的硫酸溶液需要使用的玻璃仪器有烧杯、玻璃棒、量筒、
(3)沉淀物的主要成分是
(4)结合已知条件,实验室中若选用饱和Na2CO3溶液(pH约为12)和MnSO4溶液作为反应原料制备MnCO3沉淀,采用的加料方式是将
(5)CuCl2溶液中加入Na2SO3溶液的离子反应方程式为
(6)得到的CuCl晶体需用水洗涤,洗涤CuCl晶体的操作是
(7)CuCl晶体在碱性溶液中可以制得氧化亚铜,该反应的离子反应方程式为
您最近一年使用:0次
11-12高三上·浙江湖州·期中
名校
3 . 水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O +O2+xOH﹣═Fe3O4+S4O
+O2+xOH﹣═Fe3O4+S4O +2H2O,下列说法错误的是
+2H2O,下列说法错误的是
 +O2+xOH﹣═Fe3O4+S4O
+O2+xOH﹣═Fe3O4+S4O +2H2O,下列说法错误的是
+2H2O,下列说法错误的是| A.每生成1mol Fe3O4,反应转移的电子总数为4NA |
B.Fe2+和S2O 都是还原剂 都是还原剂 |
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为 mol mol |
| D.x=4 |
您最近一年使用:0次
2019-08-02更新
|
367次组卷
|
14卷引用:黑龙江省哈尔滨师范大学青冈实验中学校2020届高三上学期开学考试(8月)化学试题
黑龙江省哈尔滨师范大学青冈实验中学校2020届高三上学期开学考试(8月)化学试题(已下线)2012届浙江省湖州市菱湖中学高三上学期期中考试化学试卷(已下线)2012届浙江省富阳市新登中学高三上学期期中考试化学试卷(已下线)2013届广西南宁三中高三下学期二模理科综合化学试卷2016届福建省仙游一中高三上学期10月月考化学试卷2016届福建省厦门双十中学高三上学期期中测试化学试卷2016届浙江省舟山中学高三上学期期中考试化学试卷2016届福建省连江县尚德中学高三上学期12月月考化学试卷2017届江西省新余一中、宜春一中高三7月联考化学试题2016-2017学年江西省吉安一中高一上段考二化学试卷安徽省定远重点中学2018-2019学年高一上学期第三次月考化学试题辽宁省锦州市2018-2019学年高二下学期期末考试化学试题甘肃省武威第六中学2021届高三上学期第二次过关考试化学试题江西省吉安市第三中学2022-2023学年高三上学期12月月考化学试题
2019高三下·全国·专题练习
名校
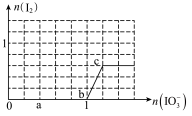
4 . 向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随通入Cl2的物质的量n(Cl2)的变化如图所示,下列说法不正确的是
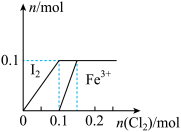

| A.氧化性强弱:I2<Fe3+< IO3- |
| B.n(Cl2)=0.12 mol时,溶液中的离子主要有:Fe2+、Fe3+、Cl− |
| C.若n(Cl2)∶n(FeI2)=6∶5,反应的离子方程式为2Fe2++10I−+6Cl2=5I2+2Fe3++12Cl− |
| D.若n(Cl2)∶n(FeI2)=2∶1,反应的离子方程式为2Fe2++4I−+3Cl2=2I2+2Fe3++6Cl− |
您最近一年使用:0次
2019-07-07更新
|
467次组卷
|
3卷引用:黑龙江省哈尔滨师范大学青冈实验中学校2020届高三上学期开学考试(8月)化学试题
黑龙江省哈尔滨师范大学青冈实验中学校2020届高三上学期开学考试(8月)化学试题(已下线)2019年7月13日 《每日一题》2020年高考一轮复习-周末培优重庆市秀山高级中学校2021届高三上学期9月月考化学试题
5 . 不能 正确表示下列变化的离子方程式是
A.二氧化硫与酸性高锰酸钾溶液反应:5SO2+2H2O+2MnO4- 2Mn2++5SO 2Mn2++5SO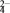 +4H+ +4H+ |
B.酸性碘化钾溶液中滴加适量双氧水:2I−+2H++H2O2 I2+2H2O I2+2H2O |
C.硅酸钠溶液和盐酸反应:SiO32-+2H+ H2SiO3↓ H2SiO3↓ |
D.硫酸铜溶液中加少量的铁粉:3Cu2++2Fe 2Fe3++3Cu 2Fe3++3Cu |
您最近一年使用:0次
2019-04-12更新
|
5503次组卷
|
17卷引用:黑龙江省佳木斯市第十二中学2022-2023学年高三上学期开学考试化学试题
黑龙江省佳木斯市第十二中学2022-2023学年高三上学期开学考试化学试题浙江省瑞安市上海新纪元高级中学2019-2020学年高一(7-10)班下学期期初考试化学试题2019年4月浙江省普通高校招生选考科目考试化学试题(已下线)专题03 离子反应——2019年高考真题和模拟题化学分项汇编(已下线)专题2.2 离子反应 离子共存及检验(练)-《2020年高考一轮复习讲练测》2019年秋高三化学复习强化练习—— 离子反应方程式及离子共存(已下线)专题五 离子反应(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训天津市北辰区2020届高三高考模拟(二模)化学试题(已下线)小题必刷03 电解质与离子方程式——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷06 与量有关的离子方程式书写——2021年高考化学一轮复习小题必刷(通用版)(已下线)专题04.离子反应-十年(2012-2021)高考化学真题分项汇编(浙江专用)浙江省杭州学军中学2021-2022学年高三上学期12月适应性考试化学试题(已下线)专题08 化学方程式正误判断—2022年高考化学二轮复习讲练测(全国版)-练习湖南省长沙市宁乡市2020-2021学年高二下学期期末调研考试化学试题重庆市二0三中学2021-2022学年高一下学期3月月考化学试题(已下线)专题04 离子反应(已下线)2019年高考浙江卷化学试题变式题(单选题11-15)
6 . Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色环保水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,应用广泛。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应氧化产物是_____ (填化学式)。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO−、OH−、FeO42-、Cl−、H2O。
①写出并配平碱性条件下湿法制高铁酸钾的离子反应方程式:________________________________ 。
②每生成1molFeO42-转移________ mol电子;若反应过程中转移了0.3mol电子,则还原产物的物质的量为________ mol。
Ⅱ.氧化还原反应在生产生活中应用广泛,思考回答以下问题
已知:2Fe3++2I−===2Fe2++I2,2Fe2++Br2===2Fe3++2Br−,2Fe2++Cl2===2Fe3++2Cl−
(1)含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是________ 。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,当Br−被氧化一半时,c为_______________ (用含a、b的代数式表示)。
(3)已知:S2O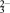 具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I−+S4O62-,S2O82-+2I−→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:
具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I−+S4O62-,S2O82-+2I−→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:____________ 。
(4)已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-;向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示。
写出a点处还原产物是_______________ ;b点到c点反应的离子方程式________________
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应氧化产物是
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO−、OH−、FeO42-、Cl−、H2O。
①写出并配平碱性条件下湿法制高铁酸钾的离子反应方程式:
②每生成1molFeO42-转移
Ⅱ.氧化还原反应在生产生活中应用广泛,思考回答以下问题
已知:2Fe3++2I−===2Fe2++I2,2Fe2++Br2===2Fe3++2Br−,2Fe2++Cl2===2Fe3++2Cl−
(1)含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,当Br−被氧化一半时,c为
(3)已知:S2O
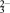 具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I−+S4O62-,S2O82-+2I−→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:
具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I−+S4O62-,S2O82-+2I−→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:(4)已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-;向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示。

写出a点处还原产物是
您最近一年使用:0次
2019-03-27更新
|
315次组卷
|
2卷引用:【全国百强校】黑龙江省哈尔滨师范大学附属中学2018-2019学年高一下学期开学考试化学试题
名校
7 . 某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)等,一种综合利用工艺设计如下:

(1)物质X的化学式为__________________
(2)“酸浸”过程中主要反应的离子方程式为:________________ ,________________
(3)“碱溶”的目的是___________________
(4)从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为:_________________________

(1)物质X的化学式为
(2)“酸浸”过程中主要反应的离子方程式为:
(3)“碱溶”的目的是
(4)从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为:
您最近一年使用:0次
名校
8 . 工业上采用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取中药药剂As2O3。工艺流程如下:

回答下列问题:
(1)“沉砷”中所用Na2S的电子式为_____________ 。
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2AsS33- ;“沉砷”中FeSO4的作用是
2AsS33- ;“沉砷”中FeSO4的作用是_____ 。
(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是___________ 。(写名称)
(4)“氧化”过程中,可以用单质碘为氧化剂进行氧化,写出该反应的离子方程式__________ 。
(5)调节pH=0时,请写出由Na3AsO4制备As2O3的离子方程式_________________ 。
(6)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为___________ 。(填化学式)


回答下列问题:
(1)“沉砷”中所用Na2S的电子式为
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)
 2AsS33- ;“沉砷”中FeSO4的作用是
2AsS33- ;“沉砷”中FeSO4的作用是(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是
(4)“氧化”过程中,可以用单质碘为氧化剂进行氧化,写出该反应的离子方程式
(5)调节pH=0时,请写出由Na3AsO4制备As2O3的离子方程式
(6)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为

您最近一年使用:0次
2019-03-10更新
|
653次组卷
|
4卷引用:【全国百强校】黑龙江省大庆中学2019届高三下学期开学考试化学试题
真题
名校
9 . NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
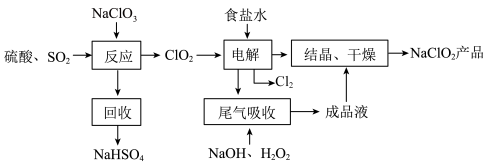
回答下列问题:
(1)NaClO2中Cl的化合价为_______ 。
(2)写出“反应”步骤中生成ClO2的化学方程式_______ 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________ 、________ 。“电解”中阴极反应的主要产物是______ 。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________ ,该反应中氧化产物是_________ 。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____ 。(计算结果保留两位小数)

回答下列问题:
(1)NaClO2中Cl的化合价为
(2)写出“反应”步骤中生成ClO2的化学方程式
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为
您最近一年使用:0次
2019-01-30更新
|
5211次组卷
|
26卷引用:黑龙江省哈尔滨市第四中学校2023-2024学年高二上学期第一次考试化学试题
黑龙江省哈尔滨市第四中学校2023-2024学年高二上学期第一次考试化学试题2015-2016学年黑龙江哈尔滨六中高二下期末化学试卷新疆第二师八一中学2022-2023学年高三上学期开学考试化学试题新疆生产建设兵团第二师八一中学2023届高三上学期开学考试化学试题2016年全国普通高等学校招生统一考试化学(新课标1卷精编版)2017届贵州省黔东南州高三下学期高考模拟考试理综化学试卷河北省武邑中学2016-2017学年高一下学期期中考试化学试题2【全国百强校】河北省武邑中学2016-2017学年高一下学期期中考试化学试题贵州省遵义航天高级中学2018届高三第二次模拟(10月)理科综合化学试题(已下线)《考前20天终极攻略》-5月28日 工艺流程分析(已下线)解密03 氧化还原反应——备战2018年高考化学之高频考点解密(已下线)学科网2019年高考化学一轮复习讲练测2.3 氧化还原反应的基本概念 练(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】福建省厦门市湖滨中学2019届高三上学期第一次阶段检测化学试题安徽省阜阳市第三中学2019届高三第一学期第二次模拟考试化学试题【全国百强校】甘肃省静宁县第一中学2019届高三上学期第二次模拟考试化学试题(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (教学案)(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)2016年全国普通高等学校招生统一考试化学(全国1卷参考版)2020届高三化学大二轮增分强化练——无机化工流程专练(已下线)专题四 氧化还原反应(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训(已下线)专题6.1 无机化工流程题(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升河北省武邑中学2016-2017学年高一下学期期中考试化学试题1云南省景东彝族自治县第一中学2021-2022学年高三下学期3月份考试化学试题(已下线)第04练 以陌生方程式的书写突破氧化还原反应-2022年【暑假分层作业】高二化学(2023届一轮复习通用)
真题
名校
10 . 若 在强热时分解的产物是
在强热时分解的产物是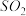 、
、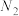 、
、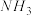 和
和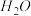 ,则该反应中化合价发生变化和未发生变化的N原子数之比为
,则该反应中化合价发生变化和未发生变化的N原子数之比为
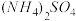 在强热时分解的产物是
在强热时分解的产物是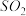 、
、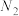 、
、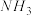 和
和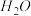 ,则该反应中化合价发生变化和未发生变化的N原子数之比为
,则该反应中化合价发生变化和未发生变化的N原子数之比为| A.1:4 | B.1:2 | C.2:1 | D.4:1 |
您最近一年使用:0次
2019-01-30更新
|
1491次组卷
|
28卷引用:黑龙江省大庆外国语学校2021-2022学年高一下学期开学考试化学试题
黑龙江省大庆外国语学校2021-2022学年高一下学期开学考试化学试题(已下线)2015届黑龙江省哈师大附中高三第一次月考化学试卷2010年普通高等学校招生统一考试理综试题化学部分(全国卷II)(已下线)2010年云南省玉溪一中高二下学期期末考试化学试题(已下线)2011-2012学年云南省玉溪一中高二上学期期中考试化学(理)试卷(已下线)2011-2012年江西省吉安一中高一上学期期中考试化学试卷(已下线)2012届福建省厦门市翔安一中高三11月份月考化学试卷(已下线)2012届山东省济宁市鱼台二中高三11月月考化学试卷(已下线)2011-2012学年四川省巴中市四县中高一上期期末联考化学试卷(已下线)2013-2014学年辽宁省抚顺市六校联合体高二下学期期末考试化学试卷2015-2016学年河北省武邑中学高一下周考化学试卷甘肃省兰州市第一中学2018届高三8月月考化学试题山西省康杰中学2018届高三上学期第一次月考化学试卷【全国百强校】内蒙古鄂尔多斯市第一中学2018-2019学年高一上学期期中考试化学试题贵州省剑河县二中2018-2019学年高二上学期期末考试化学试题河北省易县中学2018-2019学年高二下学期期末考试化学试题云南省昭通鲁甸县二中2019-2020学年高一10月月考化学试题内蒙古第一机械制造(集团)有限公司第一中学2020届高三上学期第一次月考化学试题云南省盈江县民族完全中学2019-2020学年高二上学期期末考试化学试题云南省剑川县第一中学2019-2020学年高一上学期期末考试化学试题2020年春季人教版高中化学必修1第二章《化学物质及其变化》测试卷2020届高三化学总复习考点强化练习:物质及其变化(已下线)【浙江新东方】36新疆新和县实验中学2020-2021学年高三上学期期中考试化学试题江西省九江市柴桑区第一中学2021-2022学年高三上学期第二次月考化学试题宁夏石嘴山市第三中学2021-2022学年高一上学期期末考试化学试题微专题(三)——氧化还原反应方程式的配平与书写宁夏银川市唐徕中学2023-2024学年高三上学期9月月考化学试题



