1 . (1)将SO2通入氯化钡溶液中无现象;若将SO2通入硝酸钡溶液中,有白色沉淀产生,其化学反应方程式如下(未配平):SO2+Ba(NO3)2+H2O→BaSO4↓+HNO3+NO↑
①配平上述化学反应方程式:___ 。
②该反应中,___ 元素发生氧化反应,氧化剂是___ (写化学式)。氧化产物与还原产物的物质的量之比为___ 。
③当反应消耗19.2gSO2时,反应中转移电子____ mol。
(2)维生素C又称“抗坏血酸”,能帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有___ (填氧化性或还原性)。
①配平上述化学反应方程式:
②该反应中,
③当反应消耗19.2gSO2时,反应中转移电子
(2)维生素C又称“抗坏血酸”,能帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有
您最近一年使用:0次
解题方法
2 . 按要求填空:
(1)氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一、
①氢气是清洁燃料,其燃烧产物为___________ 。
②NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为___________ ,反应消耗1 mol NaBH4时转移的电子数目为___________ 。
(2)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:___________
_____Ce3++_____ H2O2+ ___ H2O= Ce(OH)4↓+_______
(3)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是___________ 。
(4)Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+Mg=Mg2++2Ag+2Cl-
①电池的负极材料为___________ ,发生的电极反应为___________ 。
②电池正极发生的电极反应为___________ 。
(5)为减少SO2的排放,常采取的措施有:将煤转化为清洁气体燃料。已知:H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1。C(s)+
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1。C(s)+ O2(g)=CO(g) ΔH=-110.5 kJ·mol-1。写出焦炭与水蒸气反应的热化学方程式:
O2(g)=CO(g) ΔH=-110.5 kJ·mol-1。写出焦炭与水蒸气反应的热化学方程式:___________ 。
(6)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO ,常用作脱氯剂,该反应的离子方程式为
,常用作脱氯剂,该反应的离子方程式为___________ 。
(1)氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一、
①氢气是清洁燃料,其燃烧产物为
②NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为
(2)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
_____Ce3++_____ H2O2+ ___ H2O= Ce(OH)4↓+_______
(3)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是
(4)Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+Mg=Mg2++2Ag+2Cl-
①电池的负极材料为
②电池正极发生的电极反应为
(5)为减少SO2的排放,常采取的措施有:将煤转化为清洁气体燃料。已知:H2(g)+
 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1。C(s)+
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1。C(s)+ O2(g)=CO(g) ΔH=-110.5 kJ·mol-1。写出焦炭与水蒸气反应的热化学方程式:
O2(g)=CO(g) ΔH=-110.5 kJ·mol-1。写出焦炭与水蒸气反应的热化学方程式:(6)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO
 ,常用作脱氯剂,该反应的离子方程式为
,常用作脱氯剂,该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
3 . 易混易错辨析题组请按要求书写下列离子方程式:
(1)向CuCl2溶液中通入一定量的SO2,微热,一段时间后可得CuCl白色沉淀。离子方程式为___ 。
(2)在FeI2溶液中,滴加少量稀硝酸,该反应的离子方程式是:___ 。
(3)已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入过量H2SO4,溶液立即变黄,试写出该反应的离子方程式:___ 。
(1)向CuCl2溶液中通入一定量的SO2,微热,一段时间后可得CuCl白色沉淀。离子方程式为
(2)在FeI2溶液中,滴加少量稀硝酸,该反应的离子方程式是:
(3)已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入过量H2SO4,溶液立即变黄,试写出该反应的离子方程式:
您最近一年使用:0次
名校
解题方法
4 . Ι.完成下列反应的离子反应方程式
(1)实验室用碳酸钙与盐酸反应制取CO2气体,反应的离子方程式:___________ ;常用澄清石灰水检验CO2气体的离子方程式是___________________________ 。
(2)表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始反应的离子方程式是_______________ ;反应片刻后,可观察到有气体产生,其离子方程式是________________________ 。
(3)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
①用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为___________________ 。
②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为__________ 。
(4)碳酸钙与醋酸反应____________________
(5) NaHCO3 溶液和 NaOH混合________________
书写离子方程式时,哪些物质不能写成离子_____________________
II.配平下列反应
① KMnO4+ K2SO3+ H2O=____ MnO2+____ K2SO4+ KOH_______________ 。
② K2Cr2O7+ KI+ H2SO4= K2SO4+ Cr2(SO4)3+ I2+ H2O______________ 。
氧化还原方程式的配平依据是____________________
(1)实验室用碳酸钙与盐酸反应制取CO2气体,反应的离子方程式:
(2)表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始反应的离子方程式是
(3)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
①用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为
②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为
(4)碳酸钙与醋酸反应
(5) NaHCO3 溶液和 NaOH混合
书写离子方程式时,哪些物质不能写成离子
II.配平下列反应
① KMnO4+ K2SO3+ H2O=____ MnO2+____ K2SO4+ KOH
② K2Cr2O7+ KI+ H2SO4= K2SO4+ Cr2(SO4)3+ I2+ H2O
氧化还原方程式的配平依据是
您最近一年使用:0次
名校
5 . 某学习小组通过实验研究Na2O2与水的反应。
(1)甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在;取少量溶液a,加入试剂____ (填化学式),有气体产生。
(2)乙同学查阅资料获悉:用KMnO4可以氧化H2O2并测定其含量。取20.00mL溶液,用稀H2SO4酸化,用0.002mol/LKMnO4溶液滴定,产生气体,溶液褪色,至终点时共消耗10.00mLKMnO4溶液。
①实验中,滴定时KMnO4溶液应装在____ (酸或碱)式滴定管中。
②配平并用用单线桥标出该反应电子转移的方向和数目:___
MnO +H2O2+H+=Mn2++O2↑+H2O
+H2O2+H+=Mn2++O2↑+H2O
③溶液a中c(H2O2)=____ mol/L。
| 操作 | 现象 |
| 向盛有4.0gNa2O2的烧杯中加入50mL蒸馏水 | 剧列反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
| 向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
(1)甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在;取少量溶液a,加入试剂
(2)乙同学查阅资料获悉:用KMnO4可以氧化H2O2并测定其含量。取20.00mL溶液,用稀H2SO4酸化,用0.002mol/LKMnO4溶液滴定,产生气体,溶液褪色,至终点时共消耗10.00mLKMnO4溶液。
①实验中,滴定时KMnO4溶液应装在
②配平并用用单线桥标出该反应电子转移的方向和数目:
MnO
 +H2O2+H+=Mn2++O2↑+H2O
+H2O2+H+=Mn2++O2↑+H2O③溶液a中c(H2O2)=
您最近一年使用:0次
6 . 硒(Se)是人体必需的微量元素。从铜阳极泥中制备Se涉及的部分化学反应如下:
①2CuAgSe+O2+2H2SO4=Se+ Ag2Se+2CuSO4+2H2O
②SeO2 +4KI+2H2SO4=Se +2I2 +2K2SO4+2H2O
③Se+2H2SO4(浓)=2SO2 ↑+SeO2 +2H2O
④Se+4HNO3(浓)=SeO2 +4NO2↑+2H2O
⑤H2SeO3+2SO2+H2O=Se+2H2SO4
回答下列问题:
(1)反应①的离子方程式为________________ 。
(2)反应②中氧化剂与还原剂的物质的量之比为_______________ 。
(3)反应⑤中转移0.6NA电子,消耗标准状况下SO2的体积为______________ L。
(4)反应③④中等量的Se消耗H2SO4和HNO3的物质的量之比为________________ 。
(5) SeO2、H2SO4(浓) 、I2的氧化性由强到弱的顺序是________________ 。
(6)制备反应之一为5H2SeO3+2KMnO4+3H2SO4=5H2SeO4+ K2SO4+2MnSO4+3H2O,反应后,溶液中的离子浓度如下表:
则SO 的浓度为
的浓度为_______ mol/L。
①2CuAgSe+O2+2H2SO4=Se+ Ag2Se+2CuSO4+2H2O
②SeO2 +4KI+2H2SO4=Se +2I2 +2K2SO4+2H2O
③Se+2H2SO4(浓)=2SO2 ↑+SeO2 +2H2O
④Se+4HNO3(浓)=SeO2 +4NO2↑+2H2O
⑤H2SeO3+2SO2+H2O=Se+2H2SO4
回答下列问题:
(1)反应①的离子方程式为
(2)反应②中氧化剂与还原剂的物质的量之比为
(3)反应⑤中转移0.6NA电子,消耗标准状况下SO2的体积为
(4)反应③④中等量的Se消耗H2SO4和HNO3的物质的量之比为
(5) SeO2、H2SO4(浓) 、I2的氧化性由强到弱的顺序是
(6)制备反应之一为5H2SeO3+2KMnO4+3H2SO4=5H2SeO4+ K2SO4+2MnSO4+3H2O,反应后,溶液中的离子浓度如下表:
| 离子 | H+ | SeO | SO | K+ | Mn2+ |
| 浓度/(mol/L) | 0.2 | 0.15 | ? | 0.3 | 0.3 |
 的浓度为
的浓度为
您最近一年使用:0次
2020-11-06更新
|
103次组卷
|
2卷引用:天津市第八中学2023-2024学年高三上学期第一次大单元教学(9月月考)化学试题
名校
7 . 在工业上次磷酸(H3PO2)常用于化学镀银,发生的反应如下:___Ag++__H3PO2+__H2O→__Ag↓+__H3PO4+__H+
请回答下列问题:
(1)H3PO2中,P元素的化合价为__ ;该反应中,H3PO2被__ (填“氧化”或“还原”)。
(2)配平该离子方程式:__ Ag++__ H3PO2+__ H2O→__ Ag↓+__ H3PO4+__ H+。
(3)H3PO2是一元弱酸,写出其与足量NaOH溶液反应的离子方程式:__ 。
(4)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:在如图有编号的步骤中,发生氧化反应的是__ (填编号,下同),发生还原反应的是__ 。(提示:铬元素化合价有+6、+3价)

(5)一个完整的氧化还原反应方程式可以拆开写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu=2Fe2++Cu2+的拆写结果是:氧化反应为:Cu-2e-=Cu2+;还原反应为:2Fe3++2e−=2Fe2+。请据此将反应:Fe+2H+=Fe2++H2↑拆写成两个“半反应式”:氧化反应为__ ;还原反应为___ 。
请回答下列问题:
(1)H3PO2中,P元素的化合价为
(2)配平该离子方程式:
(3)H3PO2是一元弱酸,写出其与足量NaOH溶液反应的离子方程式:
(4)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:在如图有编号的步骤中,发生氧化反应的是

(5)一个完整的氧化还原反应方程式可以拆开写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu=2Fe2++Cu2+的拆写结果是:氧化反应为:Cu-2e-=Cu2+;还原反应为:2Fe3++2e−=2Fe2+。请据此将反应:Fe+2H+=Fe2++H2↑拆写成两个“半反应式”:氧化反应为
您最近一年使用:0次
8 . I、某同学写出以下三个化学方程式(未配平):
①NO+HNO3→N2O3+H2O
②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是_________________ 。
II、下列三个氧化还原反应中,氧化性最强的物质是________ 。
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③ KMnO4+ HCl(浓) → KCl+ MnCl2+ Cl2↑+ H2O(未配平)
请配平③的化学反应方程式:
__ KMnO4+__ HCl(浓)=__ KCl+__ MnCl2+__ Cl2↑+__ H2O
III、已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O
(1)用双线桥 法分析上述反应(只需标出电子得失的方向和数目)_______
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O
(2)上述反应中氧化剂是___________ ,氧化产物是_____________ 。硝酸没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸占总硝酸的_______ 。
①NO+HNO3→N2O3+H2O
②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是
II、下列三个氧化还原反应中,氧化性最强的物质是
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③ KMnO4+ HCl(浓) → KCl+ MnCl2+ Cl2↑+ H2O(未配平)
请配平③的化学反应方程式:
III、已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O
(1)用
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O
(2)上述反应中氧化剂是
您最近一年使用:0次
2020-11-04更新
|
322次组卷
|
2卷引用:天津市第二十一中学2020-2021学年高一上学期期中检测化学试题
名校
解题方法
9 . 针对以下 四个涉及
四个涉及 的反应(未配平)填空:
的反应(未配平)填空:
A.
B.
C.
D.
(1) 仅体现氧化性的反应是
仅体现氧化性的反应是_______ (填序号,下同), 仅体现还原性的反应是
仅体现还原性的反应是____ , 既体现氧化性又体现还原性的反应是
既体现氧化性又体现还原性的反应是________ , 既不作氧化剂又不作还原剂的反应是
既不作氧化剂又不作还原剂的反应是______ 。
(2)请将 反应配平,并用单线桥标出
反应配平,并用单线桥标出 反应中电子转移的方向和数目:
反应中电子转移的方向和数目:_____
□ □
□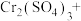 □
□ □
□ □
□ □
□
反应中氧化剂是________ ,被氧化的元素是_____ 。
 四个涉及
四个涉及 的反应(未配平)填空:
的反应(未配平)填空:A.

B.

C.

D.

(1)
 仅体现氧化性的反应是
仅体现氧化性的反应是 仅体现还原性的反应是
仅体现还原性的反应是 既体现氧化性又体现还原性的反应是
既体现氧化性又体现还原性的反应是 既不作氧化剂又不作还原剂的反应是
既不作氧化剂又不作还原剂的反应是(2)请将
 反应配平,并用单线桥标出
反应配平,并用单线桥标出 反应中电子转移的方向和数目:
反应中电子转移的方向和数目:□
 □
□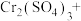 □
□ □
□ □
□ □
□
反应中氧化剂是
您最近一年使用:0次
2020-10-23更新
|
483次组卷
|
2卷引用:天津市大港一中2020-2021学年高一上学期第一次月考化学试题
名校
10 . NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是____________ 。
(2)根据上述反应,鉴别NaNO2和NaCl固体。可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有____________ (填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是____________ (填编号)。
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式:_______ Al+_______NaNO3+_______NaOH=______NaAlO2+_______N2↑+_________。若反应过程中转移5 mol e-,则生成标准状况下N2的体积为________ L。
(1)上述反应中氧化剂是
(2)根据上述反应,鉴别NaNO2和NaCl固体。可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式:
您最近一年使用:0次
2020-10-19更新
|
296次组卷
|
3卷引用:天津市静海区大邱庄中学2021届高三上学期第一次月考化学试题



