名校
解题方法
1 . 氮的化合物研究是环境科学的热点课题之一。
金属与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系下图所示:
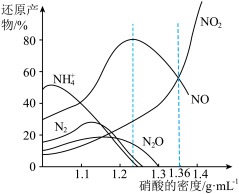
(1)当硝酸溶液的密度为1.36g.cm-3时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是(填序号)________________ 。
A.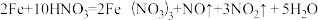
B.
C.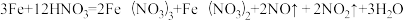
(2)现有一定量铝粉和铜粉的混合物与一定量很稀的硝酸溶液充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5mo/L的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如下图所示:
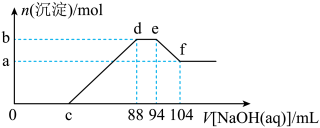
①c点对应NaOH溶液的体积为________________ mL;
②ef段发生反应的离子方程式为________________ 。
(3)研究表明硝酸与金属反应时,最容易生成亚硝酸(HNO2,弱酸),然后才转化成NO2,如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的HNO2再氧化成HNO3,如图为金属在不同浓度的HNO3-H2O2混合溶液中的溶解速率和生成NOx的体积V的变化示意图:

①最佳溶解金属的混合溶液中HNO3的质量分数________________ 。
②H2O2与HNO2反应的化学方程式为________________ 。
(4)NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NOx的储存和还原在不同时段交替进行,如图1所示:若用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。

①根据图1分析可以得出BaO的作用是________________ 。
②根据图2分析用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,第一步反应的化学方程为________________ 。
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有O2条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。请写出该反应的化学方程式________________ 。
金属与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系下图所示:

(1)当硝酸溶液的密度为1.36g.cm-3时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是(填序号)
A.
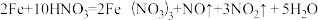
B.

C.
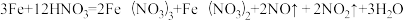
(2)现有一定量铝粉和铜粉的混合物与一定量很稀的硝酸溶液充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5mo/L的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如下图所示:

①c点对应NaOH溶液的体积为
②ef段发生反应的离子方程式为
(3)研究表明硝酸与金属反应时,最容易生成亚硝酸(HNO2,弱酸),然后才转化成NO2,如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的HNO2再氧化成HNO3,如图为金属在不同浓度的HNO3-H2O2混合溶液中的溶解速率和生成NOx的体积V的变化示意图:

①最佳溶解金属的混合溶液中HNO3的质量分数
②H2O2与HNO2反应的化学方程式为
(4)NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NOx的储存和还原在不同时段交替进行,如图1所示:若用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。

①根据图1分析可以得出BaO的作用是
②根据图2分析用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,第一步反应的化学方程为
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有O2条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。请写出该反应的化学方程式
您最近一年使用:0次
名校
2 . 按要求完成下列问题
(1)写出足量 与
与 的离子反应方程式
的离子反应方程式_______ 。
(2) 与过量
与过量 反应的离子反应方程式
反应的离子反应方程式_______ 。
(3)配平该反应_______ 。
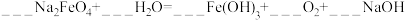
(4)_______ 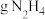 所含原子数与
所含原子数与 含原子数相同。
含原子数相同。
(1)写出足量
 与
与 的离子反应方程式
的离子反应方程式(2)
 与过量
与过量 反应的离子反应方程式
反应的离子反应方程式(3)配平该反应
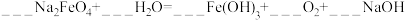
(4)
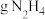 所含原子数与
所含原子数与 含原子数相同。
含原子数相同。
您最近一年使用:0次
3 . 按要求填空:
(1)25℃,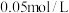 硫酸溶液中,酸电离出的
硫酸溶液中,酸电离出的 约为水电离出的
约为水电离出的 的
的______ 倍。
(2)25℃时,将 的稀硫酸
的稀硫酸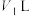 与
与 的苛性钠溶液
的苛性钠溶液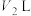 混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的
混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的 ,则
,则
___________ 。
(3)常温下,向 的乙酸溶液中加入少量蒸馏水稀释,则溶液中
的乙酸溶液中加入少量蒸馏水稀释,则溶液中 的数目将
的数目将________ , 将
将_________ (填“变大”、“变小”或“不变”)。
(4)室温时,碳酸的电离常数为 、
、 ,则当某溶液
,则当某溶液 时,
时,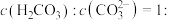
___________ ;已知次氯酸的电离平衡常数 和碳酸的电离平衡常数关系为
和碳酸的电离平衡常数关系为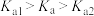 ,请写出向
,请写出向 溶液中通入少量
溶液中通入少量 的离子反应方程式
的离子反应方程式___________ 。
(5) 俗称大苏打,在与稀硫酸溶液混合时会产生沉淀及易溶于水的气体,该反应可用来探究化学反应速率的影响因素,请写出该化学反应方程式
俗称大苏打,在与稀硫酸溶液混合时会产生沉淀及易溶于水的气体,该反应可用来探究化学反应速率的影响因素,请写出该化学反应方程式___________ 。
(1)25℃,
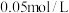 硫酸溶液中,酸电离出的
硫酸溶液中,酸电离出的 约为水电离出的
约为水电离出的 的
的(2)25℃时,将
 的稀硫酸
的稀硫酸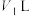 与
与 的苛性钠溶液
的苛性钠溶液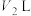 混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的
混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的 ,则
,则
(3)常温下,向
 的乙酸溶液中加入少量蒸馏水稀释,则溶液中
的乙酸溶液中加入少量蒸馏水稀释,则溶液中 的数目将
的数目将 将
将(4)室温时,碳酸的电离常数为
 、
、 ,则当某溶液
,则当某溶液 时,
时,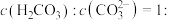
 和碳酸的电离平衡常数关系为
和碳酸的电离平衡常数关系为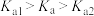 ,请写出向
,请写出向 溶液中通入少量
溶液中通入少量 的离子反应方程式
的离子反应方程式(5)
 俗称大苏打,在与稀硫酸溶液混合时会产生沉淀及易溶于水的气体,该反应可用来探究化学反应速率的影响因素,请写出该化学反应方程式
俗称大苏打,在与稀硫酸溶液混合时会产生沉淀及易溶于水的气体,该反应可用来探究化学反应速率的影响因素,请写出该化学反应方程式
您最近一年使用:0次
名校
4 . Ⅰ. 可用作清洁剂、防腐剂等。请按要求回答下列问题:
可用作清洁剂、防腐剂等。请按要求回答下列问题:
(1)下列关于 的说法正确的是______。
的说法正确的是______。
(2)将 溶液滴加到
溶液滴加到 溶液中至溶液呈中性时,发生反应的离子方程式为
溶液中至溶液呈中性时,发生反应的离子方程式为______ 。
Ⅱ.请按要求回答下列问题:
(3) 溶液与
溶液与 溶液反应的离子方程为
溶液反应的离子方程为______ 。
(4)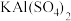 的电离方程式
的电离方程式______ 。
(5)工业上制取 用
用 与C、
与C、 在高温条件下反应,生成两种化合物,其中一种是还原性气体且有毒性,该反应的化学方程式是
在高温条件下反应,生成两种化合物,其中一种是还原性气体且有毒性,该反应的化学方程式是______ 。
(6)反应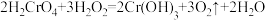 中
中 的变化
的变化
①该反应的氧化产物是______ (填化学式)。
②在该反应方程式中用单线桥法标明电子转移的方向和数目______ 。
 可用作清洁剂、防腐剂等。请按要求回答下列问题:
可用作清洁剂、防腐剂等。请按要求回答下列问题:(1)下列关于
 的说法正确的是______。
的说法正确的是______。A. 固体能导电 固体能导电 |
B. 溶液的导电性一定强于 溶液的导电性一定强于 溶液 溶液 |
C. 属于强电解质 属于强电解质 |
D. 溶液显酸性 溶液显酸性 |
 溶液滴加到
溶液滴加到 溶液中至溶液呈中性时,发生反应的离子方程式为
溶液中至溶液呈中性时,发生反应的离子方程式为Ⅱ.请按要求回答下列问题:
(3)
 溶液与
溶液与 溶液反应的离子方程为
溶液反应的离子方程为(4)
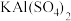 的电离方程式
的电离方程式(5)工业上制取
 用
用 与C、
与C、 在高温条件下反应,生成两种化合物,其中一种是还原性气体且有毒性,该反应的化学方程式是
在高温条件下反应,生成两种化合物,其中一种是还原性气体且有毒性,该反应的化学方程式是(6)反应
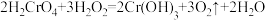 中
中 的变化
的变化
①该反应的氧化产物是
②在该反应方程式中用单线桥法标明电子转移的方向和数目
您最近一年使用:0次
名校
5 . 氮的化合物研究是环境科学的热点课题之一。
(1)锌与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系如图1所示,下列说法不正确的是_______ (填序号)。

A.一般来说,不同密度硝酸与锌反应的还原产物不是单一的
B.足量锌与一定量密度为1.36g/mL的硝酸反应,还原产物始终是NO和NO2
C.硝酸的密度越大,其还原产物中高价态的成分所占比例越多
(2)某容器中发生一个化学反应,已知反应物和生成物是由Fe2+、NO 、Fe3+、NH
、Fe3+、NH 、H+和H2O六种粒子组成的。在反应过程中测得Fe3+、NO
、H+和H2O六种粒子组成的。在反应过程中测得Fe3+、NO 的含量随时间变化的曲线如图2所示,该反应氧化剂为
的含量随时间变化的曲线如图2所示,该反应氧化剂为_______ (填写粒子符号),写出该反应的离子方程式_______ 。

(3)向空气中排放NO2会破坏臭氧层,同时NO2转化成N2O5并放出O2,还原产物是________ (填化学式),写出反应的化学方程式,并用单线桥法标出该反应电子转移的方向和数目_______ 。
(4)如图3是氮氧化物NOx的储存还原的工作原理:NOx的储存过程与还原过程在不同时刻是交替进行的。若还原过程中还原性气体为H2,则参加反应的H2与生成的N2的质量之比为_________ 。

(5)在铂原子表面H2还原NO的历程如图4所示。

在Pt-HY界面生成N2O的反应化学方程________ 。
(1)锌与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系如图1所示,下列说法不正确的是

A.一般来说,不同密度硝酸与锌反应的还原产物不是单一的
B.足量锌与一定量密度为1.36g/mL的硝酸反应,还原产物始终是NO和NO2
C.硝酸的密度越大,其还原产物中高价态的成分所占比例越多
(2)某容器中发生一个化学反应,已知反应物和生成物是由Fe2+、NO
 、Fe3+、NH
、Fe3+、NH 、H+和H2O六种粒子组成的。在反应过程中测得Fe3+、NO
、H+和H2O六种粒子组成的。在反应过程中测得Fe3+、NO 的含量随时间变化的曲线如图2所示,该反应氧化剂为
的含量随时间变化的曲线如图2所示,该反应氧化剂为
(3)向空气中排放NO2会破坏臭氧层,同时NO2转化成N2O5并放出O2,还原产物是
(4)如图3是氮氧化物NOx的储存还原的工作原理:NOx的储存过程与还原过程在不同时刻是交替进行的。若还原过程中还原性气体为H2,则参加反应的H2与生成的N2的质量之比为

(5)在铂原子表面H2还原NO的历程如图4所示。

在Pt-HY界面生成N2O的反应化学方程
您最近一年使用:0次
名校
解题方法
6 . 元素化合物在化工生产和环境科学中有着重要的用途。
(1)向NH4Al(SO4)2溶液中逐滴加入稀NaOH溶液至过量,反应的离子方程式依次为__________ 。
(2)自然界中Cr主要以+3价和+6价形式存在。 中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将
中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将 还原。写出该反应的离子方程式:
还原。写出该反应的离子方程式:___________ 。
(3)常温下,氰化钠(NaCN)能与过氧化氢溶液反应生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。写出该反应的离子方程式:___________ 。
(4)向次氯酸钙溶液中通入少量的二氧化硫。写出该反应的离子方程式:___________ 。
(5)溴化亚铁与氯气物质的量之比1:1反应的离子方程式:___________ 。
(1)向NH4Al(SO4)2溶液中逐滴加入稀NaOH溶液至过量,反应的离子方程式依次为
(2)自然界中Cr主要以+3价和+6价形式存在。
 中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将
中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将 还原。写出该反应的离子方程式:
还原。写出该反应的离子方程式:(3)常温下,氰化钠(NaCN)能与过氧化氢溶液反应生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。写出该反应的离子方程式:
(4)向次氯酸钙溶液中通入少量的二氧化硫。写出该反应的离子方程式:
(5)溴化亚铁与氯气物质的量之比1:1反应的离子方程式:
您最近一年使用:0次
名校
7 . 回答下列问题:
(1)①漂白液工作原理的化学方程式:___________
②向足量的Ca(HCO3)2溶液中滴加少量NaOH反应的离子方程式为:___________
③向Ba(OH)2溶液中滴加硫酸氢钠至溶液成中性的离子方程式为:___________
(2)已知NaH2PO2为正盐,可将溶液中的Ag+还原为Ag。
①H3PO2为___________ 元酸,H3PO2中,磷元素的化合价为___________ 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为:___________ (填化学式)
③H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式:___________ 。
(3)生产硫化钠大多采用无水芒硝(Na2SO4)——碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,煅烧时发生反应的化学方程式为___________
(4)已知在酸性介质中FeSO4能将+6价铬还原成+3价铬。写出 与FeSO4在酸性条件下反应的离子方程式:
与FeSO4在酸性条件下反应的离子方程式:___________
(1)①漂白液工作原理的化学方程式:
②向足量的Ca(HCO3)2溶液中滴加少量NaOH反应的离子方程式为:
③向Ba(OH)2溶液中滴加硫酸氢钠至溶液成中性的离子方程式为:
(2)已知NaH2PO2为正盐,可将溶液中的Ag+还原为Ag。
①H3PO2为
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为:
③H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式:
(3)生产硫化钠大多采用无水芒硝(Na2SO4)——碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,煅烧时发生反应的化学方程式为
(4)已知在酸性介质中FeSO4能将+6价铬还原成+3价铬。写出
 与FeSO4在酸性条件下反应的离子方程式:
与FeSO4在酸性条件下反应的离子方程式:
您最近一年使用:0次
名校
8 . 分析以下A-D四个涉及H2O2的反应(未配平),填空
A.
B.
C.
D.
(1)H2O2仅体现氧化性的反应是___________ ,H2O2仅体现还原性的反应是___________ ,H2O2既体现氧化性,又体现氧化性的反应是___________ ,H2O2既不作氧化剂又不作还原剂的反应是___________ (填字母)。
(2)用单线桥法表示D反应中电子转移的方向和数目:
①
___________ ,该反应中氧化剂是___________ ,氧化产物是___________
②配平反应:
___________
A.

B.

C.

D.

(1)H2O2仅体现氧化性的反应是
(2)用单线桥法表示D反应中电子转移的方向和数目:
①

②配平反应:

您最近一年使用:0次
9 . 高铁酸钠(Na2FeO4)是水处理过程中常用的一种新型净水剂,在反应中被还原成Fe3+离子,工业上常用NaClO氧化Fe(OH)3生产高铁酸钠:Fe(OH)3 + NaClO + NaOH→ Na2FeO4 + NaCl + H2O。完成下列填空:
(1)配平上述化学方程式_______ 。
(2)若制备过程中消耗了0.15mol NaClO,则转移的电子数目是_______ 。
(3)高铁酸钠之所以能净水,除了能杀菌消毒外,另一个原因是(结合离子方程式回答)_______ 。
(4)生产高铁酸钠的另一种方法是电解法,原理是Fe+2NaOH+2H2O=Na2FeO4+3H2↑,则电解过程中Fe在_______ 。(选填编号)
A.阳极发生氧化反应 B.阴极发生还原反应 C.阳极发生还原反应 D.阴极发生氧化反应
(5)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH—未列出):
表格中的a_______ 0.16(填“>”、“<”或“=”),判断的理由是_______ 。
(1)配平上述化学方程式
(2)若制备过程中消耗了0.15mol NaClO,则转移的电子数目是
(3)高铁酸钠之所以能净水,除了能杀菌消毒外,另一个原因是(结合离子方程式回答)
(4)生产高铁酸钠的另一种方法是电解法,原理是Fe+2NaOH+2H2O=Na2FeO4+3H2↑,则电解过程中Fe在
A.阳极发生氧化反应 B.阴极发生还原反应 C.阳极发生还原反应 D.阴极发生氧化反应
(5)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH—未列出):
| 离子 | SO | Mg2+ | Fe3+ | Na+ | Cl— |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
表格中的a
您最近一年使用:0次
10 . 化合物甲和NaAlH4都是重要的还原剂。一定条件下金属钠和H2反应生成甲。甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。将4.80g甲加热至完全分解,得到金属钠和2.24L(已折算成标准状况)的H2。请推测并回答:
(1)NaAlH4中H元素化合价为___________ 。甲的化学式___________ 。
(2)甲与AlCl3反应得到NaAlH4的化学方程式___________ 。
(3)甲与水反应时,1mol甲可以转移电子个数为___________ 。
(1)NaAlH4中H元素化合价为
(2)甲与AlCl3反应得到NaAlH4的化学方程式
(3)甲与水反应时,1mol甲可以转移电子个数为
您最近一年使用:0次



